高纯度难消化糊精的制备工艺及其特性研究
张 颖,朱晓雯,钱 和,姚卫蓉
(江南大学食品学院,江苏无锡214000)
高纯度难消化糊精的制备工艺及其特性研究
张颖,朱晓雯,钱和,姚卫蓉*
(江南大学食品学院,江苏无锡214000)
研究了高纯度难消化糊精的制备工艺及其特性。以玉米淀粉为原料,经过高温酸解得到焦糊精,再酶解、浓缩,采用酒精沉淀的方法得到难消化糊精后用酒精洗去葡萄糖,制备高纯度难消化糊精。结果表明最佳工艺条件为:加酸量为12%,焦糊化温度为180℃,焦糊化时间为0.5h,酒精洗涤次数为6次,此时高纯度难消化糊精得率可达40.32%,纯度可达95.30%。并测定了高纯度难消化糊精的分子量分布和热特性分析,重均分子量为8607u,热稳定性高。本文为其在各类食品中的应用奠定了一定基础。
难消化糊精,高纯度,工艺,特性
膳食纤维具有改善人体肠道菌群,改善血糖和脂肪代谢,降低血清胆固醇,促进矿物质吸收等生理功能[1]。难消化糊精属于低分子可溶性膳食纤维[2]。1989年在日本,松谷化学工业株式会社开发出了难消化糊精,因其具有多种生理功效而取得日本政府特定保健食品原料的认定[3]。在我国,难消化糊精的研究在二十世纪九十年代中后期才开始。2005年,江南大学的Oumar博士利用酵母菌发酵的方法制备纯化难消化糊精,使得终产品的纯度达到94%[4]。2007年,广东省食品研究所申请了一种难消化糊精的制备方法的专利,这个专利利用普鲁兰酶代替传统方法中的糖化酶制备难消化糊精[5]。2009年,江南大学的滕健硕士利用微波法制备难消化糊精,但纯度不高[6]。2010年保龄宝生物股份有限公司申请了一种新型抗消化糊精的制备方法,该专利采用酶制剂直接转化生产,使最终产品中有效成分含量达到90%以上[7]。
酒精沉淀已被用于提取葛仙米多糖[8],从猕猴桃皮渣中提取果胶[9],从海红果皮渣中提取果胶[10],从胡萝卜渣中提取食用果胶[11],生产硫酸软骨素[12]等的多糖工艺研究中。在酶解过程中会产生游离葡萄糖,导致最终产品的纯度很低。因此本文以玉米淀粉为原料,酸热解得到焦糊精,酶解除去焦糊精中的淀粉及其他糊精,用酒精沉淀的方法得到难消化糊精。测定高纯度难消化糊精的分子量分布和热特性为其在各类食品中的应用做好铺垫。
1 材料与方法
1.1材料与仪器
玉米淀粉山东祥瑞药业有限公司;浓盐酸(AR) 国药集团化学试剂有限公司;氢氧化钠(AR)
国药集团化学试剂有限公司;乙醇(AR) 国药集团化学试剂有限公司;耐高温α-淀粉酶无锡杰能科酶制剂公司(酶活:2万u/mL);葡萄糖淀粉酶无锡杰能科酶制剂公司(酶活:10万u/g);碱性蛋白酶(Alcalase2.4L)诺维信生物技术有限公司;磷酸二氢钠、磷酸氢二钠、丙酮AR,国药集团化学试剂有限公司。
SYH型捏合机南通范氏机械厂;JB90-D型强力电动搅拌机上海标本模型厂;THZ-82型水浴恒温振荡器国华企业;HHS型电热恒温水浴锅上海医疗机械五厂;DGG-9123AD型电热恒温鼓风干燥箱上海森信实验仪器有限公司;PHS-3C型酸度计上海埃依琪实业有限公司;R-501型旋转蒸发器上海申顺生物科技有限公司;SHB型循环水式多用真空泵郑州长城科工贸有限公司;差示扫描量热仪美国TA仪器有限公司;高效液相凝胶过滤色谱仪美国Waters公司。
1.2实验方法
1.2.1难消化糊精制备工艺过程普通玉米淀粉→加酸搅拌→预干燥→焦糊化→液化→去蛋白→糖化→脱色→浓缩→酒精沉淀→酒精洗涤→干燥→高纯度难消化糊精
将普通玉米淀粉加1%的盐酸加热搅拌,预干燥后,高温热解生成焦糊精。将焦糊精用耐高温α-淀粉酶、糖化酶、碱性蛋白酶酶解,再经过活性炭脱色,浓缩之后用4倍酒精沉淀,再用酒精洗涤干燥之后制得高纯度难消化糊精。
1.2.2高纯度难消化糊精的制备工艺影响因素研究
1.2.2.1加酸量对难消化糊精得率的影响在500g普通玉米淀粉中加入1%的盐酸,加酸量为6%、9%和12%。在捏合机内室温搅拌1h,边搅拌边升温到110℃控制水分小于5%,再次边搅拌边升温到180℃,反应0.5h。加水调浆,用NaOH调pH至6.0,加入0.1%耐高温α-淀粉酶在95℃反应2h。继续用1mol/L NaOH调节pH至5.8,加入0.05%的碱性蛋白酶在60℃反应1h。再用1mol/L HCl调节pH至4.5,加入0.1%的糖化酶在60℃搅拌下反应36h。糖化液用4倍体积预热至60℃的95%乙醇沉淀,放置到105℃的烘箱中干燥。计算难消化糊精得率。
1.2.2.2焦糊化温度对难消化糊精得率的影响在500g普通玉米淀粉中加入1%的盐酸,加酸量12%。在捏合机内室温搅拌1h,边搅拌边升温到110℃控制水分小于5%,再次边搅拌边升温到140、160、180和200℃,反应0.5h。后续反应同1.2.2.1。计算难消化糊精得率。
1.2.2.3焦糊化时间对难消化糊精得率的影响在500g普通玉米淀粉中加入1%的盐酸,加酸量12%。在捏合机内室温搅拌1h,边搅拌边升温到110℃控制水分小于5%,再次边搅拌边升温到180℃,反应0.5、1、1.5、2和2.5h。后续反应同1.2.2.1。计算难消化糊精得率。
1.2.2.4酒精洗涤次数对难消化糊精得率和纯度的影响糖化反应后的糖化液按4∶1的比例浓缩后,加入4倍体积预热至60℃的95%乙醇沉淀。再加一倍体积的78%酒精加热搅拌洗涤3、4、5、6次,放置到105℃的烘箱中干燥。计算难消化糊精得率和纯度。
1.2.2.5玉米淀粉原料对难消化糊精得率和纯度的影响在500g普通玉米淀粉、蜡质玉米淀粉、高直链玉米淀粉中各加入1%的盐酸,加酸量12%。在捏合机内室温搅拌1h,边搅拌边升温到110℃控制水分小于5%,再次边搅拌边升温到190℃,反应0.5h。糖化反应后的糖化液按4∶1的比例浓缩后,加入4倍体积预热至60℃的95%乙醇沉淀。再加一倍体积的78%酒精加热搅拌洗涤3、4、5、6次,放置到105℃的烘箱中干燥。计算难消化糊精得率和纯度。
1.2.3难消化糊精得率和纯度测定方法难消化糊精的纯度测定参照国标GB/T22224-2008食品中膳食纤维的测定-酶重量法。
难消化糊精的得率(%)=干燥后的物质重量/反应前玉米淀粉的重量×100
1.2.4高纯度难消化糊精的分子量分布测定方法色谱条件为:色谱柱:UltrahydrogelTMLinear 300mm× 7.8mm;流动相:0.1mol/L NaNO3;流速:0.9mL/min;柱温:45℃;样品制备:样品溶解于流动相(20%CH3CN+ 80%H2O)中,用微孔过滤膜过滤后进样。
1.2.5玉米淀粉和高纯度难消化糊精的热特性分析测定方法采用差示扫描量热仪测定玉米淀粉和抗性麦芽糊精的热特性。主要实验步骤如下:准确称取一定量的样品(按干基计)于坩埚中,加入去离子水(绝干样品∶水=1∶2,W/W),坩埚加盖压紧密封,在4℃冰箱内平衡24h,仪器通N2速率50mL/min,以空皿作为参比,然后以10℃/min的速率升温,温度从30℃到120℃。

图1 加酸量对难消化糊精得率的影响Fig.1 Effect of the amount of acid added on indigestible dextrin yield
2 结果与讨论
2.1加酸量对难消化糊精得率的影响
不同加酸量的难消化糊精得率见图1。由图1可以看出,随着加酸量的增加,难消化糊精的得率也在增加。这是因为酸量的增加有利于淀粉大分子降解成小分子,这些小分子重新聚合,生成不能被α-淀粉酶和糖化酶降解的成分。显然在加酸量为12%时,难消化糊精的得率最高。但在实验中发现,当加酸量超过12%时,焦糊精的颜色很深不利于后续步骤的脱色。因此,难消化糊精生产过程加酸量为12%最合适。
2.2焦糊化温度对难消化糊精得率的影响
不同焦糊化温度的难消化糊精得率见图2。由图2可以看出,随着温度的升高,难消化糊精的得率也在增加。这种情况的出现主要是由于在酸和热的作用下淀粉分子降解产生一些单糖、双糖、低聚糖以及小分子糊精,而在高温下这些小分子会重新聚合。重新聚合的葡萄糖分子间不再是α-1,4糖苷键和α-1,6糖苷键,而有可能生成α-1,2、α-1,3糖苷键,并在部分还原末端上有分子内脱水的缩葡聚糖和β-1,6的结构存在[13]。除直链部分外还有许多不规则结构。这些键不能或很难被α-淀粉酶和糖化酶降解,因此使难消化糊精的得率增加。但实验中发现,在200℃以上热处理时,焦糊精的颜色为棕褐色,不利于脱色,且味道呈焦苦味,不利于其在食品中应用。在制备难消化糊精时,选择焦糊化温度为180℃。

图2 焦糊化温度对难消化糊精得率的影响Fig.2 Effect of pyrolysis temperature on indigestible dextrin yield
2.3焦糊化时间对难消化糊精得率的影响
不同焦糊化时间的难消化糊精得率见图3。由图3可以看出,随着反应时间的延长,难消化糊精的得率也在增加。但是反应时间1.5~2.5h的增加并不明显。这是因为在热处理的最初阶段,发生的主要是淀粉分子在酸热条件下的降解作用,而在高温下,随着这些小分子量的成分增加,又发生了小分子的重聚反应。但是反应时间过长,会影响最终产品的颜色。考虑到生产效率和成本的问题,焦糊化时间为0.5h最合适。

图3 焦糊化时间对难消化糊精得率的影响Fig.3 Effect of pyrolysis time on indigestible dextrin yield
2.4酒精洗涤次数对难消化糊精得率和纯度的影响
不同洗涤次数的难消化糊精得率和纯度见图4。由图4可以看出,随着洗涤次数的增加,难消化糊精的得率逐渐降低,纯度逐渐增加。这是因为78%酒精可以洗去酶解过程中产生的游离葡萄糖。洗涤次数越多,葡萄糖越少,纯度越高。但是在洗涤过程中也会有不可避免的损失,导致得率逐渐降低。因此,确定酒精洗涤次数为6次时,此时难消化糊精的得率为40.32%,纯度为95.30%。

图4 酒精洗涤次数对难消化糊精得率和纯度的影响Fig.4 Effect of alcohol washing times on yield and purity of indigestible dextrin
2.5玉米淀粉原料对难消化糊精得率和纯度的影响
玉米淀粉原料对难消化糊精得率和纯度的影响见表1。由表1可以看出,在同一处理条件下,以普通(祥瑞)玉米淀粉和蜡质玉米淀粉为原料制备的难消化糊精得率和纯度相差不大。以高直链淀粉为原料制备的难消化糊精的得率比较高,但纯度很低。这可能与高直链淀粉中的直链淀粉含量有关[14]。考虑到成本的问题,所以选用最普通的玉米淀粉作为反应原料。

表1 原料对难消化糊精得率和纯度的影响Table 1 Effect of raw materials on yield and purity of indigestible dextrin
2.6高纯度难消化糊精的分子量分布
高纯度难消化糊精的分子量分布如图5所示,玉米淀粉经过酸热处理后的高纯度难消化糊精只在保留时间为22.493min出现了一个明显的主峰,说明其改性很彻底,纯度很高,几乎不存在小分子单糖。
从表2中可以看出,高纯度难消化糊精的数均分子量为2921u,重均分子量为8607u,峰值分子量为3083u。已有文献表明,采用GPC的方法得到的玉米淀粉的重均分子量为2.744×107u,数均分子量为1.040×107u[15]。
2.7玉米淀粉和高纯度难消化糊精的热特性分析
玉米淀粉的DSC如图6所示,从图6中可以看出,玉米淀粉的起始糊化温度(T0)为67℃,峰值温度(TP)为72℃,终了温度(TC)为78℃。如图7所示,以玉米淀粉为原料制备的高纯度难消化糊精在72℃没有出现相转变峰,说明淀粉的结构已不复存在。说明淀粉经过酸热处理后,破坏了玉米淀粉原有的结构。已有文献表明其分子间可能形成α-1,2、α-1,3糖苷键,并在部分还原末端上有分子内脱水的缩葡聚糖和β-1,6的结构存在,其在常压下不会出现相转变。所以将高纯度难消化糊精作为膳食纤维添加到食品中不会改变其结构,其抗性依然存在。

表2 高纯度难消化糊精的分子量分布参数Table 2 Molecular weight distribution parameters of high purity indigestible dextrin

图5 高纯度难消化糊精的分子量分布Fig.5 Molecular weight distribution of high purity indigestible dextrin

图6 玉米淀粉的DSC图Fig.6 DSC-thermogram of corn starch
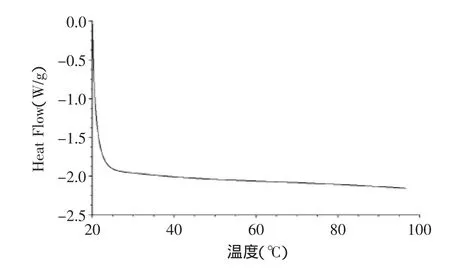
图7 高纯度难消化糊精的DSC图Fig.7 DSC-thermogram of high purity indigestible dextrin
3 结论
用1%(w/w)盐酸与玉米淀粉混合,加酸量为12%,预干燥后,在180℃下焦糊化反应0.5h后,加1.5倍体积水调浆再酶解,糖化液浓缩后用4倍体积的95%酒精沉淀制备难消化糊精。然后再用一倍体积的78%酒精反复搅拌洗涤6次,洗去葡萄糖,使难消化糊精的纯度达到95.30%,得率达到40.32%。高纯度难消化糊精的数均分子量为2921u,重均分子量为8607u,峰值分子量为3083u,热稳定性高,玉米淀粉的结构已不复存在,其作为低分子可溶性膳食纤维可用于生产实践。
[1]寇秀颖,黄冬冬,王三永,等.难消化糊精及其制备工艺[J].食品科技,2007,32(9):50-52.
[2]Brouns F,Arrigoni E,Langkilde A M.Physiological and Metabolic Properties of aDigestion-Resistant Maltodextrin,Classified as Type 3 Retrograded Resistant Starch[J].Journal of Agricultural and Food Chemistry,2007,55(4):1574-1581.
[3]大隈一裕,西端丰秀.水溶性膳食纤维Fibersol-2[J].中国食品添加剂,2003(5):11-16.
[4]BANGOURA A O.Fibersol-2的制备及其生理功能的研究[D].无锡:江南大学,2005.
[5]黄冬冬,寇秀颖,李春荣,等.一种抗性麦芽糊精的制备工艺:中国,CN1908017A[P].2006.
[6]滕健.微波法抗性麦芽糊精的制备及其性质和应用的研究[D].无锡:江南大学,2009.
[7]周焕霞.抗性糊精的特性、功能及市场前景[J].发酵科技通讯,2011,40(4):54-56.
[8]莫开菊,谢笔均,汪兴平,等.葛仙米多糖的提取、分离与纯化技术研究[J].食品科学,2004,25(10):103-108.
[9]王满力,吴英华,吴惠芳.从猕猴桃皮渣中提取果胶的工艺研究[J].食品科技,2003(3):85-86.
[10]刘步明,曹艳萍.从海红果皮渣中提取果胶的工艺研究[J].食品科学,2005,26(8):191-193.
[11]陈改荣.胡萝卜果胶最佳萃取工艺条件的研究[J].河南化工,1996(8):18-20.
[12]高华,刘坤,于兹东,等.硫酸软骨素生产新工艺研究[J].青岛大学学报(工程技术版),2003,18(4):55-58.
[13]大隈一裕,刘凌.难消化糊精Fibersol-2的保健功效[J].中国食物与营养,2002(1):50-52.
[14]Wang YJ,Delgado GA,Kozlowski R.Enzyme resistant dextrins from high amylose corn mutant starches[J].STARCH-STARKE,2001,53(1):21-26.
[15]张攀峰,陈玲,李琳,等.不同直链/支链比的玉米淀粉分子质量及其构象[J].食品科学,2010,31(19):157-160.
Study on preparation process and properties of high purity indigestible dextrin
ZHANG Ying,ZHU Xiao-wen,QIAN He,YAO Wei-rong*
(Department of Food,Jiangnan University,Wuxi 214000,China)
It was described the preparation and properties of high purity indigestible dextrin.The corn starch was acidhydrolyzed under 180℃for 0.5h by adding 12%(V/W)HCl solution(1%W/W)firstly,and then mixed with 10 folds water(V/W)and enzymolyzed by amylase and glucoamylase.The hydrolysis was concentrated under vacuum and then precipitated with ethanol to be purified,the precipitation for 6 times was the production of indigestible dextrin and the yield was 40.32%and the purity was 95.30%.Analysis of molecular weight distribution and DSC-thermogram of high purity indigestible dextrin were studied,the results showed the high thermal stability and the heavy molecular weight was 8607u,which provided some information for its application in all kinds of food.
indigestible dextrin;high purity;preparation process;properties
TS201.1
B
1002-0306(2015)10-0293-04
10.13386/j.issn1002-0306.2015.10.053
2014-08-29
张颖(1990-),女,硕士,研究方向:食品安全与质量控制。
姚卫蓉(1970-),女,博士,教授,研究方向:食品安全与质量控制。

