三种物理法辅助蛋白酶水解合浦珠母贝蛋白的效果评价
吴燕燕,王 晶,2,李来好
(1.中国水产科学研究院南海水产研究所,农业部水产品加工重点实验室,广东广州510300;2.上海海洋大学食品学院,上海201306)
三种物理法辅助蛋白酶水解合浦珠母贝蛋白的效果评价
吴燕燕1,王晶1,2,李来好1
(1.中国水产科学研究院南海水产研究所,农业部水产品加工重点实验室,广东广州510300;2.上海海洋大学食品学院,上海201306)
目的:研究了微波法(W)、超声法(U)与传统水浴法(H)3种模式辅助7种常用酶(Alcalase 2.4L蛋白酶、菠萝蛋白酶、木瓜蛋白酶、胰蛋白酶、风味蛋白酶、胃蛋白酶和枯草蛋白酶)酶解合浦珠母贝蛋白的效果。方法:通过RPHPLC法与Tricine-SDS-PAGE电泳实验,结合水解度、DPPH·清除率、·OH自由基清除率等评价指标。结果:物理辅助酶解能有效促进水解,微波结合木瓜蛋白酶、胰蛋白酶和枯草蛋白酶处理,其作用效果优于超声波法和传统水浴法;Alcalase 2.4L蛋白酶与复合风味蛋白酶在三种辅助模式下相似。结论:综合各指标结果得出,微波助解合浦珠母贝蛋白最佳的酶为Alcalase 2.4L蛋白酶与复合风味蛋白酶。
合浦珠母贝蛋白,物理法辅助酶解,水解效果
合浦珠母贝(Pinctada Fucata)为我国海水珍珠的主要母贝,主产于我国的海南、广东、广西海域,以广西合浦所产最为著名。其通常附着生活在水质澄清有珊瑚礁或多沙砾的浅海底,养殖产量大。然而收珠后的贝肉市场,其产品附加值利用较低。合浦珠母贝肉具有很高的营养价值,富含蛋白质、多种不饱和脂肪酸、矿物质和维生素等多种营养物质。此外,还可利用栅栏技术优化即食调味工艺,作为海鲜调味品上市[1],其酶解产物还具有抗氧化功能,可减少机体内的氧自由基、羟自由基从而达到抗氧化、防衰老的功能[2]。
物理助解包括微波和超声波辅助酶解蛋白,微波是无线电波,频率较高为300MHz~3000GHz,被称为超高频电磁波。水和食物会吸收微波使自身发热,可加快化学反应的速率。微波辅助酶解的工艺近几年也不断被报道,Pramanik B等[3]实验证明微波可促进酶解进行,提高酶解效率。窦文超等[4]利用微波辅助酶解蛋白质,有效提高速率,将酶解从十几小时缩短为全水解的20min时间。超声波是频率在20kHz以上,其在介质中传播会产生热效应、机械效应和空化效应[5]。目前,超声波为生物技术与食品的传统加工带来了方法升级更新。水浴酶解是传统的酶解工艺,具有水解简便、稳定和条件温和的特点,但针对一些蛋白的酶解效率较低。
本文以微波、超声波与水浴3种模式分别辅助7种酶来酶解合浦珠母贝蛋白,在几种酶各自适宜的条件下,以微波和超声波为主,与水浴对比,进一步确认物理助解的影响,为工业化生产天然抗氧化剂提供海洋资源和技术支持。

表1 7种酶的最佳酶解条件Table 1 The optimal conditions of hydrolysis by seven kinds of enzymes
1 材料与方法
1.1材料与仪器
合浦珠母贝肉经开珠后取其新鲜的贝肉,冻藏,购于海南养殖基地;Alcalase 2.4L蛋白酶(酶活力20万U/g) 丹麦诺维信公司;木瓜蛋白酶(酶活力80万U/g,CAS:9001-73-1,BR)、胃蛋白酶(酶活力1.5万NFU/mg,CAS:9001-75-6,BR)、菠萝蛋白酶(酶活力30万U/g,CAS:9001-00-7,BR)、风味蛋白酶(酶活力2万U/g,BR) 广州市齐云生物技术公司;胰蛋白酶(酶活力25万U/g,CAS:9002-07-3,BR)、邻苯三酚(CAS:87-66-1,AR) 广州菲博生物科技公司;枯草蛋白酶(酶活力11万U/g,CAS:9014-01-1,食品级) 无锡市雪梅酶制剂科技有限公司;DPPH(CAS:1898-66-4,AR)美国sigma公司;Tricine-SDS-Page试剂盒南京建成科技有限公司;邻二氮菲(CAS:66-71-7,AR)、甲醛、冰乙酸等试剂均为分析纯,购于国药试剂有限公司。
DS-1型高速组织捣碎机上海标本模型厂,中国;DK-S24型恒温水浴锅上海森信实验仪器厂有限公司,中国;3K30型高速冷冻离心机Sigma公司,德国;MAS-Ⅱ微波仪上海新仪微波化学科技有限公司,中国;Kjeltel2300凯氏定氮仪丹麦FOSS仪器有限公司,中国公司;Delta320精密pH计梅特勒-托利多仪器(上海)有限公司,中国;Akku-drive电子滴定仪赫施曼公司,德国;KS-300型超声波清洗机(360W) 宁波科生仪器厂,中国;Bio-rad电泳仪北京伯乐生命科学发展有限公司,中国;1100 Series高效液相色谱仪Agilent公司,美国;色谱柱:Athena C18-WP柱5μ(250mm×4.6mm)安谱Anpel,中国;自动进样器:1100 Series Agilent Technologies Waldbronn,Germany;SUNRISE酶标仪TECAN公司,奥地利。
1.2实验方法
1.2.1样品前处理将合浦珠母贝去壳和脏器,然后直接用组织捣碎机将贝肉绞碎待用。对照组为前处理后的样品不作酶解与水解处理,直接1000r/min离心10min得到的上清液经0.2μm膜过滤所得。
1.2.2物理助解与水浴酶解
1.2.2.1酶解条件设定称取处理好的样品12g若干份,按照3∶2(W∶W)料液比添加pH7.0的缓冲溶液,加酶量为4000U/g,最适条件见表1。在恒温水浴(H)中处理1.5h后取出样品沸水浴灭酶15min,1000r/min离心10min取上清液真空冷冻干燥待测。以RP-HPLC和Tricine-SDS-PAGE法反映其中的片段异同情况,并以对DPPH·、·OH的清除率与水解度(DH)为指标反应各酶解环境下的活性变化。
1.2.2.2物理助解微波(W)辅助酶解,在每种酶的最适条件下,300W微波处理1.5h后,取出样品沸水浴灭酶15min,1000r/min离心10min取上清液真空冷冻干燥待测。超声波(U)辅助酶解,在每种酶的最适条件下,超声功率360W,频率2000Hz,在sweep模式下酶解处理1.5h后,取出样品沸水浴灭酶15min,1000r/min离心10min取上清液真空冷冻干燥待测。
1.2.2.3不同条件酶解的片段的检验采用RPHPLC法,具体参数为:检测波长:268nm/280nm,柱温:30℃,流速:1.0mL/min,进样量:20μL,流动相:A为水-三氟乙酸(1000∶1,v/v),B为乙腈。梯度洗脱条件如表2所示。

表2 RP-HPLC洗脱条件Table 2 The elution conditions of RP-HPLC
1.2.2.4Tricine-SDS-PAGE确定酶解物的分子量参考Hermann Schagger等[6]的Tricine-SDS-PAGE系统,按照试剂盒中的操作说明制备分离胶浓度16.5%,夹层胶浓度10%,浓缩胶浓度4%,系统温度低于35℃,点样20μL。稳压操作,浓缩胶电压30V,夹层胶60V,分离胶120V,凝胶在乙醇-冰乙酸-甲醛(18∶8∶8,V∶V∶V)中固定30min。采用0.1%考马斯亮蓝R-250∶甲醇∶冰乙酸(9∶9∶2,V∶V∶V)体系在恒温摇床中隔夜染色,转移至水-甲醇-冰乙酸(8∶1∶1,V∶V∶V)中脱色6h。采用Fermentas PageRuler Prestained Protein Ladder SM0671和杆菌肽(1422.7u)作Marker,反映其酶解物的相对分子质量分布情况。
1.2.3指标的测定
1.2.3.1水解度(DH)[7]其中氨基态氮含量N1测定参照甲醛-电位滴定法,总氮含量N2测定参照凯氏定氮法[8],具体如公式(1)所示:式中:N1:为水解液中氨基氮含量;N2:为原料中粗蛋白氮含量。

1.2.3.2抗氧化活性测定采用酶解液对·OH和DPPH·的清除率为指标对比其抗氧化能力。·OH清除率的测定参考文献[9]。DPPH的清除能力在文献[10]的基础上稍作修改如下:1mL样品酶解液与1mL去离子水混合,再加1mL DPPH溶液(2×10-4mol/L,DPPH溶于95%乙醇),暗反应20min,10000r/min离心10min,此组作为实验组,在517nm下测吸光值,记为Ai;空白组用1mL 95%乙醇代替DPPH溶液;对照组以1mL去离子水代替样品。等体积去离子水和95%乙醇混合液空白调零,DPPH·清除率按以下公式(2)计算:
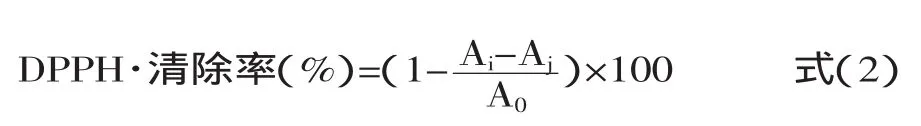
式中:A0:对照组吸光值;Ai:样品组吸光值;Aj:空白组吸光值。

图1 对照组和3种处理模式下Alcalase 2.4L以及菠萝蛋白酶酶解RP-HPLC图Fig.1 RP-HPLC profile of blank group and hydrolysate obtained by Alcalase 2.4L and bromelain under microwave irradiation(W),ultrasonicwave(U)and conventional heating(H)

图2 3种处理模式下木瓜蛋白酶、胰蛋白酶和风味蛋白酶酶解的RP-HPLC图Fig.2 RP-HPLC profile of hydrolysate obtained by papain,trypsin and flavourzyme hydrolysis under microwave irradiation(W),ultrasonicwave(U)and conventional heating(H)
2 结果与分析
2.13种物理法辅助酶解产物的RP-HPLC结果比较
直接离心得到的上清液过0.2μm膜为对照组,酶A、B、P、T、F、W、K以及不加酶情况在3种处理方式下的RP-HPLC分离结果分别见图1~图3。对比图1中酶A与对照组可见,在15min处的产物被分解,而25min后出来的产物量明显增加,另外发现酶A在3种处理模式下酶解的产物成分没有明显差别。
对比实验组RP-HPLC的结果,清晰可见,图2和图3中微波处理与传统水浴相比峰的个数相对较多,换言之,就是酶解的效果较充分;超声处理的酶解产物组成与水浴的几乎没有变化,这一点符合Jia Junqiang等[11]研究得出,超声波是一种稳定高效处理手段,是新式食品加工方法。Liu D等[12]实验发现微波在一定范围内会影响酶的作用活性,导致性能下降。但从本实验的图谱也补充说明了在一定的条件下,微波也可促进酶的活性。图2中P、T和图3中的K酶对比,微波处理和超声处理,发现微波更能促进木瓜蛋白酶、胰蛋白酶和枯草蛋白酶对合浦珠母贝肉的酶解作用。单独选择酶种,由图1~图3可知,Alcalase蛋白酶和风味蛋白酶在3种模式下,25min之前的组分信号强度降低,之后的信号有明显的增大现象,说明这两种酶比较适合合浦珠母贝肉的酶解反应。

图3 3种处理模式下胃蛋白酶、枯草蛋白酶和不加酶处理组酶解的RP-HPLC图Fig.3 RP-HPLC profile of hydrolysate obtained by pepsin and subtilisin and hydrolysis without proteases under microwave irradiation(W),ultrasonicwave(U)and conventional heating(H)
2.23种物理法辅助酶解产物的Tricine-SDSPAGE结果比较
蛋白标准物和杆菌肽的条带见图4,绿色的条带为10ku的位置,杆菌肽标品条带所在位置为1.42ku。不加酶的3种处理模式下产物的电泳图见图5,对照图4可知,不加酶处理的W、U、H泳道条带集中在1422~10000u范围内,而且可以看出蛋白碎片种类数量W>U>H。不同处理模式下7种酶作用的酶解物Tricine-SDS-PAGE结果如下图6所示。

图4 蛋白标准物的SDS-PAGE图Fig.4 The SDS-PAGE profile of marker

图6 7种酶在3种处理模式下的SDS-PAGE图Fig.6 The SDS-PAGE profile of hydrolysate obtained from hydrolysis by the seven proteases under different patterns
由图6中可发现,在3种模式下7种酶的条带数和宽度都多于不加酶的情况,这一现象也印证了RPHPLC得到的结果。另外,Alcalase、风味蛋白酶、胃蛋白酶和枯草蛋白酶在W和U条件下相对H较多的将夹层胶附近的条带片段酶切为更小片段,因此在各自的泳道下端也出现了一些条带,说明超声和微波在一定条件下能促进其水解。W和U相比,菠萝蛋白酶和木瓜蛋白酶更适合于超声处理,微波对其造成的影响较大。总体来看,在短时间内,超声和微波能有效将合浦珠母贝100~1000ku内的蛋白酶解成10ku以下的分子[13]。
2.33种物理法辅助酶解产物的抗氧化能力分析
对7种酶在微波、超声和传统水浴条件下处理后的酶解产物测定水解度以及DPPH·和·OH的清除能力结果分别见图7~图9。

图7 7种酶在3种处理模式下水解合浦珠母贝蛋白的水解度Fig.7 The hydrolysis degree of Pinctada Fucata protein hydrolyzed by the seven proteases under different patterns
图7中可以看出,Alcalase蛋白酶、风味蛋白酶和枯草蛋白酶在微波或超声波的辅助处理下比水浴处理的水解度明显高,这3种酶最少的提高了近10%,最高多出28.41%。木瓜蛋白酶和胰蛋白酶在微波或超声波的辅助处理下水解效果接近且比水浴效果好。虽然菠萝蛋白酶在微波条件下的效果比超声波和水浴效果略差,胃蛋白酶在微波条件下比超声波效果好但略低于水浴效果,但7种酶,均在3种物理法辅助下水解合浦珠母贝蛋白,能明显提高水解效果。
对照图8与图9可以发现,比不加酶处理产物对2种自由基的清除率都要高的组为A、B、P、F和K组,也就是说这5种酶在3种类处理条件下能切割出较多的抗氧化片段。综合考虑水解度问题,选择Alcalase蛋白酶、风味蛋白酶和枯草蛋白酶不但在物理助解时提高水解度而且能较多的切割抗氧化片段,此结论与尚军等[14]利用超声助解蛋白酶酶解合浦珠母贝蛋白的结论相一致,Alcalase蛋白酶与枯草蛋白酶在此模式下效果最佳。李菊芳和陈洪等[15]微波辅助碱性蛋白酶和风味蛋白酶助解菜籽油和油料饼粕,证明微波这种内部加热的方式,促进了酶的作用,缩短了反应时间。由此可以说明物理辅助酶解的方法是可促进酶对合浦珠母贝蛋白酶解,但应根据不同的物理方式选择合适的酶[16]。

图8 7种酶在3种处理模式下水解物对DPPH·的清除率Fig.8 The scavenging rate of hydrolysate obtained by the seven proteases against DPPH radical under different patterns

图9 7种酶在3种处理模式下水解物对·OH的清除率Fig.9 The scavenging rate of hydrolysate obtained by the seven proteases against·OH under different patterns
3 结论
本文比较了超声波、微波与水浴三种物理法辅助蛋白酶水解浦珠母贝蛋白,蛋白酶均采用7种实验室常用酶,通过测定RP-HPLC图谱和Tricine-SDSPAGE电泳结果,证明在短时间内,超声波、微波法辅助酶解能有效促进合浦珠母贝蛋白的水解。超声辅助酶解较微波处理稳定,与水浴差别较小,微波辅助木瓜蛋白酶、胰蛋白酶和枯草蛋白酶对合浦珠母贝肉的酶解作用最佳,本研究结果与F Javier Izquierdo等[17]研究结论相符。综合考虑电泳分析和抗氧化能力,证明微波辅助Alcalase 2.4L蛋白酶和复合风味蛋白酶的效果较好。李菊芳等[18]也得出相似结论,充分利用微波和超声波的优点,可提高酶解的效率,缩短酶解制备多肽的时间。
[1]吴燕燕,李来好,杨贤庆,等.栅栏技术优化即食调味珍珠贝肉工艺的研究[J].南方水产,2008,4(6):56-62.
[2]吴燕燕,尚军,李来好,等.合浦珠母贝肉短肽的分离及其抗氧化活性研究[J].食品工业科技,2012,33(7):123-126.
[3]Pramanik B N,Mirza U A,Hain Y,et al.Microwave﹞enhanced enzyme reaction for protein mapping by mass spectrometry:A new approach to protein digestion in minutes[J].Protein Science,2002,11(11):2676-2687.
[4]窦文超,郇延富,张志权,等.小型微波谐振腔用于蛋白质微波辅助酶解[J].高等学校化学学报,2007,28(2):238-241.
[5]Ulusy B H,Colak H,Hampikyan H.The use of ultrasonicwaves in food technology[J].Research Journal of Biological Sciences,2007,2(4):491-497.
[6]Hermann Schägger.Tricine-SDS-PAGE[J].Nature Protocols,2006,1(1):16-22.
[7]Yanyan Wu,Jing Wang,Laihao Li,et al.Desalination of antioxidantpeptidesfromPinctadaFucatausingC18
chromatographic column[J].Advances in Chemical Engineering,2013,781:1508-1512.
[8]吴燕燕,田倩,尚军,等.合浦珠母贝抗氧化肽的性质及应用研究[J].食品工业科技,2011,32(11):123-126,130.
[9]刘秋风,吴成业,苏永昌,等.龙须菜中硫琼脂的体外抗氧化评价及降血糖、降血脂活性的动物实验[J].南方水产科学,2013,9(3):57-66.
[10]Rajapakse N,Mendis E,Jung W K,et al.Purification of a radical scavenging peptide from fermented mussel sauce and its antioxidant properties[J].Food Research International,2005,38:175-182.
[11]Jia J,Ma H,Zhao W,et al.The use of ultrasound for enzymatic preparation of ACE-inhibitory peptides from wheat germ protein[J].Food Chemistry,2010,119(1):336-342.
[12]Liu D,Li X N,Qin Z J,et al.Study on the processing technique of enzyme hydrolysis Eupolyphaga sinensis peptide and innunoregulatory effect[J].Journal of Chinese medicinal materials,2012,35(9):1382-1385.
[13]Damm M,Nusshold C,Cantillo D,et al.Can electromagnetic fields influence the structure and enzymatic digest of proteins/A critical evaluation of microwave-assisted proteomics protocols[J]. Journal of Proteomics,2012,75(18):5533-5543.
[14]尚军.合浦珠母贝肉寡肽的制备及其抗氧化活性研究[D].湛江:广东海洋大学,2010.
[15]李菊芳,魏芳,陈洪,等.微波辅助分步酶解菜籽粕制备菜籽多肽的研究[J].中国油脂,2010(3):18-22.
[16]Hua L,Low T Y,Sze S K.Microwave-assisted specific chemical digestion for rapid protein identification[J].Proteomics,2006,6(2):586-591.
[17]F Javier Izquierdo,Elena Penas,M Luisa Baeza,et al. Effects of combined microwave and enzymatic treatments on the hydrolysis and immunoreactivity of dairy whey proteins[J]. International Dairy Journal,2008(18):918-922.
[18]李菊芳,董绪燕,魏芳,等.微波/超声波及固定化酶技术在食品蛋白高效水解中的应用研究进展[J].中国农业科技导报,2009,11(6):86-92.
Evaluation of three kinds of physic-assisted enzymatic hydrolysis from Pinctada fucata protein
WU Yan-yan1,WANG Jing1,2,LI Lai-hao1
(1.South China Sea Fisheries Research Institute,Chinese Academy of Fishery Sciences,Key Lab of Aquatic Product Processing,Ministry of Agriculture,Guangzhou 510300,China;2.Shanghai Ocean University,Shanghai 201306,China)
Objective:the effects of physic-assisted enzymatic hydrolysis method by microwave(W),ultrasound(U)and traditional water bath(H)with seven kinds of protease(Alcalase 2.4L,bromelain,papain,trypsin,flavourzyme,pepsin and subtilisin)from Pinctada Fucata protein were researched in this paper.Methods:the evaluation index were measured through the profile of reversed-phase high-performance liquid chromatography(RP-HPLC)and Tricine-SDS-PAGE electrophoresis with degree of hydrolysis(DH),scavenging rates against 1,1-diphenyl-2-picryl hydrazyl(DPPH)and hydroxy radicals.Results:Physical assisted hydrolysis could promote the enzymolysis effectively.The effects of hydrolysis by microwave assisted with papain,trypsin and subtilisin were the best method.The situation of Alcalase 2.4L and flavourzyme was steady in three modes. Conclusion:The optimum protease for microwave assisted by hydrolyse from Pinctada Fucata protein were Alcalase 2.4L and flavourzyme.
Pinctada Fucata protein;physic-assisted enzymatic hydrolysis;hydrolysis effect
TS254.9
A
1002-0306(2015)10-0163-06
10.13386/j.issn1002-0306.2015.10.025
2014-07-30
吴燕燕(1969-),女,博士,研究员,研究方向:水产品加工与质量安全控制。
国家海洋局海洋公益性行业科研专项(201305018);广东省科技计划项目(2011B031200009);海南省重点科技项目(ZDXM20100005)。

