地塞米松诱导肺腺癌对紫杉醇耐药与Survivin基因表达
康马飞* 李林凤
(桂林医学院,广西 桂林 541001)
地塞米松诱导肺腺癌对紫杉醇耐药与Survivin基因表达
康马飞* 李林凤
(桂林医学院,广西 桂林 541001)
目的 观察不同浓度地塞米松(DEX)预处理后,再予紫杉醇(PTX)干预后人肺腺癌细胞的耐药情况及Survivin基因mRNA及蛋白表达的变化。方法 用四唑盐(MTT) 试验测定不同浓度PTX作用于肺腺癌A549细胞后的细胞存活率, 筛选出PTX的半数抑制浓度(IC50)。用不同浓度DEX预处理A549细胞后,再予不同浓度PTX作用于A549细胞,用MTT试验测定细胞存活率,用RT-PCR和Western Blot法检测细胞中Survivin基因mRNA和蛋白的表达水平。结果 不同浓度的DEX预处理A549细胞后能诱导其对PTX产生耐药,细胞耐药率随DEX浓度的增加而增高。Survivin基因mRNA和蛋白的表达水平随DEX浓度的增加而增高。结论 地塞米松能诱导肺腺癌细胞对紫杉醇产生耐药,其机制可能与地塞米松诱导肺腺癌细胞抗凋亡基因Survivin基因表达增加有关。
地塞米松;肺肿瘤;Survivin;抗凋亡基因;癌;细胞系;抗药性
化疗是治疗恶性实体瘤的主要手段之一,糖皮质激素因能促淋巴细胞凋亡,广泛用于淋巴、血液系统肿瘤及其他肿瘤的联合治疗(如止吐,某些化疗药物使用前的预处理)。然而,新的资料表明,糖皮质激素能诱导大多数恶性实体瘤产生化疗耐药,但机制尚未完全明确。本研究通过不同浓度地塞米松预处理肺腺癌细胞后再给予紫杉醇干预,观察细胞耐药发生情况及细胞耐药发生与抗凋亡基因survivin基因表达的变化关系,以探讨地塞米松诱导实体瘤化疗耐药的机制。
1 材料与方法
1.1材料:①细胞株:采用人肺腺癌A549细胞株(中科院细胞库提供)。②药物:地塞米松,紫杉醇。③试剂:RPMI-1640培养基、胰酶(美国GIBCO公司),胎牛血清(杭州四季青生物工程材料有限公司),四甲基偶氮唑盐(美国Sigma公司),琼脂糖(上海普飞生物技术公司),TBE、EB(上海碧云天生物技术公司)。④survivin及GAPDH引物由上海生工生物工程有限公司合成。RNAiso PLUS(total RNA提取试剂)、PrimeScript RT reagent Kit(反转录试剂盒)、SYBR Premix Ex TaqⅡ(PCR扩增试剂盒)由天根生化科技有限公司提供。总蛋白提取试剂盒由上海贝博生物科技有限公司提供。BCA蛋白定量试剂盒由北京艾德莱生物科技有限公司提供。ECL超敏发光试剂盒由北京博奥森生物科技有限公司提供。Western Blot兔抗鼠survivin单克隆抗体(一抗)由美国Epitomics公司提供。β-actin鼠单抗(一抗)由碧云天生物科技有限公司提供。
1.2方法
1.2.1细胞培养:A549细胞在37 ℃、5% CO2及饱和湿度条件下,于含10%胎牛血清、青霉素100 U/mL,链霉素100 mg/L的RPMI-1640培养液中生长,2~3 d传代1次。
1.2.2MTT 法测定紫杉醇对A549细胞的半数抑制浓度(IC50):收集呈指数生长的A549细胞,用0.25%胰酶消化,制成单细胞悬液。取1×104/mL细胞悬液接种于96孔培养板内,每孔200 μL,设置空白孔(完全培养液),对照孔(细胞、完全培养液),实验孔(细胞、完全培养液),对照组及实验组各浓度分别设3个复孔,然后置于37 ℃、5% CO2孵箱内培养24 h后,于实验孔中加入不同浓度的紫杉醇干预,紫杉醇的终浓度设置为15、25、35 μmol/L,于对照孔加入等体积的PBS液,置于37 ℃、5% CO2孵箱内继续培养24 h。然后每孔加入MTT溶液20 μL(5 g/L),继续孵育4 h,终止培养。吸弃上清液,加入DMSO,选择490 nm波长,在酶联免疫检测仪上测定各孔吸光度(A)值。细胞存活率(Surv%)=(实验孔A值-空白孔A值)/(对照组A值-空白孔A值)×100%。抑制率=1-细胞存活率。IC50用SPSS17.0软件以Probit回归法计算得出。

表1 各组细胞存活率比较
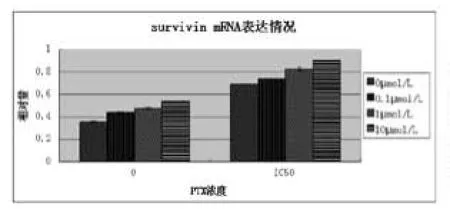
图1 各组细胞Survivin mRNA表达水平比较

图2 RT-PCR法检测细胞中Survivin mRNA表达
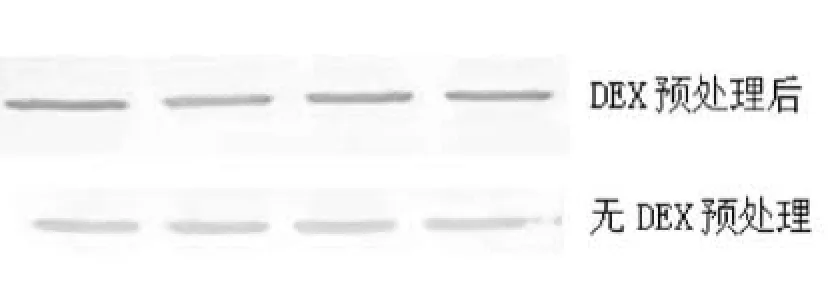
图3 Survivin蛋白表达水平比较
1.2.3MTT法测定地塞米松诱导A549细胞对紫杉醇的反应:同1.2.2中设置空白孔(完全培养液),对照孔(细胞、完全培养液),实验孔(细胞、地塞米松、完全培养液),其中地塞米松浓度分别设置为0.1、1、10 μmol/L,对照组及实验组各浓度分别设3个复孔,培养24 h后,于对照组及实验孔加入紫杉醇浓度分别为0.1 mol/L、1倍IC50,继续培养24 h。同1.2.2中酶联免疫法测定各孔吸光度及计算细胞存活率。
1.2.4RT-PCR法检测细胞中Survivin mRNA水平:收集呈指数生长的A549细胞,取1×104/mL细胞悬液接种于90 mm培养皿内,设置对照组(细胞、完全培养液),实验组(细胞、地塞米松、完全培养液),同1.2.3中设置地塞米松浓度培养24 h后,分别于对照孔及实验孔中加入紫杉醇,浓度分别为0.1 mol/L、1倍IC50,继续培养24 h。以PBS清洗并调整细胞为1.5 mL Eppendorf管1×107个,离心后尽弃PBS,按照试剂盒说明书方法提取总RNA,纯度鉴定合格后保存于-70 ℃备用。各样品取1 μg RNA,进行cDNA合成及PCR扩增。引物序列:survivin(118bp)上游5-GGACCACCGCATCTCTACAT-3,下游5-CAAGTCTGGCTCGTTCTCAGT-3,GAPDH(106 bp)上游5-CCGCATCTTCTTTTGCGTCG-3,下游5-AGTTAAAAGCAGCCCTG GTGA-3。热启动法进行PCR,反应条件:94 ℃预变性3 min,94 ℃变性30 s,55 ℃梯度退火30 s,72 ℃延伸1 min,72 ℃延伸5 min,共30个循环,取10 μL扩增产物于1.5%琼脂糖凝胶电泳。溴化乙锭染色后于凝胶图像分析仪进行扫描分析。对基因表达量与GAPDH表达量的比值进行比较。实验重复3次。
1.2.5蛋白免疫印迹法(Western-Blot)检测survivin蛋白表达水平:按试剂盒操作步骤提取细胞总蛋白,BCA法进行蛋白定量。取40 μg蛋白加入上样缓冲液变性待用。制备SDS-PAGE胶,浓缩胶90V电压电泳40 min,分离胶120 V电压电泳1 h,转膜(湿转法)前准备好6张薄滤纸和1张PVDF膜(PVDF膜用前置于甲醇中激活30 s),PVDF膜的面积≥滤纸面积≥凝胶面积,PVDF膜、滤纸和凝胶置于1×转移缓冲液中浸泡20 min。按(-)海绵/三层薄滤纸/凝胶/PVDF膜/三层薄滤纸/海绵(+)的顺序夹好夹子,尽量赶尽每层之间的气泡。夹子按转移槽的正负极正确放置,调节电压至100 V,转膜1 h(因为电转移时会产热,所以要在转移槽的周围放冰用于降温)。转膜结束后取出PVDF膜,将膜用TBS轻轻漂洗后,移至含有封闭液的平皿中,37 ℃ 封闭1 h。将封闭后的PVDF膜用TBST洗涤3次,每次5 min。survivin一抗按1∶500稀释,将抗体滴加到PVDF膜上,封膜,37 ℃孵育2 h或4 ℃孵育过夜。一抗作用后,将膜取出,用TBST洗涤3次,每次5 min,让其与碱性磷酸酶标记的二抗反应,反应条件为37 ℃ 1~2 h。二抗山羊抗兔IgG 1∶1000稀释孵育完成后,将膜取出,用TBST洗涤3次,每次5 min,显色液显色5~10 min,待目的条带清晰后终止显色反应,显色后的PVDF膜在半干时拍照。
1.3统计学处理:采用SPSS17.0进行统计分析,实验数据以()表示,多组均数间比较采用单因素方差分析,两两比较采用LSD-t检验,P<0.05为差异有统计学意义。
2 结 果
2.1紫杉醇对A549细胞的半数抑制率(IC50):不同浓度(0.1、1、10 μmol/L)处理A549细胞后,A值分别为(0.803±0.014)、(0.767 ±0.017)、(0.748±0.001),对照组A值为(0.846±0.030)。不同浓度紫杉醇作用对应的细胞的存活率分别为13.3%、36.9%和58.1%;由Probit法得出紫杉醇对A549细胞的IC50为28.66 μmol/L。
2.2不同浓度地塞米松诱导A549细胞对紫杉醇的反应:不同浓度地塞米松预处理的A549细胞再予紫杉醇干预后,A549细胞对紫杉醇显示出典型的耐药,且与地塞米松的浓度呈剂量依赖关系。细胞的存活率及比较结果见表1。
2.3各组A549细胞的Survivin mRNA及蛋白表达水平:不同浓度地塞米松预处理的A549细胞再予紫杉醇干预后,A549细胞Survivin mRNA及蛋白表达明显增加,且与地塞米松的浓度呈剂量依赖关系。见表2、表3、图1~图3。
3 讨 论
在过去的研究中,已证实糖皮质激素可诱导多种实体瘤对化疗药物耐药[1-2]。一项研究从切除的患者标本中分离出肺癌细胞,分为加地塞米松和不加地塞米松两组。结果显示,全部10份含地塞米松的标本对顺铂(DDP)、吉西他滨(GEM)耐药[3]。一项研究从21例前列腺癌患者中分离的新鲜细胞,经地塞米松预处理后对PTX、GEM、DDP、5-氟尿嘧啶(5-FU)和γ射线耐药[4]。有研究者检测了8个细胞系,18个手术切除标本和裸鼠移植物的凋亡诱导率、存活率、肿瘤生长和蛋白表达情况。在有地塞米松存在的情况下,强烈抑制5-FU、DDP、GEM或γ射线引起的肿瘤细胞凋亡,结肠癌和肝癌细胞的生存能力增强,生长加快。该研究认为糖皮质激素诱导结肠癌和肝癌细胞对化疗耐药不是偶然出现,而是很普通的现象,说明使用糖皮质激素对癌症患者是有害的[5]。本研究也进一步证实,A549细胞在地塞米松预处理后对PTX耐药,且与DEX的浓度呈剂量依赖关系,耐药随DEX浓度增加而增强。

表2 各组细胞Survivin mRNA表达水平比较
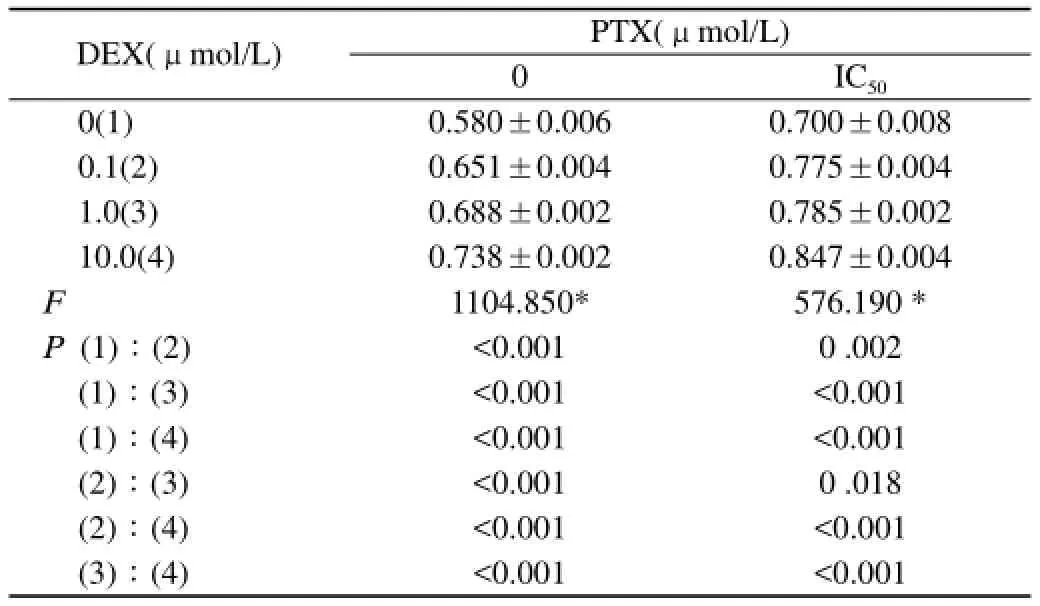
表3 各组细胞Survivin 蛋白表达水平比较
Survivin为人类凋亡抑制蛋白家族的新成员,在正常分化的成人组织中几乎不表达,但在各种肿瘤组织中常呈高度表达。软骨肉瘤中Survivin高表达且在体外表现对化疗耐药[6]。有研究显示Survivin异常高表达使卵巢肿瘤细胞对多种化疗药物的耐受性增加,并介导卵巢癌多药耐药的形成[7]。NSCLC患者Survivin蛋白表达阳性预示对紫杉醇治疗相对不敏感[8]。NSCLC组织中Survivin表达阳性提示顺铂耐药[9]。survivin高表达的进展期胃癌患者对多西紫杉醇化疗耐药[10]。上述的研究都表明,survivin高表达的实体瘤对化疗耐药。本研究结果提示,肺腺癌细胞经地塞米松预处理后,survivin mRNA和蛋白表达均明显增加,说明地塞米松诱导survivin基因表达增强。本研究结果显示,survivin mRNA和蛋白表达均随地塞米松的浓度增高而增加,而且在紫杉醇存在的情况下比无紫杉醇存在的情况下表达更高。提示糖皮质激素使用量越大,可能越容易导致化疗耐药,同时也提示,在化疗期间同时使用糖皮质激素可能更容易导致化疗耐药。该研究也从另一方面提示,针对survivin的治疗可能是逆转化疗耐药的一个途径。目前有研究使用基因沉默方法抑制survivin基因表达,可抑制化疗耐药[11-16]。但临床中如何抑制survivin基因表达尚有待于以后的研究。
总之,本研究结果表明,地塞米松可诱导肺癌对化疗耐药,抗凋亡基因survivin表达增强是地塞米松诱导肺癌对化疗耐药的机制之一。
[1] Wu W,Chaudhuri S,Brickley DR,et al.Microarray analysis reveals glucocorticoid-regulated survival genes that are associated with inhibition of apoptosis in breast epithelial cells[J].Cancer Res, 2004,64(5):1757-1764.
[2] Zhang C,Mattern J,Haferkamp A,et al.Corticosteroid-induced chemotherapy resistance in urological cancers[J].Cancer Biol Ther. 2006, 5(1):59-64.
[3] Zhang C,Mattern J,Haferkamp A,et al.Corticosteroid-induced chemotherapy resistance in urological cancers[J].Cancer Biol Ther,2006, 5(1):59-64.
[4] Yoshida Y,Kishimoto T,Ishiguro H,et al.Dexamethasone modifies the susceptibility to serum cytotoxicity and increases the metastatic efficiency of a colon carcinoma cell line[J].Exp Mol Pathol,2006, 81(1):77-84.
[5] Lien HC,Lu YS,Shun CT,et al.Differential expression of glucocorticoid receptor in carcinomas of the human digestive system[J]. Histopathology,2008,52(3):314-324.
[6] Lechler P,Renkawitz T,Campean V,et al.The antiapoptotic gene survivin is highly expressed in human chondrosarcoma and promotes drug resistance in chondrosarcoma cells in vitro[J].BMC Cancer, 2011,11:120.
[7] Aune G,Stunes AK,Tingulstad S,et al.The proliferation markers Ki-67/MIB-1,phosphohistone H3,and survivin may contribute in the identification of aggressive ovarian carcinomas[J].Int J Clin Exp Pathol,2011,4(5):444-453.
[8] 周正仕,廖小方,郑勤红,等.Survivin、BRCA1及class Ⅲ β-tubulin在非小细胞肺癌组织中的表达及与紫杉醇耐药的关系[J].肿瘤学杂志,2012,8(11): 806-810.
[9] 李伟,丁静,陈余清.晚期非小细胞肺癌中Survivin表达对顺铂敏感性和预后的预测价值[J].中国肿瘤临床,2012,(16):1216-1221.
[10] 郑维锷,原少斐,陈华进,等.展期胃癌β-tubulinⅢ和survivin的表达及与多西紫杉醇耐药性关系[J].医学研究杂志,2012,41(1):79-83.
[11] 杨永光,刘丽娟,李明意,等.抑制survivin表达对肝癌细胞阿霉素化疗敏感性的影响[J].中国普通外科杂志,2013,22(6):742-746.
[12] 曹菲,张智慧,吴萍,等.地塞米松对顺铂诱导人肺腺癌细胞株凋亡的抑制作用及其机制[J].四川大学学报(医学版),2013,44(6): 902-906.
[13] 余宗艳,齐宇红,梁军.地塞米松联合顺铂对肺腺癌A549细胞增殖和凋亡的影响[J].现代肿瘤医学,2014,22(4):762-766.
[14] 余宗艳,齐宇红,郑磊,等.地塞米松预处理人肺腺癌A549细胞对顺铂抗肿瘤活性的影响[J].现代肿瘤医学,2014,22(4):784-787.
[15] 李林凤,康马飞.地塞米松诱导肺腺癌细胞对紫杉醇耐药与Bc1-xL和Survivin基因表达[D].桂林:桂林医学院,2014.
[16] 康马飞,李林凤.地塞米松诱导人肺腺癌A549细胞对紫杉醇耐药性及Bcl-xL基因表达的影响[J].现代医药卫生,2014,30(21): 3206-3208.
Dexamethasone Induced Resistance to Paclitaxe in Adenocarcinoma of Lung and Expression of Survivin Gene
KANG Ma-fei, LI Lin-feng
(Guilin Medical University, Guilin 541001,China)
Objective To observe the changes of the drug resistance and the expression of mRNA and protein of survivin in human lung adenocarcinomal cells after dexamethasone(DEX) pretreatment in different concentrations and treatment with paclitaxel(PTX). Methods The cells viability rate of lung adenocarcinoma A549 cells was determined by MTT assay (mononuclear cell direct cytoxicity assay) after treatment of different concentrations of PTX, and to estimate the concentration of IC50of PTX. The cells viability rate of A549 cells which pretreated with different concentrations of DEX was determined by MTT assay after treatment of different concentrations of PTX, and the expression level of mRNA and protein of survivin in all of the A549 cells were determined by reverse transcriptase-polymerase chain reaction(RT-PCR) and Western Blot. Results After being pretreated with DEX in different concentrations, A549 cells were induced resistance to PTX,and the rate of resistance increased gradually with the increasing concentrations of DEX and the expression level of survivin mRNA and protein increased gradually with the increasing concentrations of DEX also. Conclusions Dexamethasone can induce resistance to paclitaxel in lung adenocarcinoma cells, and survivin , a gene of anti-apoptosis, may be involved in the path-ways of chemotherapy resistance of lung adenocarcinoma through inhibition of cellular apoptosis.
Dexamethasone; Lung neoplasms; Survivin; Anti apoptotic gene; Carcinoma; Cell line; Drug resistance
R734.2
B
1671-8194(2015)33-0001-03
广西卫生厅计划课题(项目编号:Z2013479)
E-mail:kmfgl@163.com

