LSPA1早期基因gp22细菌双杂交诱饵载体与筛选文库的建立
冯梦蝶毛普加洪愉许泽仰赵继华杨洪文宋武战黄芬井申荣曾韦锟,3
(1.昆明理工大学医学院,昆明 650500;2.成都军区昆明总医院核医学科,昆明 650032;3.昆明学院 医学院临床检验教研室,昆明 650214)
LSPA1早期基因gp22细菌双杂交诱饵载体与筛选文库的建立
冯梦蝶1毛普加1洪愉2许泽仰1赵继华2杨洪文2宋武战2黄芬1井申荣1曾韦锟1,3
(1.昆明理工大学医学院,昆明 650500;2.成都军区昆明总医院核医学科,昆明 650032;3.昆明学院 医学院临床检验教研室,昆明 650214)
构建细菌双杂交系统中的诱饵载体pKT25-gp22和甲型副伤寒沙门氏菌基因文库以便后续的筛选实验。PCR扩增获得gp22基因,插入pKT25构成诱饵质粒pKT25-gp22。提取甲型副伤寒沙门氏菌基因组DNA,经Sau3AⅠ部分酶切后连接到pUT18C质粒的BamHⅠ位点,获得基因组DNA表达文库。用化转的方法将诱饵质粒与pUT18C共转入BTH101,检测诱饵质粒自激活作用,并检测诱饵蛋白对宿主菌的毒性。将文库质粒电转至JM109感受态,PCR鉴定文库的多样性。诱饵载体pKT25-gp22无自激活报告基因的能力且对细菌的生长无毒性。所构建的副甲基因组文库覆盖基因组达8倍,满足文库筛选需要。成功构建细菌双杂交系统中诱饵载体pKT25-gp22,筛选文库质量良好,可应用于细菌双杂交实验。
细菌双杂交;诱饵载体;基因组文库;早期基因;甲型副伤寒沙门氏菌
甲型副伤寒沙门菌(副甲)是人兽共患病甲型副伤寒的致病菌。全球每年约有2 165万人感染伤寒或副伤寒菌,造成21.5万人死亡,其中每4例中就有1例是由甲型副伤寒沙门菌引起的[1]。在医疗环境恶劣、食品和水不安全的东南亚和中南亚,尤其在儿童和青少年人群中,副伤寒仍然是引起疾病和死亡的重要原因[2]。
噬菌体是生物圈中最多的微生物,对微生态环境和宿主菌进化有重要的影响[3]。噬菌体作为特异性细菌病毒,尤其是在病原菌的治疗和诊断方面越来越受到重视[4]。噬菌体侵染细菌后,噬菌体与宿主间存在广泛的相互作用,但具体是噬菌体的哪个基因发挥作用,目前对这方面的研究甚少。
噬菌体LSPA1是本实验室前期分离的甲型副伤寒沙门菌烈性噬菌体[5],该噬菌体基因组注释提示gp22基因是噬菌体的早期基因之一,而早期基因往往在噬菌体感染细菌过程中起着至关重要的作用[6]。因此,本实验拟选取LPSA1早期基因gp22构建细菌双杂交诱饵载体,通过Sau3AI酶切甲型副伤寒沙门菌基因组,构建甲型副伤寒沙门菌基因文库,通过文库鉴定及诱饵自激活等验证该细菌双杂交系统可行性,旨为进一步利用该系统探索噬菌体与宿主相互作用、更深入研究其生命活动奠定基础。
1 材料与方法
1.1 材料
1.1.1 菌株与载体 副甲CMCC50973、甲型副伤寒沙门氏菌噬菌体LSPA1、大肠杆菌JM109为昆明理工的大学基因工程与制药实验室保存。载体pBR-gp22由昆明理工大学基因工程与制药实验室构建并保存。细菌双杂交系统购自Uromedex公司,其中BTH101:F-,cya-99,araD139,galE15,galK16,rpsL1,hsdR2,mcrA1,mcrB1,为细菌双杂交的宿主菌,链霉素抗性。pKT25包含T25基因片段,该片段编码CyaA 1-224氨基酸,用于构建诱饵质粒的载体(图1),pUT18C包含T18基因片段,编码CyaA 225-399氨基酸,用于构建文库质粒(图2)。pKT25-zip和pUT18C-zip为阳性对照质粒,分别编码T25-zip和T18-zip融合蛋白,在pKT25-zip和pUT18C-zip共转入宿主菌时BTH101时,恢复Cya+。
1.1.2 工具酶与主要试剂 限制性内切酶(PstⅠ、XhoⅠ)、DNAmarker DL2000、DNAmarker DL5000、T4 DNA连接酶、pMD18-T,均购自宝生物工程(大连)有限公司。质粒DNA小量提取试剂盒、琼脂糖凝胶回收试剂盒购自北京庄盟国际生物基因科技有限公司。RNaseA购自生工生物工程(上海)股份有限公司。蛋白酶K购自Fermentas公司。TaqDNA聚合酶I购自天根生化科技(北京)有限公司。LB培养基:酵母粉5 g,胰蛋白胨10 g,NaCl 10 g,定容至1 L(固体加2%的琼脂)。IPTG、X-gal、卡那霉素、氨苄青霉素、链霉素均购自生工生物工程(上海)股份有限公司。实验所用引物见表1,由上海捷瑞生物工程有限公司合成。
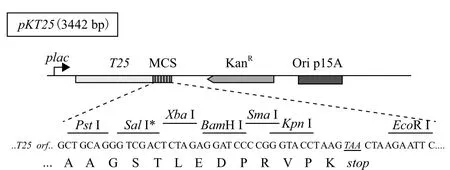
图1 pKT25图谱

图2 pUT18C图谱

表1 引物
1.2 方法
1.2.1 副甲噬菌体早期基因gp22扩增 以副甲噬菌体LSPA1基因组为模板,使用引物1和引物2扩增目的片段gp22。PCR参数:94℃预变性5 min;94℃变性30 s;55℃复性30 s、72℃延伸30 s,循环35次;72℃总延伸5 min。采用1.5%琼脂糖凝胶电泳检测PCR产物,小量琼脂糖凝胶试剂盒纯化目的片段。T-A克隆至pMD18-T,获得pMD18T-gp22,用PstⅠ和XbaⅠ双酶切鉴定,并送上海生工生物工程有限公司测序。
1.2.2 诱饵载体的构建 PstⅠ和XbaⅠ双酶切pMD18T-gp22载体回收gp22片段,pKT25载体用相同酶双酶切,胶回收载体大片段。将两者用T4 DNA连接酶连接,转化E.coli DH5α,kan抗性平板筛选。随机挑选平板上长出的单个菌落接种于LB液体培养基过夜培养后提质粒,进行PCR和双酶切鉴定。
1.2.3 电转化感受态JM109的制备 取出冻存的大肠杆菌JM109接种于5 mL LB液体培养基中,37℃过夜培养。再按1%接种量转接至100 mL新鲜的LB液体培养基中,37℃振荡培养至OD595为0.6。将100 mL培养物分装至50 mL离心管中,4℃ 6 000×g离心7 min收集菌体。菌体用50 mL预冷的去离子水重悬后收集菌体,重复上述步骤3次后,菌体用500 μL预冷的10%甘油重悬后分装,每支50 μL于-80℃保存。
1.2.4 基因组文库的构建与鉴定 将含有质粒pUT18C的大肠杆菌JM109接种于含有100 μg/mL Amp+的LB液体培养基中,37℃振荡培养过夜,按照质粒提取试剂盒提取质粒。pUT18C载体用BamHⅠ酶切、去磷酸化,凝胶电泳回收。对副甲基因组的提取及最佳酶切条件的摸索,并在最佳酶切条件下大量酶切并回收250-1 500 bp片段[7]。采用T4 DNA连接酶将去磷酸化的载体与副甲噬菌体基因组随机片段按摩尔比为1∶4的比例16℃连接过夜,产物电转化JM109感受态中,涂布于Amp抗性平板筛选得到重组克隆,构成文库质粒。随机挑选20个菌落,以引物5和引物6进行PCR扩增DNA片段,鉴定插入片段的大小与分布。PCR反应参数:94℃预变性10 min;94℃变性30 s;55℃复性30 s、72℃延伸90 s,循环35次;72℃总延伸10 min。将PCR产物在1.5%琼脂糖凝胶上电泳,用凝胶成像仪分析。
1.2.5 重组诱饵载体的毒性鉴定 取鉴定正确的诱饵质粒pKT25-gp22及空载质粒pKT25菌液,稀释后涂布卡那霉素(50 μg/mL)抗性平板,37℃培养12 h后,观察两个平板上菌落的大小及外观;选取大小相近的两种菌的单克隆于LB培养基中,37℃培养,每隔30 min取300 μL菌液,以新鲜的LB培养基为空白对照,测定OD595,绘制生长曲线,评定重组诱饵质粒表达产物对细菌细胞生长有无毒性。
1.2.6 细菌双杂交中诱饵质粒的自激活检验 取诱饵质粒pKT25-gp22、pKT25-gp22与空载pUT18C分别转化至宿主菌BTH101,转化产物涂布于含100 μg/mL氨苄青霉素、50 μg/mL卡那霉素、40 μg /mL X-gal、0.5 mmol/L IPTG、100 μg/mL链霉素的LB平板上,30℃培养24-72 h。以pKT25-zip与pUT18C-zip共转至BTH101作为阳性对照检验诱饵蛋白是否具有自激活现象。
2 结果
2.1 gp22扩增及亚克隆构建
利用设计的PCR引物1、2,以副甲噬菌体基因组为模板进行PCR扩增,扩增产物经1.5%琼脂糖凝胶电泳检测,大小约为231 bp(图3),其TA克隆质粒经PstⅠ和XbaⅠ酶切能切出约231 bp目的片段。重组质粒测序结果提示插入片段与原始序列一致。

图3 PCR扩增目的基因gp22及亚克隆载体酶切鉴定
2.2 诱饵质粒的构建与鉴定
从鉴定正确的亚克隆载体上PstⅠ和XbaⅠ双酶切回收gp22后插入pKT25质粒的PstⅠ/XbaⅠ位点,转化JM109感受态,得到重组质粒,PCR及双酶切鉴定均有相应大小的目的条带出现,结果如图4所示。

图4 诱饵载体pKT25-gp22的鉴定
2.3 副甲基因文库的构建与初步鉴定
在最佳酶切条件下大量酶切基因组,回收250-1 500 bp片段与BamHⅠ酶切并去磷酸化的pUT18C载体连接,转化JM109,涂布于氨苄青霉素抗性平板,37℃培养后统计菌落的个数,共获得3.4×105个阳性克隆。选取20个阳性克隆,用pUT18C质粒多克隆两侧的测序引物进行菌落PCR扩增,扩增产物用1.5%琼脂糖电泳,从图5中可以看出,20个阳性克隆中插入片段达99%,片段大小随机性良好,集中在250-1 500 bp。

图5 PCR鉴定基因组文库
2.4 诱饵质粒毒性检测
以pKT25/BTH101细菌为对照,pKT25-gp22/ BTH101细菌为实验组进行诱饵质粒毒性检测。结果表明,实验组和对照组中菌落数及菌落大小均无明显差异且菌落外观无差异。分别挑选1个单克隆测定其生长曲线,结果如图6所示,两种菌的生长曲线大致相同,说明重组质粒pKT25-gp22表达产物对BTH101无毒性。

图6 诱饵质粒对宿主菌毒性的检测(OD595为x-±s)
2.5 诱饵质粒自激活作用的鉴定
检测结果如图7所示,pKT25-gp22单转及pKT25-gp22+pUT18C质粒共转至BTH101,在LB/X-gal平板上菌落呈白色(图7-A,7-B),而pKT25-zip+pUT18C-zip质粒共转至BTH101后在LB/X-gal平板上菌落呈蓝色(图7-C)。分别在上述3个平板上挑选大小合适的菌落在相同的平板上划线,重复传代3次后,前二者菌落均为白色(图7-D,7-E),而后者仍为蓝色(图7-F)。说明重组诱饵质粒无自激活作用。
3 讨论
随着抗菌药物在临床的广泛应用,耐药菌在全球范围内迅速增加。对于严重的沙门氏菌感染,氟喹诺酮类、三代头孢菌素是唯一可用的抗生素,且易造成耐药性的发生[8],因此急需寻找抗生素的替代物。噬菌体能杀死细菌,但能否作为抗生素替代物而备受关注,有效侵染宿主菌是噬菌体治疗的关键[9]。噬菌体侵染并消灭宿主菌是个复杂的过程,但归根结底是噬菌体蛋白和宿主蛋白之间的相互作用。

图7 诱饵质粒的自激活检测
蛋白质与蛋白质之间相互作用的研究方法主要有噬菌体展示技术、免疫共沉淀、酵母双杂交,还有在酵母双杂交基础上衍生出的细菌双杂交。细菌双杂交具有快速、高通量筛选的优点,对于筛选与已知蛋白相互作用的未知蛋白更为有效[10]。本研究采用的是腺苷酸环化酶细菌双杂交系统[11],其原理如图8所示。将gp22与T25融合,构成诱饵质粒,将副甲噬菌体基因文库克隆至pUT18C质粒(氨苄青霉素抗性),若有适宜的片段编码的多肽与诱饵蛋白相互作用,则能催化ATP分解成cAMP从而激活cAMP-CAP启动子启动,使得下游的报告基因表达。
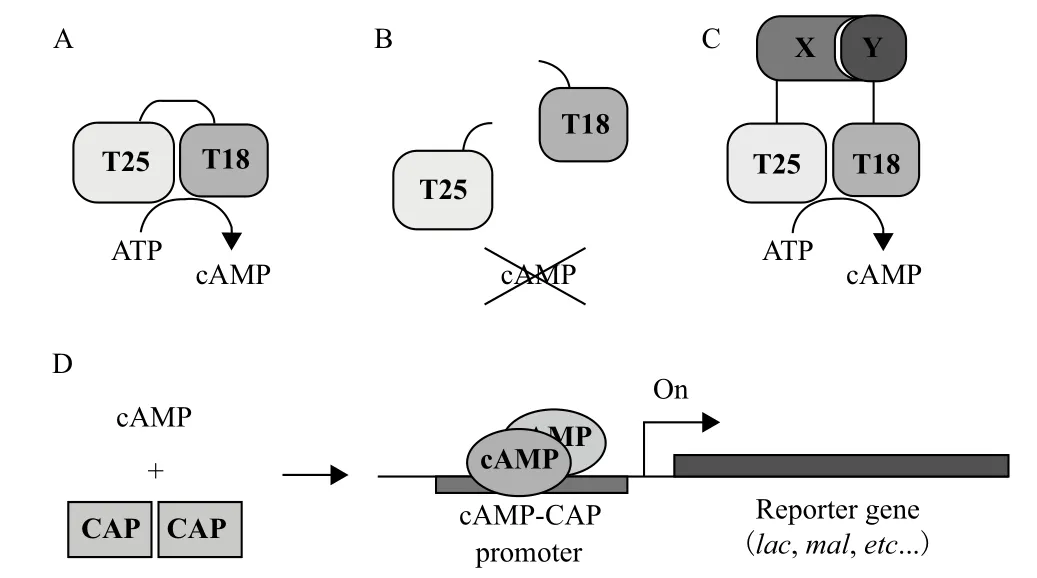
图8 基于CyaA片段功能互补细菌双杂交系统的原理
本研究所用的噬菌体LSPA1是由本实验室分离纯化获得的副甲烈性噬菌体,其基因组序列已提交GENBANK(GI:676402673),为了进一步研究LSPA1在侵染细菌早期与宿主菌的相互作用蛋白,通过分析LSPA1基因组和检索相关参考文献分析[12],选取噬菌体早期基因gp22作为研究对象,并将其克隆至pKT25构建诱饵质粒,以期利用细菌双杂交技术在构建的宿主甲型副伤寒沙门菌基因文库筛选相互作用的蛋白。
基因文库的容量是衡量文库质量的重要标准,文库构建时获得的克隆数越多,代表性就越好,但同时文库的量大又增加了筛选的难度,因此文库的容量要适宜。按照公式N=ln(1-P)/ln(1-f)[13],其中N是转化成功的单克隆数,P是覆盖率,f是插入片段平均长度与基因组总长的比值。副甲基因组全长为4 608 196 bp,f为1.09×10-4,若要求插入DNA片段在文库中出现的概率为99%,所需转化成功的菌落数约为41 442个,本研究构建文库的克隆数为340 000个,覆盖倍数约为8.2倍,达到基因文库的构建要求。
诱饵质粒和甲型副伤寒沙门菌基因文库的成功构建,是利用细菌双杂交进行筛选并获取与gp22相互作用分子的关键步骤。此外,某些蛋白质在细菌中表达时对细菌产生的毒性作用及本身就具备结合转录激活活性的蛋白质而直接激活报告基因的表达,这些都使得细菌双杂交的结果不可靠,所以对诱饵蛋白自激活与毒性作用的验证是必要的,以此排除假阳性和假阴性相互作用,同时也降低了筛选的工作量与筛选难度。本研究以转化诱饵质粒、共转诱饵质粒和空载文库质粒,同时以阳性质粒共转为阳性对照来检测诱饵表达载体是否具有自激活作用。结果表明,诱饵质粒无自激活报告基因的作用,保证了实验的可靠性,为下一步研究噬菌体LPSA1侵染宿主菌的机制奠定基础。
4 结论
本研究利用基因工程技术成功地将来源于甲型副伤寒沙门氏菌噬菌体LSPA1的早期基因gp22克隆至pKT25构建细菌双杂交的诱饵质粒pKT25-gp22,并对诱饵质粒进行了毒性及自激活检测。同时也成功地构建了甲型副伤寒沙门菌基因文库,可用于后期筛选。
[1] Maclennan CA, Martin LB, Micoli F. Vaccines against invasive Salmonella disease:Current status and future directions[J]. Human Vaccines & Immunotherapeutics, 2014, 10(6):1478-1493.
[2] Sushant S, Rodney C, Thomas FW, et al. Increasing rates of Salmonella Paratyphi A and the current status of its vaccine development[J]. Expert Review of Vaccines, 2013, 12(9):1021-1031.
[3] Labrie SJ, Samson JE, Moineau S, et al. Bacteriophage resistance mechanisms[J]. Nature Reviews Microbiology, 2010, 8(5):317-327.
[4] Sarika J, Tulsi DC. Antimicrobial resistance among blood culture isolates of Salmonella enterica in New Delhi[J]. J Infect Dev Ctries 2013, 7(11):788-795.
[5] 毛普加, 洪愉, 冯金, 等. 甲型副伤寒沙门氏菌噬菌体PSPA1感染宿主相关基因分析[J]. 医学分子生物学杂志, 2014, 11(2):85-89.
[6] Roucourt B, Chibeu A, Lecoutere E, et al. Homotypic interactions among bacteriophage φKMV early proteins[J]. Archives of virology, 2007, 152:1467-1475.
[7] 原薇薇, 杨杰, 王冬梅, 等. 耐甲氧西林金黄色葡萄球菌PBP2a相互作用蛋白的筛选[J]. 第三军医大学学报, 2010, 32(8):749-753.
[8] Capparelli R, Nunzia N, Marco I, et al. Bacteriophage therapy of Salmonella enterica:a fresh appraisal of bacteriophage therapy[J]. J Infect Dis, 2010, 201(1):52-61.
[9] Shanta, D Surojit, D Utpala M, et al. Antimicrobial resistance,virulence profiles and molecular subtypes of Salmonella enterica serovars typhi and paratyphi A blood isolates from Kolkata, India during 2009-2013[J]. PLoS One, 2014, 9(8):e101347.
[10] 李建华. 细菌双杂交系统及其在病原微生物学中的应用[J].微生物学免疫学进展, 2006, 34(3):34-39.
[11] Gouzel K, Josette P, Agnes U, et al. A bacterial two-hybrid system based on a reconstituted signa transduction pathwayl[J]. Microbiology, 1998, 95(8):5752-5756.
[12] Turner D, Hezwani M, Nelson S, et al. Characterization of the Salmonella bacteriophage vB_SenS-Ent1[J]. J Gen Virol, 2012,93(9):2046-2056.
[13] 萨姆布鲁克J, 拉塞尔DW, 黄培堂, 编译. 分子克隆实验指南[M]. 第3版. 北京科学出版社, 2002:512-513.
(责任编辑 李楠)
Construction of LSPA1 Early Gene gp22 Bacterial Two-hybrid Bait Vector and Screening Library
Feng Mengdie1Mao Pujia1Hong Yu2Xu Zeyang1Zhao Jihua2Yang Hongwen2Song Wuzhan2Huang Fen1Jing Shenrong1Zeng Weikun1,3
(1. Medical Faculty,Kunming University of Science and Technology,Kunming 650500;2. Department of Nuclear Medicine,Kunming General Hospital of Chengdu Military Command,Kunming 650032;3. Department of Clinical Laboratory of Medical Faculty,Kunming University,Kunming 650214)
This study aims to construct a bait vector pKT25-gp22 and the gene library of Salmonella paratyphi A in bacterial two-hybrid system for further screening study. The gp22 gene was obtained by PCR amplification and then cloned into pKT25 to constitute the bait plasmid pKT25-gp22. The genomic DNA of S. paratyphi A was extracted and partially digested with Sau3AⅠ. The fragments between 250 to1 500 bp were re-natured and ligated to BamHⅠ site of pUT18C plasmid, and the genomic DNA library was obtained. The bait plasmid pKT25-gp22 and pUT18C were co-transformed to BTH101, and the self-activation of bait plasmid pKT25-gp22 and the toxicity of bait protein to the host bacteria were detected. The library plasmids were transformed to JM109 competence and the library diversity was identified by PCR. The results revealed that the bait vector was successfully constructed without self-activation of the transcription of reporter gene and non-toxic to the growth of bacteria. The genomic library covering 8 times of S. paratyphi A genome met the requirements of screening. In conclusion, the bait plasmid pKT25-gp22 and the genomic DNA library of S. paratyphi A were successfully constructed, which can be utilized in bacterial two-hybrid study.
bacterial two-hybrid system;bait vector;genomic library;early gene ;Salmonella paratyphi A
10.13560/j.cnki.biotech.bull.1985.2015.07.033
2014-11-03
国家自然科学基金项目(31160193),云南省教育厅科学研究基金项目(2010Y398),云南省应用基础研究面上项目(2010ZC055;2012FB135)
冯梦蝶,女,硕士研究生,研究方向:病原微生物;E-mail:fengmengdier@163.com
曾韦锟,男,博士,研究方向:病原微生物 ;E-mail:zengweikun@gmail.com

