泮托拉唑对肝癌细胞SMCC-7721迁移、侵袭及凋亡的影响
蔡孝莉 冉丽丹 文国容 金 海 庹必光遵义医学院附属医院消化内科,贵州遵义563000
泮托拉唑对肝癌细胞SMCC-7721迁移、侵袭及凋亡的影响
蔡孝莉冉丽丹文国容金海庹必光
遵义医学院附属医院消化内科,贵州遵义563000
目的观察泮托拉唑对人肝癌细胞SMMC-7721迁移、侵袭及凋亡的影响,预测其对人肝癌的抗癌作用。方法体外培养人肝癌细胞SMMC-7721细胞,细胞迁移和侵袭实验分为对照组和泮托拉唑不同浓度组(20、40、80、120、160μmol/L),对其进行干预,用细胞小室(Transwell)观察其对肝癌细胞迁移能力的影响;用Transwell小室上铺设基质胶观察泮托拉唑对细胞侵袭的影响;细胞凋亡实验分为对照组和泮托拉唑不同浓度组(40、80、160、320、640μmol/L),用流式细胞仪检测其对细胞凋亡的影响。结果泮托拉唑20μmol/L组对人肝癌细胞SMMC-7721的迁移和侵袭与对照组比较差异无统计学意义(P>0.05),而泮托拉唑40、80μmol/L组与对照组比较差异有统计学意义(P<0.05),并且泮托拉唑120、160μmol/L组与对照组比较差异均有高度统计学意义(P<0.01);另外,泮托拉唑40μmol/L组对人肝癌细胞SMMC-7721的凋亡与对照组比较差异无统计学意义(P>0.05),而泮托拉唑80、160、320、640μmol/L组与对照组比较差异有统计学意义(P<0.05或P<0.01)。结论泮托拉唑能抑制人肝癌细胞SMMC-7721迁移和侵袭,并促进凋亡,可能对人肝癌具有一定的抗癌作用。
泮托拉唑;肝癌细胞;细胞运动
肝癌是我国最高发的恶性肿瘤之一,因其高侵袭、高转移和复发,多数患者在确诊以后的生存时间较短。目前除了手术、化疗等,尚无很好的治疗方法,且疗效不如人意。研究发现[1-3],质子泵抑制剂(PPIs)对实体瘤细胞具有抗肿瘤活性,但对正常细胞则无影响。但目前国内外关于PPIs对恶性肿瘤的研究甚少。本实验选用不同浓度的泮托拉唑作用于肝癌细胞SMMC-7721,观察其对肝癌细胞的迁移、侵袭及凋亡能力的影响,为肝癌的治疗提供新的思路和方向。
1 材料与方法
1.1实验材料
人肝癌细胞SMCC-7721购于中国科学院上海细胞所;DMEM培养基、胎牛血清及胰蛋白酶均购于美国Hyclone公司;泮托拉唑购于美国Sigma公司;Matriger基质胶购于美国BD公司;Annexin V-FITC细胞凋亡检测试剂盒购于南京凯基生物公司;二氧化碳培养箱购于美国Thermo公司;图像分析系统购于德国Lecia公司;流式细胞仪购于美国BD公司。
1.2分组与给药
细胞迁移及侵袭实验分为对照组(细胞悬液不加任何药物)、泮托拉唑不同浓度组(20、40、80、120、160μmol/L);细胞凋亡实验分为对照组和泮托拉唑不同浓度组(40、80、160、320、640μmol/L);将用无血清培养基配制好的相应浓度的泮托拉唑加入事先准备好的细胞悬液中。
1.3实验方法
1.3.1细胞迁移实验取对数生长期细胞,用无血清培养饥饿24 h后,加入胰酶消化,用含10%胎牛血清(FBS)的DMEM培养基终止胰酶消化,并制成细胞悬液,使细胞悬液的终浓度为2×104/mL以备用;取孔径为8μm的Transwell小室,上室分别加入以上配置好的终浓度为2×104/mL细胞悬液100μL,其中,在对照组中上室再加入含无血清的培养基100μL,实验组则分别再加入事先用无血清培养基配制的各浓度的泮托拉唑100μL,使上室细胞悬液血清浓度为5%,下室则加入含20%FBS的DMEM培养基500μL;于37℃、5%CO2培养箱内培养24 h后,取出细胞小室,用棉签擦掉上室中的液体,用PBS缓冲液淋洗2遍,晾干;4%多聚甲醛固定15min后,用蒸馏水冲洗2遍,每次2min;然后苏木精复染7min后,再用自来水冲洗10min;95%乙醇5 s,晾干;伊红染色2min;75%酒精清洗2遍,每次2min;95%酒精清洗2遍,每次2min;二甲苯透明5 min后,用镊子将Transwell的膜取下,置于载玻片上,中性树胶封片,置于显微镜下观察细胞从上室迁移到下室膜表面的细胞个数并拍照,随机选取10个低倍视野进行细胞计数,并计算平均值。
1.3.2细胞侵袭实验事先将基质胶取出,置于4℃过夜备用;在Transwell小室上室铺设基质胶,基质胶用无血清培养基按1∶3稀释,37℃孵育30 min,待其凝固后用无血清培养基水化备用;上室加入细胞悬液100μL,其浓度为1×105/mL;其中,对照组再加入无血清培养基100μL,其余各组加入用无血清培养基配制的不同浓度的泮托拉唑100μL;于37℃、5%CO2培养箱内培养24 h,取出细胞小室,用棉签轻轻擦掉上室中的基质胶;用PBS清洗2遍,晾干;其余操作步骤同细胞迁移实验。
1.3.3细胞凋亡实验取对数生长期的肝癌细胞SMCC-7721,接种在35mm×12mm的培养皿中,细胞浓度调节为1×105/mL,在37℃、5%CO2培养箱中培养24 h,待其贴壁。细胞贴壁后,弃培养基,PBS缓冲液洗涤2次,加入含泮托拉唑的新培养基,泮托拉唑终浓度分别为40、80、160、320、640μmol/L,每浓度设置3个复孔,对照组用不含药物的10%FBS的DMEM培养基代替。培养24 h后,收集上清液中细胞及贴壁细胞,用PBS洗涤2次,用1×Binding Buffer悬浮细胞,调细胞浓度为1×106/mL,取300μL放入5 mL离心管中,各管分别先加5μL Annexin V-FITC,混匀,再加5μL PI混匀。避光反应15min后用流式细胞仪检测凋亡。
1.4统计学方法
采用SPSS 17.0软件进行分析,计量资料采用均数±标准差(x±s)表示,多组间比较采用单因素方差分析,以P<0.05为差异有统计学意义。
2 结果
2.1泮托拉唑对肝癌细胞SMMC-7721细胞迁移的影响
与对照组比较,泮托拉唑20μmol/L组对人肝癌细胞SMMC-7721的迁移没有影响(P>0.05),泮托拉唑40、80、120、160μmol/L组能抑制细胞的迁移,并随着药物浓度的提高,抑迁移作用逐渐增强(P<0.05或P<0.01)。见图1、表1。
2.2泮托拉唑对肝癌细胞SMMC-7721细胞侵袭的影响
与对照组比较,泮托拉唑20μmol/L组对人肝癌细胞SMMC-7721的侵袭没有影响(P>0.05),泮托拉唑40、80、120、160μmol/L组能抑制细胞的侵袭作用,且随着药物浓度的提高,抑制侵袭作用逐渐增强(P<0.05或P<0.01)。见图2、表2。

图1 不同浓度泮托拉唑对肝癌细胞SMMC-7721细胞迁移的影响(HE染色,200×)
表1 泮托拉唑对肝癌细胞SMMC-7721细胞迁移的影响(个,±s,n=8)

表1 泮托拉唑对肝癌细胞SMMC-7721细胞迁移的影响(个,±s,n=8)
注:与对照组比较,*P<0.05,**P<0.01
?
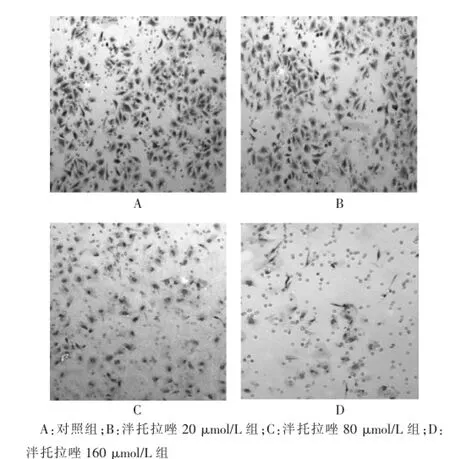
图2 不同浓度泮托拉唑对肝癌细胞SMMC-7721细胞侵袭的影响(HE染色,200×)
表2 泮托拉唑对对肝癌细胞SMMC-7721细胞侵袭的影响(个s,n=8)

表2 泮托拉唑对对肝癌细胞SMMC-7721细胞侵袭的影响(个s,n=8)
注:与对照组比较,*P<0.05,**P<0.01
?
2.3泮托拉唑对肝癌细胞SMMC-7721细胞凋亡的影响
与对照组比较,泮托拉唑40μmol/L组对人肝癌细胞SMMC-7721的凋亡没有影响(P>0.05),泮托拉唑80、160、320、640μmol/L组能促进细胞的凋亡,且随着药物浓度的提高,促凋亡作用逐渐增强(P<0.05或P<0.01)。见图3、表3。
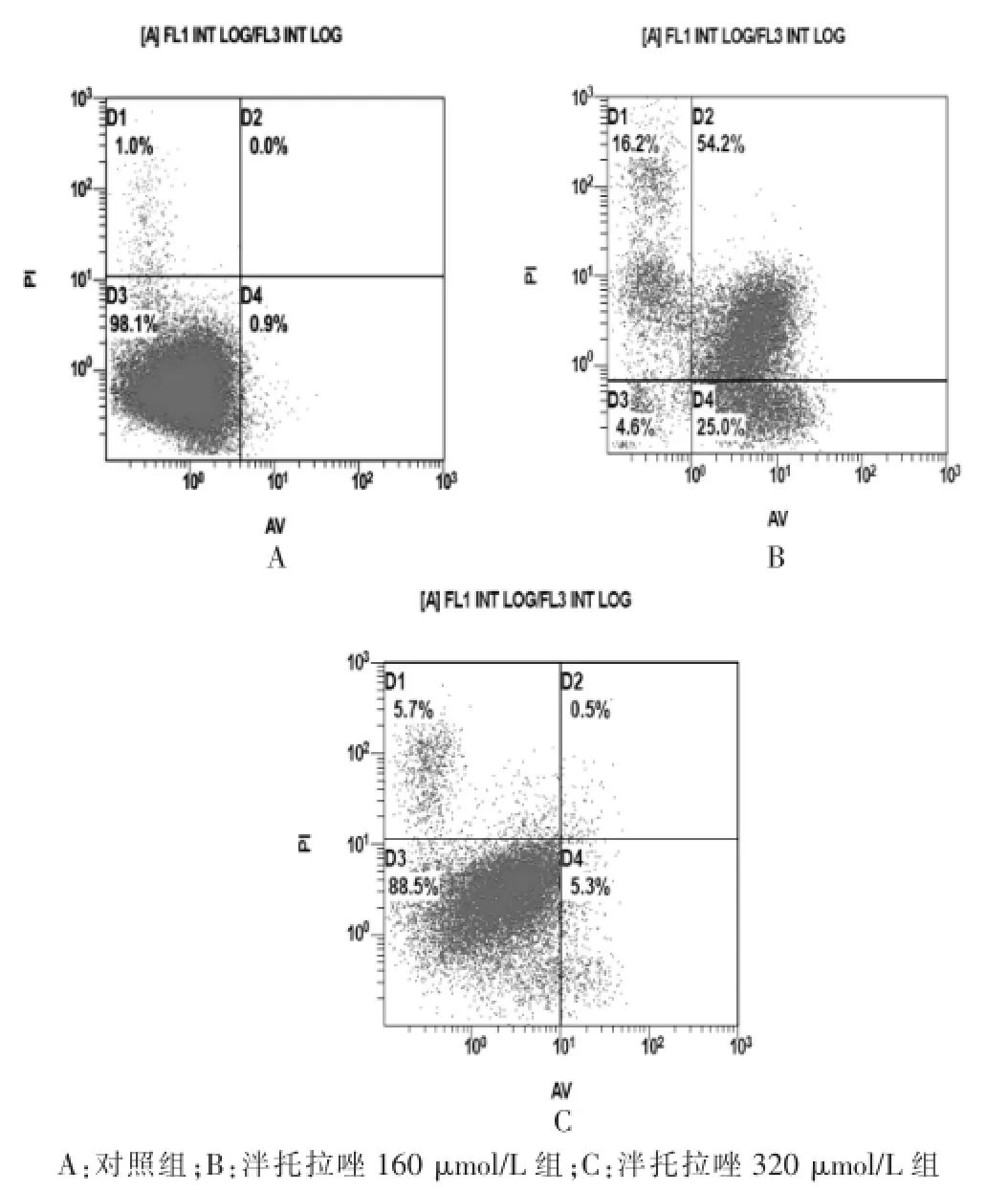
图3 不同浓度泮托拉唑对肝癌细胞SMMC-7721细胞凋亡的影响
表3 不同浓度泮托拉唑对肝癌细胞SMMC-7721细胞凋亡的影响(%,±s,n=8)

表3 不同浓度泮托拉唑对肝癌细胞SMMC-7721细胞凋亡的影响(%,±s,n=8)
注:与对照组比较,*P<0.05,**P<0.01
组别凋亡率对照组泮托拉唑40μmol/L组泮托拉唑80μmol/L组泮托拉唑160μmol/L组泮托拉唑320μmol/L组泮托拉唑640μmol/L组2.10±0.80 2.10±1.06 5.03±0.51*28.20±2.26*34.20±8.45**70.70±12.02**
3 讨论
随着肿瘤逐渐成为人类健康的主要威胁,寻找既能杀伤肿瘤细胞,又对人体正常细胞不良反应小或无不良反应的化疗药物成为近年来肿瘤治疗方面的新方向。V-ATPases是一种多蛋白复合物,广泛分布于真核细胞的囊泡膜和细胞膜,依赖ATP逆浓度梯度将H+泵出细胞外或者泵入细胞器囊泡腔内,维持细胞器的pH在7.0左右[4-5]。在大多数实体肿瘤细胞中,V-ATPases表达过量,并且与肿瘤的转移和浸润呈正相关,从而造就了肿瘤酸性微环境。有学者认为,肿瘤酸性微环境是癌症进展和转移的关键因素[6-8]。Chen等[6]发现PPI能抑制V-ATPases的表达,并扭转转运膜pH的梯度。研究发现人肝癌细胞中的V-ATPases明显上调,抑制V-ATPases可延缓肝癌细胞的生长[9]。因此,阻断V-ATPases的表达可以抑制人类癌症的生长和转移。最近研究肿瘤酸化的机制为针对VATPases提供了新的策略[10]。PPIs这类药物符合这一目标[11]。
PPIs是一类临床治疗酸相关疾病安全有效的药物。泮托拉唑是一种PPIs,能在pH<4的酸性环境下发挥抑制酸的作用,临床常用来抑制胃酸和应用于酸相关的疾病,其具有良好的安全性,几乎没有副作用。本实验选用不同浓度的PPIs泮托拉唑干预人肝癌细胞SMMC-7721,观察其对人肝癌细胞SMMC-7721的迁移、侵袭及凋亡的情况,从PPIs对癌症的影响这一角度着手探讨,本实验研究发现,选用不同浓度的泮托拉唑作用于SMMC-7721人肝癌细胞24 h后,与对照组比较,泮托拉唑20μmol/L组对细胞的迁移和侵袭无明显影响(P>0.05),在40μmol/L时有明显的抑制作用(P<0.05),并且随着药物浓度的增加作用逐渐增强。另外,选用不同浓度的泮托拉唑作用于SMMC-7721人肝癌细胞24 h后,与对照组比较,40μmol/L泮托拉唑对细胞的凋亡无明显影响(P>0.05),在80μmol/L时有明显的促凋亡作用(P<0.05),并且随着药物浓度的增加作用逐渐增强。
我国是全球肝癌发病率最高和病死数最多的国家,肝癌患者占全球的55%,肿瘤的侵袭与转移是影响肝癌患者生存期的重要因素,肝癌的高转移和复发率是直接导致肝癌患者死亡的主要原因[12]。寻找影响肝癌侵袭、转移,及促进肝癌细胞凋亡的药物已成为临床亟待解决的问题。PPIs一直以抑制胃酸分泌而著称,被广泛运用于消化道溃疡及反流性食管炎等酸相关性疾病。但新近的研究发现,PPIs可抑制肿瘤局部酸的分泌,从而抑制多种肿瘤的侵袭迁移等,如胃腺癌[13]、胰腺癌[14]、甲状腺癌[15]、黑色素瘤[16]等,可是,目前泮托拉唑对肝癌的作用仍不清楚。本实验研究结果提示,泮托拉唑能抑制肝癌细胞SMMC-7721细胞的侵袭和迁移,诱导细胞凋亡,泮托拉唑可能成为临床治疗肝癌的安全而有效的药物,但本实验仅从细胞水平探索泮托拉唑对肝癌细胞SMMC-7721的影响,而具体通过怎样的机制发挥作用还有待进一步的研究发现。
[1]Luciani F,Spada M,De Milito A,et al.Effect of proton pump inhibitor pretreatment on resistance of solid tumors to cytotoxicdrugs[J].JNatlCancer Inst,2004,96(22):1702-1713.
[2]De Milito A,Iessi E,Logozzi M,et al.Proton pump inhibitors induce apoptosis of human B-cell tumors through a caspase-independentmechanism involving reactive oxygen species[J].Cancer Res,2007,67(11):5408-5417.
[3]YeoM,Kim DK,Kim YB,etal.Selective induction ofapoptosiswith proton pump inhibitor in gastric cancer cells[J]. Clin Cancer Res,2004,10(24):8687-8696.
[4]Nishi T,Forgac M.The vacuolar H+-ATPases-nature's most versatileproton pumps[J].NatRevMolCellBiol,2002,3(2):94-103.
[5]Swietach P,Vaughan-Jones RD,Harris AL.Regulation of tumor pH and the role of carbonic anhydrase 9[J].Cancer Metastasis Rev,2007,26(2):299-310.
[6]Chen M,Zou XP,Luo HS,et al.Effects andmechanisms of proton pump inhibitors as a novel chemosensitizer on human gastric adenocarcinoma(SGC7901)cells[J].Cell Biol Int,2009,33(9):1008-1019.
[7]Chiche J,Brahimi-Horn MC,Pouysségur J.Tumor hypoxia induces a metatloic shift causing acidosis:a common feature in cancer[J].JCell MolMed,2010,14(4):771-794.
[8]Trédan O,GalmariniCM,Patel K,etal.Drug resistance and the solid tumormicroenvironment[J].JNatl Cancer Inst,2007,99(19):1441-1454.
[9]Xu J,Xie R,Liu X,et al.Expression and functional role of vacuolar H+-ATPases in human hepatocellular carcinoma[J].Carcinogenesis,2012,33(12):2432-2440.
[10]Fais S,De Milito A,You HY,et al.Targeting vacuolar H+-ATPases as a new strategy against cancer[J].Cancer Res,2007,67(22):10627-10630.
[11]Barrison AF,Jarboe LA,Weinberg BM,et al.Patterns of proton pump inhibitoruse in clinicalpractice[J].Am JMed,2001,111(6):469-473.[12]Wong CC,Wong CM,Tung EK,et al.Rho-kinase 2 is frequently overexpressed in hepatocellular carcinoma and involved in tumor invasion[J].Hepatology,2009,49(5):1583-1594.
[13]ShenWD,Zou XP,Chen M,etal.Effectof pantoprazole on human gastric adencarcinoma SGC7901 cells through regulation of phosphor-LRP6 expression in Wnt/β-catenin signaling[J].Oncology Reports,2013,30(2):851-855.
[14]Udelnow A,Kreyes A,Ellinger S,et al.Omeprazole inhibits proliferation andmodulates autophagy in pancreatic cancer cells[J].PloSOne,2011,6(5):e20143.
[15]Mirzababaee M,Shafiei B,Seifollahi S,et al.Management of gastrointestinal complaints in differentiated thyroid cancer patients treated with131I:comparison of the efficacy ofpantoprazole,metoclopramide,and ondansetrona randomized clinical trial[J].Nuklearmedizin,2014,53(5):186-189.
[16]Marino ML,Fais S,Djavaheri-Mergny M,et al.Proton pump inhibition induces autophagy as a survivalmechanism followingoxidativestressin humanmelanoma cells[J]. Cell Death Dis,2010,1:e87.
Effects of Pantoprazole on m igration,invasion and apoptosis of human liver carcinoma SMCC-7721 cells
CAIXiaoli RAN Lidan WEN Guorong JIN Hai TUO Biguang
Department of Gastroenterology,Affiliated Hospital of Zunyi Medical University,Guizhou Province,Zunyi 563000,China
Ob jective To investigate the effects of Pantoprazole on themigration,invasion and apoptosis of human liver carcinoma SMMC-7721 cell,and to predict its anti-cancer effect on liver cancer.Methods In vitro cultivation of human liver carcinoma SMMC-7721 cells,cellmigration and invasion experiments were divided into control group and different concentrations of Pantoprazole groups(20,40,80,120,160μmol/L),Transwell chamber assay was used to detect the migration of SMMC-7721 cells.Transwell chamber assay was used to detect the invasion of SMMC-7721 cells.Cell apoptosis experimentwas divided into control group and different concentrations of Pantoprazole groups(40,80,160,320,640μmol/L),FCM test was used to detect the apoptosis of SMMC-7721 cells.Results The migration and invasion of Pantoprazole 20μmol/L group had no statistically significant differences in SMMC-7721 cells compared with control group(P>0.05),while Pantoprazole 40,80μmol/L group had a statistically significant difference compared with control group(P<0.05),and Pantoprazole 120,160μmol/L group were highly statistically significant different compared with control group(P<0.01).In addition,apoptosis of Pantoprazole 40μmol/L group was not statistically significant in SMMC-7721 cells compared with control group(P>0.05),and Pantoprazole 80,160,320,640μmol/L group were statistically significant compared with control group(P<0.05 or P<0.01).Conclusion Pantoprazole can inhibit human liver carcinoma SMCC-7721 cellsmigration and invasion,and promote apoptosis,it may have certain anti-cancer effect on human liver.
Pantoprazole;Hepatoma cell;Cellmovement
R735.7
A
1673-7210(2015)05(a)-0007-05
2015-01-06本文编辑:张瑜杰)
国家自然科学基金项目(81360311)。
蔡孝莉(1987.1-),女,遵义医学院2012级消化内科专业在读硕士研究生,主要从事消化系统肿瘤及离子通道转运研究。
庹必光(1963.8-),男,博士,教授,主要从事消化系统肿瘤及离子通道转运研究。

