一株高效四环素降解菌的分离鉴定及其降解性能研究
张欣阳 蔡婷静 许旭萍
(福建师范大学生命科学学院,福州 350108)
一株高效四环素降解菌的分离鉴定及其降解性能研究
张欣阳 蔡婷静 许旭萍
(福建师范大学生命科学学院,福州 350108)
四环素类抗生素在畜牧养殖业中广泛使用,但其结构复杂,难降解,容易在水环境中积蓄,进而对生态环境产生深远影响,许多国家已将抗生素污染列为重要的环境问题展开了相关的基础研究。近年来利用微生物降解环境中的抗生素污染物成为研究热点。采用选择性培养基,从某制药厂排污口的水样中分离筛选到1株具有较高降解四环素能力的菌株4002,经形态观察、生理生化测定和16S rDNA序列分析,将该菌初步鉴定为Advenella sp.。从pH、溶氧量、无机盐等方面对菌株降解四环素的性能进行研究。结果表明,该菌株降解四环素的适宜pH为7.0,在有氧条件下,30℃,150 r/min振荡培养6 d,可使初始浓度为50 μg/mL四环素降解率达57.8%。无机盐对降解率有显著影响,添加FeSO4和MnSO4对四环素降解有促进作用,MgSO4影响不大,CaSO4则有抑制作用。在培养至第8天时,培养液经HPLC检测显示6.022 min处出现新的吸收峰,推测为降解产物。
四环素降解菌;筛选;鉴定;降解性能
20世纪40年代以来,抗生素作为药物治疗动物疾病的同时,也被用于饲料的添加剂以促进动物的生长[1]。研究表明四环素类抗生素进入动物体内后不能被完全吸收,大约有75%以原型或母体化合物的形式排出体外,这些抗生素作为环境外源性化学物对生态和环境生物将产生深远的影响。例如,导致人类产生抗药性等,并最终对人类的生存和健康造成危害[2,3]。四环素类抗生素由于其成本低廉、使用方便等原因在世界各国得到大量的使用。我国是世界上四环素类抗生素的生产、使用和销售大国,2008年四环素类药物仅出口量就达1.34×l07kg[4]。近年来,随着对生态环境的日益关注,有关四环素类抗生素的生态毒性、残留污染的问题越来越引起人们的重视。抗生素进入环境中会发生一系列降解反应,主要包括生物降解和非生物降解[5]。其中,非生物降解过程包括光降解、氧化降解、水解等;生物降解过程包括植物降解和微生物降解两种方式[6]。与其他处理方法相比,利用微生物处理抗生素残留物,条件简单、容易控制、成本较低、专一性较强、不会引起二次污染,是目前最为经济有效的方法,主要包括好氧处理、厌氧处理、复合菌系处理和固定化微生物处理等[7]。目前国外多为物理化学方法[8-11]、复合生物技术[12,13]及堆肥工艺[14,15]等,鲜有报道能够降解四环素的单一微生物菌株;国内已报道少许四环素降解菌,如许晓玲[16]筛选得到的缺陷短波单胞菌(Brevundimonas diminuta)和人苍白杆菌(Ochrobactrum anthropi)等,但总体而言并不多见。
本试验从抗生素制药厂排污口水样中分离筛选出1株对四环素具有一定降解能力的细菌,对其进行分类鉴定,研究影响该菌株降解四环素的理化因素,并对其降解四环素的产物进行初步分析,为该菌应用于处理四环素环境污染奠定基础和提供理论依据。
1 材料与方法
1.1 材料
样品:本实验样品采自福州某制药厂排污口河道内的污水和污泥。
基础培养基(g/L): 牛肉膏3,蛋白胨10,NaCl 5,pH7.0-7.4。该培养基用于菌种活化。选择培养基:在基础培养基中按照试验要求添加不同浓度的四环素。固体培养基加入15-20 g/L琼脂。
药品:四环素标准品(C22H24N2O8·HCl),购于北京鼎国昌盛生物技术有限责任公司。
1.2 方法
1.2.1 四环素降解菌的富集、分离纯化及筛选 称取1 g污泥或吸取1 mL污水样品,加到装有99 mL无菌水的250 mL三角瓶中,充分振荡后静置片刻,取1 mL上清液加到含50 μg/mL四环素的选择培养基中,置于30℃,150 r/min恒温摇床中培养至培养液出现明显的浑浊(约3 d),吸取此培养液1 mL,再接种到四环素浓度为100 μg/mL的选择培养基中,于相同条件下培养3 d。以此类推,进行富集,每次移接时,逐步提高选择培养基中的四环素浓度,直至350 μg/mL。富集结束时,取1 mL培养液进行梯度稀释,取2-3个适宜稀释度的菌液,采用平板涂布法进行分离,挑选菌落形态外观不同的单菌落划线进一步分离纯化后,挑取单菌落接种至斜面,编号保存。
将分离获得的各菌株分别接种到基础培养基中,经培养后制成种子液。各取1 mL种子液接种至四环素浓度为50 μg/mL的99 mL选择培养基内,30℃,150 r/min培养3 d后,采用药敏试验法测定培养液中四环素残留量。以金黄色葡萄球菌为指示菌,测定抑菌圈直径。抑菌圈越小的菌株,即表示其对四环素的降解能力越强。选择降解力较高的菌株进行复筛。
1.2.2 四环素降解菌的分类鉴定
1.2.2.1 降解菌株培养特征及生理生化鉴定 将降解菌接种到基础培养基平板上,30℃恒温培养24 h后观察菌落形态,并进行革兰氏染色后用普通光学显微镜观察菌体形态。根据《伯杰氏细菌鉴定手册》[17]和《常见细菌系统鉴定手册》[18}进行生理生化鉴定。
1.2.2.2 降解菌株16S rDNA序列分析 提取细菌基因组DNA,正向引物为27f:5'-AGAGTTTGATCCTGGCTCAG-3',反向引物为1492r:5'-GGTTACCTTGTTACGACTT-3'。PCR扩增在DL9700扩增仪上进行,扩增体系为典型扩增体系。反应条件为:94℃预变性5 min后进行35个循环,每个循环包括94℃变性30 s,52℃退火30 s,72℃延伸100 s,循环结束后72℃延伸10 min。对PCR扩增后的产物进行纯化,16S rDNA的测序工作由北京鼎国生物技术有限公司完成。将测得菌株的16S rDNA序列在NCBI中进行BLAST研究其同源性,选取同源性相近的细菌,构建进化树。
1.2.3 四环素降解菌的降解性能测定
1.2.3.1 降解菌降解四环素的曲线 将降解菌接种至基础培养基中,培养3 d制成种子液。种子液以1%接种量接种到含四环素为50 μg/mL的选择培养基中,30℃,150 r/min振荡培养,每隔24 h取样测定培养液中四环素残留量,计算降解率,绘制降解曲线。试验设3个重复,结果取其平均值。并以相同条件下进行培养的不接菌培养基作为对照。
1.2.3.2 pH对降解菌降解四环素的影响 分别配制pH为5.0、6.0、7.0、8.0、9.0、10.0含四环素50 μg/mL的选择培养基,接种1%的降解菌种子液,30℃,150 r/min振荡培养6 d,测定培养液中四环素的残留量,计算四环素降解率。试验设3个重复,结果取其平均值。
1.2.3.3 溶氧量对降解菌降解四环素的影响 将降解菌种子液以1%的接种量接种到含四环素50 μg/mL的选择培养基中,分别放置于30℃有氧培养(150 r/min 振荡培养)、缺氧培养(静置培养,瓶口包有无菌滤膜)、厌氧培养(静置培养,瓶口塞有厌氧橡胶塞),培养6 d后,取样测定培养液中四环素的残留量,计算四环素降解率。试验设3个重复,结果取其平均值。
1.2.3.4 无机盐对降解菌降解四环素的影响 在选择培养基中分别添加0.03%的CaSO4,MgSO4,FeSO4,MnSO4等4种无机盐。接种1%的降解菌种子液,30℃,150 r/min振荡培养6 d。测定培养液中四环素的残留量,计算四环素降解率。试验设3个重复,结果取其平均值。
1.2.4 四环素测定方法
1.2.4.1 药敏法 试验步骤见参考文献[19],以金黄色葡萄球菌为指示菌,测定培养液的抑菌圈大小,并根据四环素含量标准曲线换算成四环素浓度。标准曲线的制作:用无菌水配制浓度分别为10、20、30、40、50、60、70及80 μg/mL等一系列浓度梯度的四环素标准溶液,分别测定不同浓度四环素对金黄色葡萄球菌的抑菌圈大小,以四环素浓度为横坐标,抑菌圈直径为纵坐标,制作四环素含量标准曲线,用于换算培养液中四环素的浓度。
四环素降解率(%)=(初始浓度-剩余浓度)/初始浓度×100%
1.2.4.2 高效液相色谱法(HPLC) 用HPLC分析不同培养时间培养液中四环素含量及其产物。HPLC测定方法参照文献[20]并稍作改进。色谱条件为Waters Acquity HPLC色谱仪;Acquity HPLCTM,C18,1.7 μm,2.1 mm×50 mm色谱柱;流动相:草酸(0.01 mol/L)∶乙腈∶甲醇=70∶25∶5(体积比);流速:0.2 mL/min;柱温:30℃;检测波长:289 nm。进样量2 μL。
2 结果
2.1 标准曲线的测定
采用药敏试验法测定不同四环素浓度对金黄色葡萄球菌的抑菌圈大小,得到标准曲线如图1。

图1 四环素浓度标准曲线
2.2 四环素降解菌的筛选
经过初筛和复筛得到4株降解四环素能力较强的菌株,分别编号为6、12、4001、4002。对这4株菌再次复筛,最终确定4002具有高效的四环素降解能力。
2.3 四环素降解菌4002的分类鉴定
2.3.1 形态特征及生理生化鉴定 菌株4002在牛肉膏蛋白胨培养基(基础培养基)平板上的菌落形态见图2。其菌落呈乳白色,表面及边缘光滑湿润,圆形,直径在1- 2 mm之间。菌体呈短杆状,大小为(0.41-1.02)μm×(0.41-1.53)μm,无芽孢,无鞭毛,为革兰氏阴性菌,见图3。其生理生化鉴定结果,见表1。

图2 菌株4002菌落特征

图3 菌株4002菌体形态(1000×)

表1 菌株4002的生理生化特征
2.3.2 四环素降解菌4002的16S rDNA序列分析
PCR扩增后的16S rDNA大小为1 432 kb,其在GenBank中申请获得的序列号为KM191133。在NCBI中进行BLAST比对,研究其同源性,选取同源性相近的细菌,构建进化树。
用MEGA4软件绘制系统进化树(图4)可知,菌株4002与Advenella kashmirensis,strain 445C(AJ-864472)的进化关系最近。经过BLAST比对,4002与 Advenella kashmirensis,strain 445C的 16S rDNA序列相似度为99%。将该菌株初步鉴定为Advenella sp.。该菌株应用于四环素降解目前尚未见文献报道,说明这是一种新的四环素降解菌菌种资源。

图4 降解菌4002系统进化树
2.4 四环素降解菌4002的降解性能
2.4.1 降解菌4002降解四环素的曲线 由图5可知,随着培养时间的延长,培养液中四环素的残留量逐渐减少。接有菌株4002的试验组显示,前5 d四环素的残留量下降较慢,5 d后迅速下降,在第6天达到较低值,根据标准曲线和抑菌圈直径计算可知降解率为53.0%,高于不接菌空白对照组(34.7%)。其后继续培养降解率提高较小,所以后续试验确定降解周期为6 d。
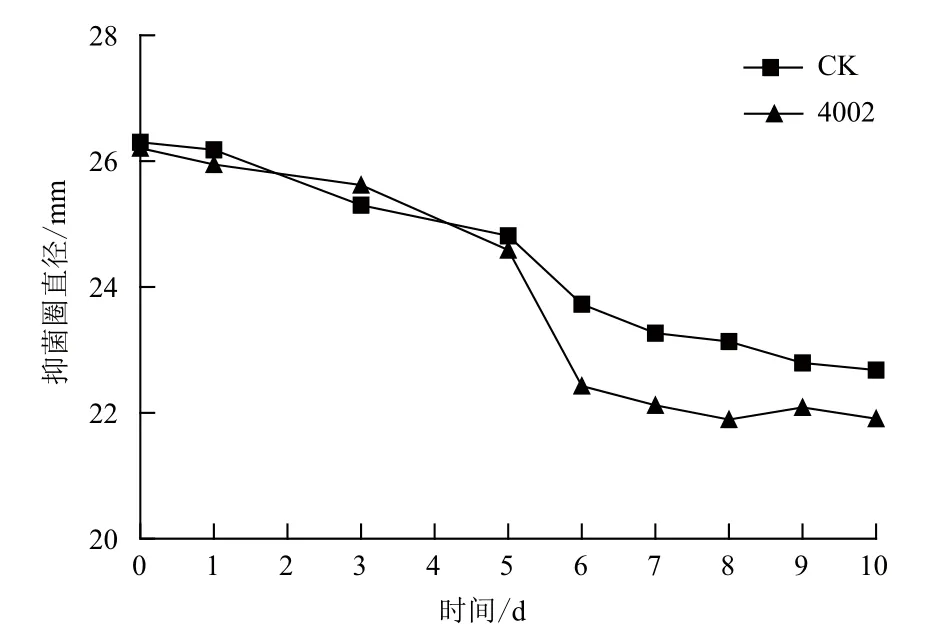
图5 降解菌4002降解四环素的曲线(抑菌圈法)
2.4.2 pH值对降解菌4002降解四环素的影响 将培养基分别调整为不同的pH,接种后进行培养,研究pH对菌株4002降解四环素的影响,结果见图6。当pH为7.0时,抑菌圈最小,四环素的降解率为57.8%。

图6 pH值对降解菌4002降解四环素的影响
2.4.3 溶氧量对降解菌降解四环素的影响 由图7可知,在有氧条件下,四环素的残留量最少,抑菌圈最小,降解率为57.8%;而缺氧培养与厌氧培养,抑菌圈基本一致,但明显比有氧条件下的抑菌圈大。说明好氧条件更有利于菌株4002对四环素的降解。
2.4.4 无机盐对降解菌4002降解四环素的影响 在选择培养基中添加 CaSO4、FeSO4、MgSO4、MnSO44种不同的无机盐进行四环素降解试验,并以不添加无机盐的选择培养基作为对照,结果见图8。在选择培养基中添加FeSO4对菌株4002降解四环素有显著地促进作用,培养6 d时四环素的降解率达到100%,比没有添加的对照组提高了44.3%,其次是MnSO4,降解率为65.4%,比对照提高了9.7%。添加MgSO4的降解率为57.6%与对照组差别不大,而CaSO4的加入对四环素降解一定的抑制作用,降解率仅为34.3%。

图7 溶氧量对降解菌降解四环素的影响

图8 无机盐对四环素降解的影响
2.5 HPLC 检测四环素
用超纯水配置四环素水溶液标准品,HPLC检测出峰时间约为4.69 min。用HPLC测定不同培养时间的培养液中剩余的四环素浓度及吸收峰变化,四环素所对应的峰面积减小说明残留量下降。结果显示,随着培养时间的延长,四环素的特征峰的峰面积逐渐减少(图9-图13)。在接种后培养的前5 d,培养液中四环素的峰面积减少较慢(图9,图10);且在培养7 d内未检测到产物峰(图9-图12)。但培养8 d时,四环素的峰面积明显下降,且在6.022 min时出现新的未知物质吸收峰(图13双箭头所示),可以看出在4002菌株的作用下四环素发生了降解,产生新的降解产物(其余吸收峰为培养基中物质的吸收峰)。

图9 第3天培养液中四环素的HPLC峰面积

图10 第5天培养液中四环素的HPLC峰面积
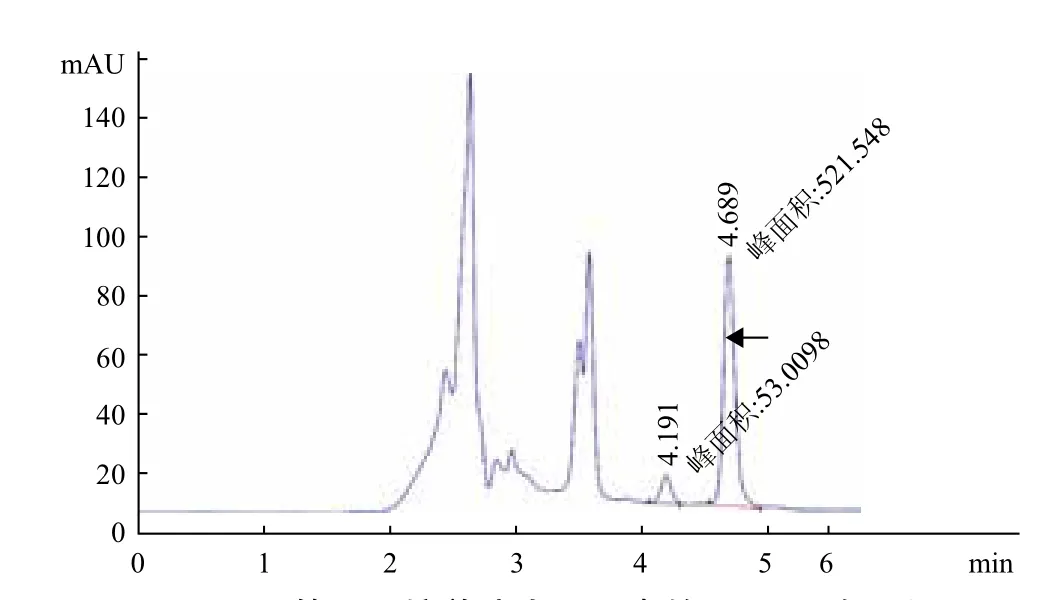
图11 第6天培养液中四环素的HPLC峰面积

图12 第7天培养液中四环素的HPLC峰面积
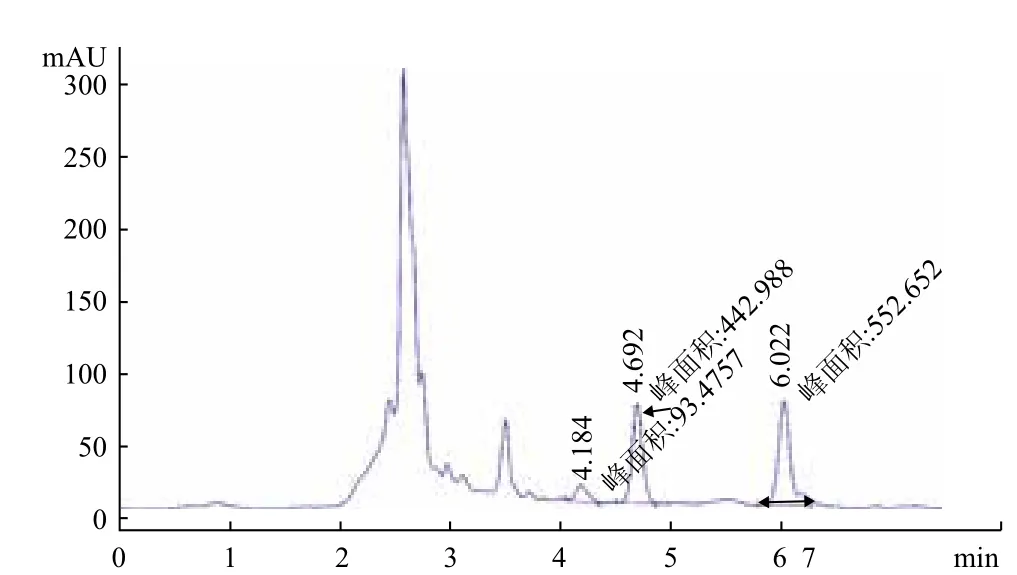
图13 第8天培养液中四环素的HPLC峰面积
3 讨论
已有研究表明四环素在过酸或过碱的环境下都不稳定,在过酸环境下容易发生脱水反应和差向异构化,过碱环境下易形成无效的内酯型异构体,而在中性环境下较为稳定[22]。大多数自然水体pH接近中性,不利于四环素的自然降解,本试验菌株降解四环素适宜的pH为7.0,在四环素污染水体中则可起到有效的降解作用,有利于水体净化。
不同的微生物具有不同的代谢类型,如好氧、厌氧、兼性厌氧等。要提高菌株的降解能力,合适的培养条件至关重要。环境中好氧微生物在充足的氧气条件下能够迅速生长,进而提高降解效率。据已有的实际应用可知,工业处理抗生素废水时好氧微生物的使用更为广泛。在试验中,三角瓶的装液量与溶氧量成负相关,因此可从装液量的多少间接反应溶氧量的多少。从许晓玲[16]报道的两株四环素降解菌的研究可见,随着装液量的增加,菌体的OD值下降,四环素的残留量上升。无丙二酸柠檬酸杆菌是马志强等人报道的一株四环素高效降解菌[23],当装液量从50 mL上升到200 mL时,菌株对四环的降解率降低约50%。说明微生物在好氧条件下更容易发挥对四环素的降解作用。这与本试验菌株4002在好氧条件下的降解率好于厌氧和缺氧是相似的。无丙二酸柠檬酸杆菌在优化条件下培养3 d,四环素的去除率可以达到86.1%。但该菌适宜的降解条件为:pH 5.5,温度35℃。
有研究指出Fe2+具有很强的光敏化作用,可以加强抗生素在环境中的降解[24]。这可以解释本试验在培养基中加入FeSO4后大大提高了四环素降解率的原因。与已报道的四环素降解菌Trichosporon mycotoxinivorans[25]相比,MnSO4的添加可以在一定程度上促进四环素的降解,而MgSO4则对降解率影响较小的结果是一致的;但添加CaSO4的试验结果与本试验略有不同。这可能与不同菌株的生长对无机盐的要求不同有关。郝文静等[26]报道Advenella kashmirensis具有降解海洋石油的能力,但尚未见该种细菌能够降解四环素的相关报道。菌株4002是一种新发现的能够降解四环素的微生物资源,其温和的pH及培养温度显示出该菌在自然环境下对抗生素废水的处理具有实际的应用前景和潜力。
4 结论
分离筛选到1株四环素降解菌株4002,经鉴定为Advenella sp.。
pH、溶氧量及无机盐对菌株4002降解四环素的能力有影响,其中无机盐的种类对四环素降解影响显著。该菌株在pH7.0、有氧培养的条件下对四环素的降解能力均好于同因素的其它条件,FeSO4和MnSO4的加入均促进降解,MgSO4对降解影响不大,CaSO4对降解有一定的抑制作用。
培养8 d时,用HPLC分析可见在6.02 2min处出现了新的吸收峰,推测可能为菌株4002对四环素的降解产物。
[1] 陈代杰. 抗菌药物与细菌耐药性[M]. 上海:华东理工大学出版社. 2001
[2] Chee-Sanford JC, Mackie RI, Koike S, et al. Fate and transport of antibiotic residues and antibiotic resistance genes following land application of manure waste[J]. Journal of Environ Mental Quality, 2009, 38:1086-1108.
[3] Martinez JL. Environmental pollution by antibiotics and by antibiotic resistance determinants[J]. Environmental Pollution, 2009, 157: 2893-2902.
[4] 贺德春, 许振成, 吴根义, 等. 四环素类抗生素的环境行为研究进展[J]. 动物医学进展, 2011, 32(4):98-102.
[5] 刘锋, 陶然, 应光国, 等. 抗生素的环境归宿与生态效应研究进展[J]. 生态学报, 2010, 30(16):4503-4519.
[6] 李伟明, 鲍艳宇, 周启星. 四环素类抗生素降解途径及其主要降解产物研究进展[J]. 应用生态学报, 2012, 23(8):2300-2308.
[7] 唐礼庆, 何成达, 罗亚红, 等. 四环素类抗生素生产废水处理技术进展[J]. 环境科学与管理, 2006, 31(7):99-102.
[8] Wang Y, Zhang H, Zhang J, et al. Degradation of tetracycline in aqueous media by ozonation in an internal loop-lift reactor[J]. Journal of Hazardous Materials, 2011, 192(1):35-43.
[9] Zhang H, Liu F, Wu X, et al. Degradation of tetracycline in aqueous medium by electrochemical method[J]. Asia-Pacific Journal of Chemical Engineering, 2009, 4(5):568-573.
[10] Reyes C, Fernández J, Freer J, et al. Degradation and inactivation of tetracycline by TiO2 photocatalysis[J]. Journal of Photochemistry and Photobiology A:Chemistry, 2006, 184. (1):141-146.
[11] Bautitz IR, Nogueira RFP. Degradation of tetracycline by photo-Fenton process—Solar irradiation and matrix effects[J]. Journal of Photochemistry and Photobiology A:Chemistry, 2007, 187(1):33-39.
[12] Yu TH, Lin A YC, Panchangam SC, et al. Biodegradation and biosorption of antibiotics and non-steroidal anti-inflammatory drugs using immobilized cell process[J]. Chemosphere, 2011, 84(9):1216-1222.
[13] Li B, Zhang T. Biodegradation and adsorption of antibiotics in the activated sludge process[J]. Environmental Science & Technology,2010, 44(9):3468-3473.
[14] Ho YB, Zakaria MP, Latif P A, et al. Degradation of veterinary antibiotics and hormone during broiler manure composting[J]. Bioresource Technology, 2013, 131:476-484.
[15] Hu Z, Liu Y, Chen G, et al. Characterization of organic matter degradation during composting of manure-straw mixtures spiked with tetracyclines[J]. Bioresource Technology, 2011, 102(15):7329-7334.
[16] 许晓玲, 李卫芬, 雷剑, 等. 四环素降解菌的选育, 鉴定及其降解特性[J]. 农业生物技术学报, 2011, 19(3):549-556.
[17] 布坎南RE, 吉本斯NE. 伯杰氏细菌鉴定手册[M]. 北京:科学出版社, 1984.
[18] 常见细菌系统鉴定手册[M]. 北京:科学出版社, 2001.
[19] 中国兽药典委员会. 中华人民共和国兽药典[M]. 北京:化学工业出版社, 2000:69.
[20] 孙刚, 袁守军, 彭书传, 等. 固相萃取-高效液相色谱法测定畜禽粪便中的土霉素、金霉素和四环素[J]. 环境化学,2010, 29(4):739-743.
[21] 胡学香, 陈勇, 聂玉伦, 等. 水中四环素类化合物在不同光源下的光降解[J]. 环境工程学报, 2012, 6(8):2465-2469.
[22] Halling-Sørensen B, Lykkeberg A, Ingerslev F, et al. Characterisation of the abiotic degradation pathways of oxytetracyclines in soil interstitial water using LC-MS-MS[J]. Chemosphere, 2003, 50(10):1331-1342.
[23] 马志强, 马玉龙, 谢丽, 等. 微生物法降解药渣中残留四环素的试验研究[J]. 环境科学与技术, 2012, 35(1):46-49.
[24] 刘伟, 王慧, 陈小军, 等. 抗生素在环境中降解的研究进展[J].动物医学进展, 2009, 30(3):89-94.
[25] 冯福鑫, 许旭萍, 程群星, 等. 四环素高效降解酵母菌Trichosporon mycotoxinivorans XPY-10 降解特性[J]. 环境工程学报, 2013, 7(12):4779-4785.
[26] 郝文静. 高效海洋石油降解菌的筛选鉴定及生物修复研究[D]. 大连:大连交通大学, 2013.
(责任编辑 李楠)
Isolation and Identification of A Tetracycline-degrading Bacterium and Optimizing Condition for Tetracycline Degradation
Zhang Xinyang Cai Tingjing Xu Xuping
(College of Life Sciences,Fujian Normal University,Fuzhou 350108)
Tetracycline antibiotics have been widely used in the livestock industry, but its complex structure, difficult to degrade, easy to accumulate in the water environment and produce a far-reaching impact on the ecological environment, antibiotic pollution as an important environmental issues has expanded the related basic research. Microbial degradation of the environment antibiotic pollution in recent years become a hotspot method. The selective media was used to isolate and screen the tetracycline-degrading bacteria. A high efficiency tetracyclinedegrading bacterium(4002)was selected from sewage of a pharmaceutical factory. According to the morphological features, physiological and biochemical characteristics and the sequence analysis of 16S rDNA, the strain was identified as Advenella kashmirensi. Besides, the pH,dissolved oxygen, inorganic salts and other aspects of the strains were analyzied to study the degradation performance of tetracycline. The results showed that, the strain suitable conditions for the degradation of tetracycline are pH7.0, under aerobic condition, 150 r/min and cultured with shaking 6 d, the initial concentration of 50 μg/mL tetracycline degradation rate of 57.8%. FeSO4and MnSO4can promote degradation of tetracycline and little impact on MgSO4, but CaSO4can inhibit degradation. After cultured for 8 d, the culture solution by HPLC detection showed at 6.022 min emergence of a new absorption peak, which was speculated as the degradation product.
tetracycline-degrading strain;screening;identification;degradation performance
10.13560/j.cnki.biotech.bull.1985.2015.01.026
2014-06-18
福建省自然科学基金项目(2011J01150,2013J01123)
张欣阳,女,硕士研究生,研究方向:环境微生物;E-mail:xinyang.jun@gmail.com
许旭萍,女,教授,硕士生导师,研究方向:微生物资源与环境微生物技术;E-mail:xuping@fjnu.edu.cn

