碳酸乙烯酯与丁二酸二甲酯耦合反应制备聚丁二酸乙二醇酯预聚体的热力学分析
王丽苹
(曲靖师范学院化学化工学院,云南 曲靖 655011)
聚丁二酸丁二醇酯(PBS)具有优异的性能,可完全生物降解为CO2和H2O。但PBS的价格偏高,限制了其使用范围。聚丁二酸乙二醇酯(PES)具有良好的力学性能、耐热性能和加工性能,且其降解速度较PBS快,成本较低,可以填充或直接替代PBS[1]。因此,PES的合成和应用研究已成为热点。
丁二酸二甲酯(DMSu)与碳酸乙烯酯(EC)耦合反应制备PES,同时联产碳酸二甲酯(DMC),另外,该反应路线还可避免产生大量的甲醇,减少了能量的损耗,提高了原子利用率,是一条真正意义的绿色化学清洁生产工艺路线,极具经济价值[2]。
该过程主要包括以下几个反应:反应式 (1)是DMSu与EC耦合反应的第一步,生成中间产物;中间产物可能如反应式(2)所示,与DMSu反应生成预聚体丁二酸乙二醇酯,也可按照反应式(3)反应路径进行,生成单边产物(如虚线框所示),单边产物继续按反应式(3)反应,生成PES和DMC;反应式(4)为总包反应。
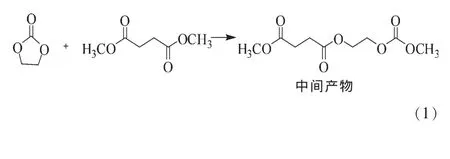
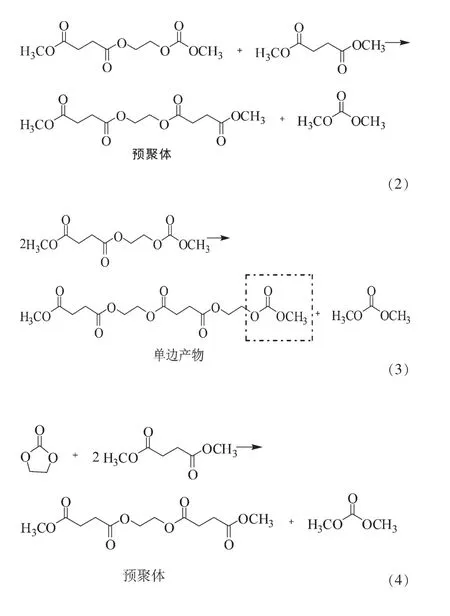
目前,有关EMSu和EC耦合反应的热力学分没有报道,本文对该耦合反应进行了热力学计算和分析,以期为操作条件的确定、反应装置的设计及催化剂的制备提供理论依据和指导。
1 热力学计算
1.1 298K时理想气体标准摩尔生成热ΔfHθg,298的估算
Benson法以原子或原子团为中心,并考虑到与此原子或原子团相连接的原子或原子团的不同来划分基团。在确定基团数时考虑了次相邻原子间的影响,对于那些不能在基团参数中反映出来的因素(如顺反异构、位置异构、交叉异构等)则另设修正项,具有较高的精密度,几乎适用于所有有机物,温度适用范围为300~1500K,误差一般为2.0kJ/mol[3-4]。因此,本工作采用Benson法估算ΔfHθg,298,计算式见式(1),式中 ni为基团个数,ΔfHθg,298为基团贡献值,参见文献[3]。

DMSu、EC、中间产物、预聚体、单边产物、DMC的 ΔfHθg,298的计算值分别为-792.80kJ/mol、-550.66kJ/mol、 -1343.46kJ/mol、 -1568.84kJ/mol、 -2119.5kJ/mol、-567.42kJ/mol。 文献[5]报道,DMC 的 ΔfHθg,298为-570.40kJ/mol,计算值与文献值相差不大,说明Benson法估算化合物的ΔfHθg,298可靠。
1.2 不同温度下蒸发焓的计算
采用Ma-Zhao法计算丁二酸二甲酯、碳酸乙烯酯、PES和DMC在各自沸点下的蒸发焓,计算式见式(2)和式(3),基团贡献值参见文献[3]。
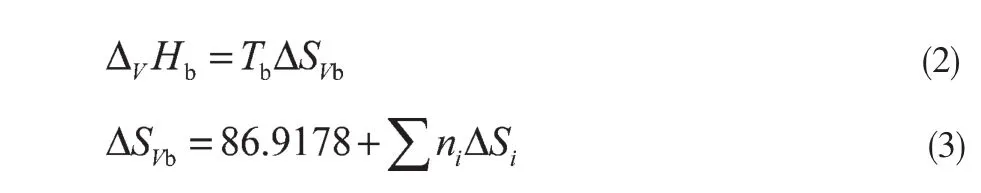
DMSu、EC、中间产物、预聚体、单边产物、DMC的 ΔvHb的计算值分别为 47.23kJ/mol、39.59kJ/mol、71.81kJ/mol、85.21kJ/mol、103.52kJ/mol、34.02kJ/mol。文献[6]报道,DMC的为33.82 kJ/mol,计算值和文献值相差不大,因此按此方法估算ΔvHb可靠。
根据各组分的ΔvHb,利用Watson公式[3,7]计算丁二酸二甲酯、碳酸乙烯酯、PES和DMC在不同温度(T)下的蒸发焓(ΔvHT)。 Watson 公式见式(4),式中,Tbr为正常沸点的对比温度,Tbr=Tb/Tc;Tr为温度T的对比温度,Tr=T/Tc;n取0.375,计算结果见表1。

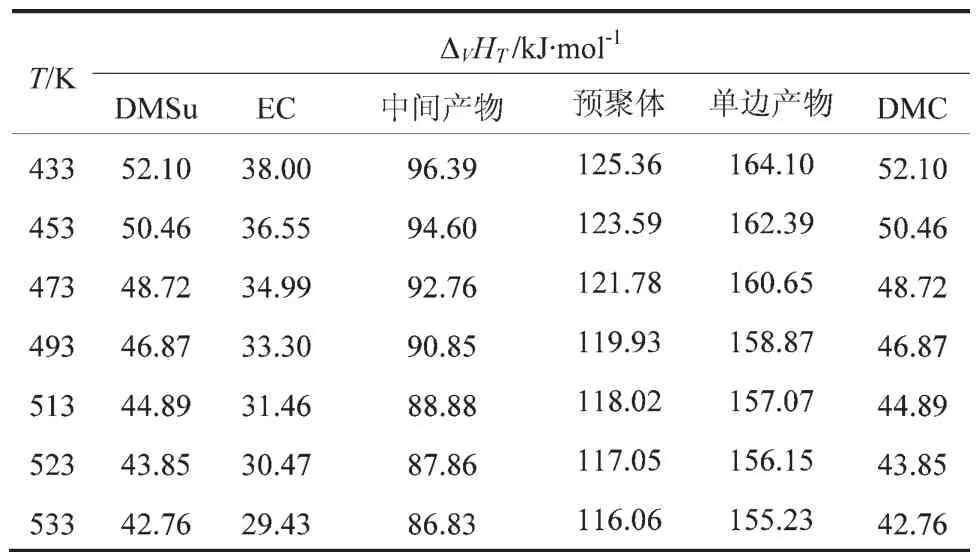
表1 各组分在不同温度下的蒸发焓
1.3 不同温度下液态生产焓的计算
计算各组分的液态生成焓,需要其在不同温度下的气体等压热容(Cp,g)。首先,通过Benson法计算不同温度下的Cp,g,然后,进行多项式回归得到Cp,g随温度变化的函数关系式(见表2),再采用式(5)和式(6)计算各组分在不同温度下的气态和液态生成焓(ΔfHθg,T和 ΔfHθL,T),计算结果见表3。

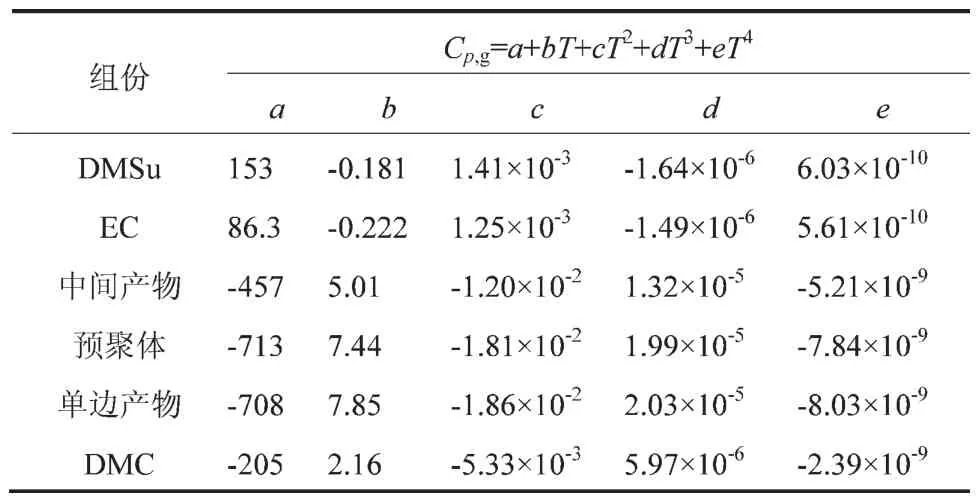
表2 各组分的气体等压热容与温度的关系
1.3 气态标准熵和液态标准熵的计算
各组分的理想气体标准熵(Sθg,298)由 Benson法估算得到,DMSu、EC、中间产物、单体、DMC的Sθg,298分别为445.30J/(mol·K)、190.15J/(mol·K)、635.45J/(mol·K)、870.34 J/(mol·K)、362.73 J/(mol·K),各组分的气态标准熵由理想气体标准熵值结合不同温度下Benson法模拟得到的Cp,g表达式计算,见式(7)。各组分的液态标准熵用式(8)计算得到,计算结果见表4。
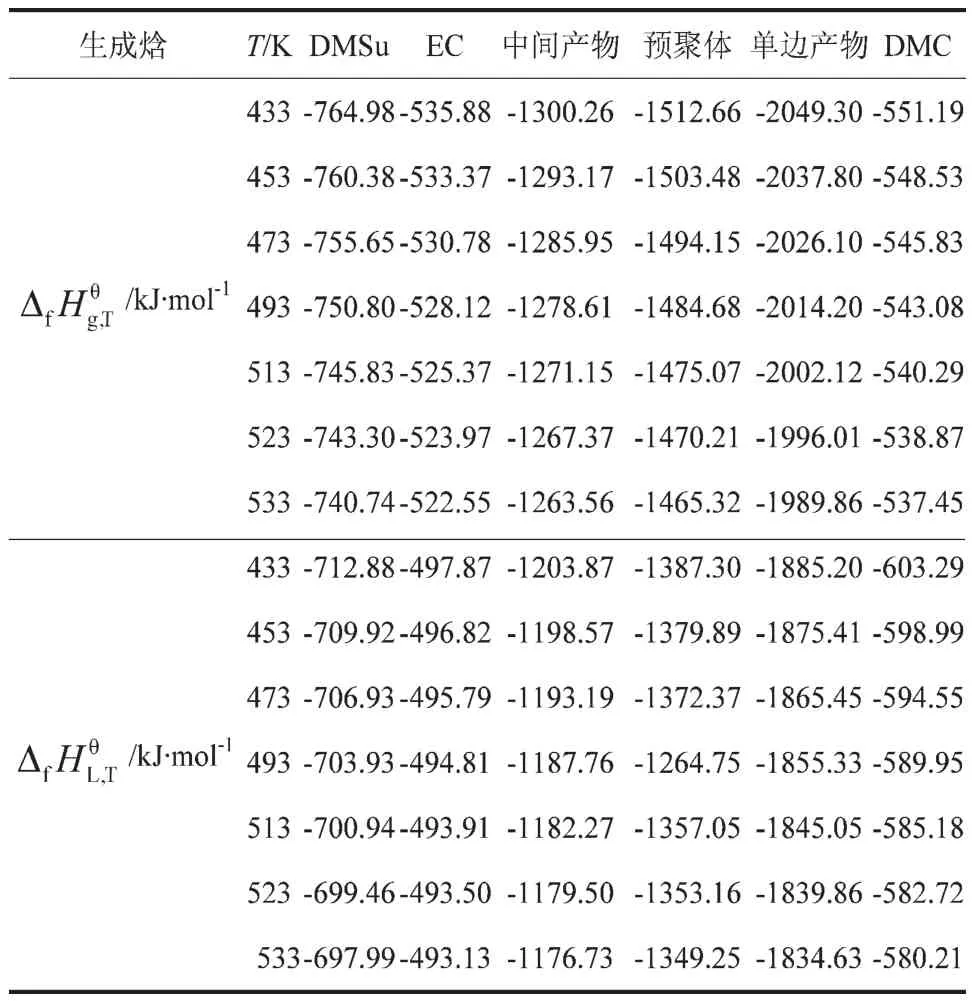
表3 各组分在不同温度下的气态和液态生成焓

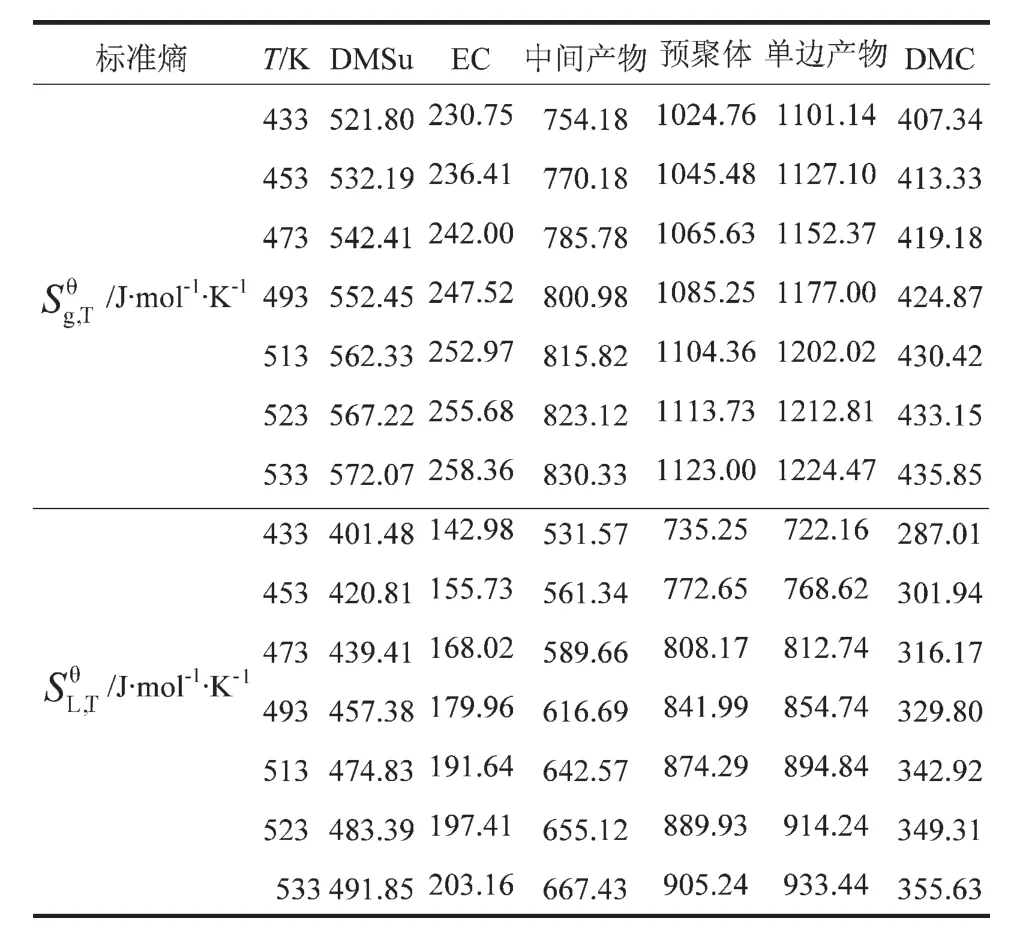
表4 各组分在不同温度下的气态标准熵和液态标准熵
1.4 反应过程热力学参数的计算
DMC、DPC与BD的酯交换反应为液相反应。采用式(9)~(12)计算反应的焓变(ΔrHθ)、熵变(ΔrSθ)、吉布斯自由能变(ΔrGθ)和平衡常数(Kp),计算结果见表5和表6。
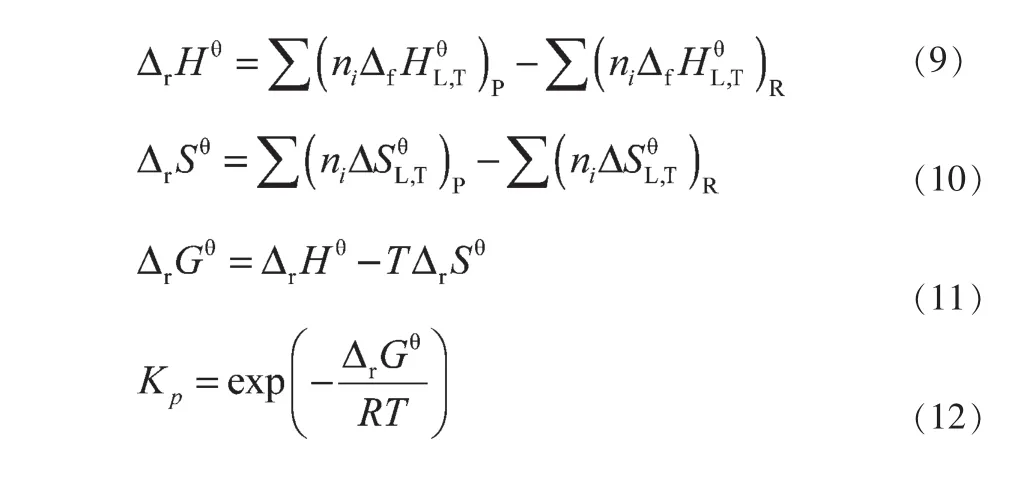
式中,下角标P表示生成物;下角标R表示反应物。
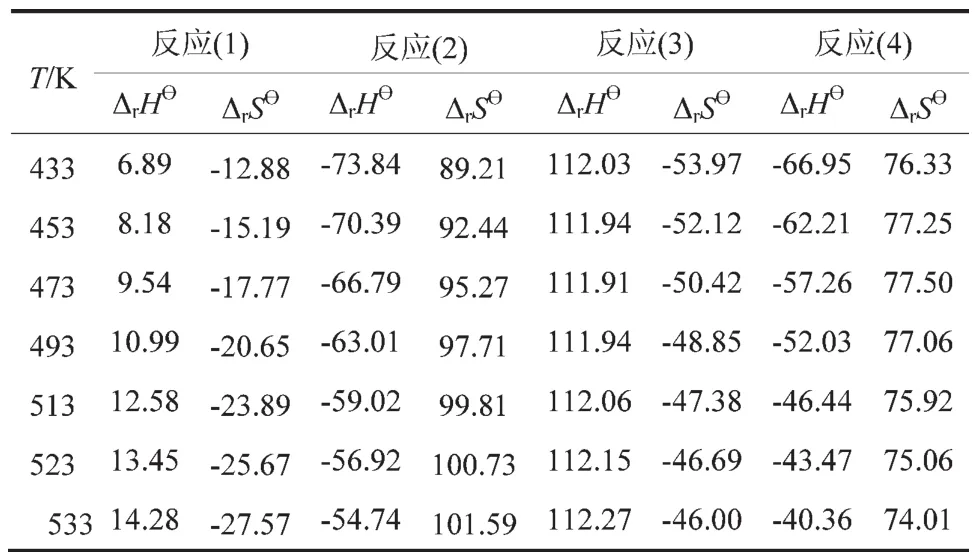
表5 不同温度下反应(1)~(4)的和(J/(mol·K))
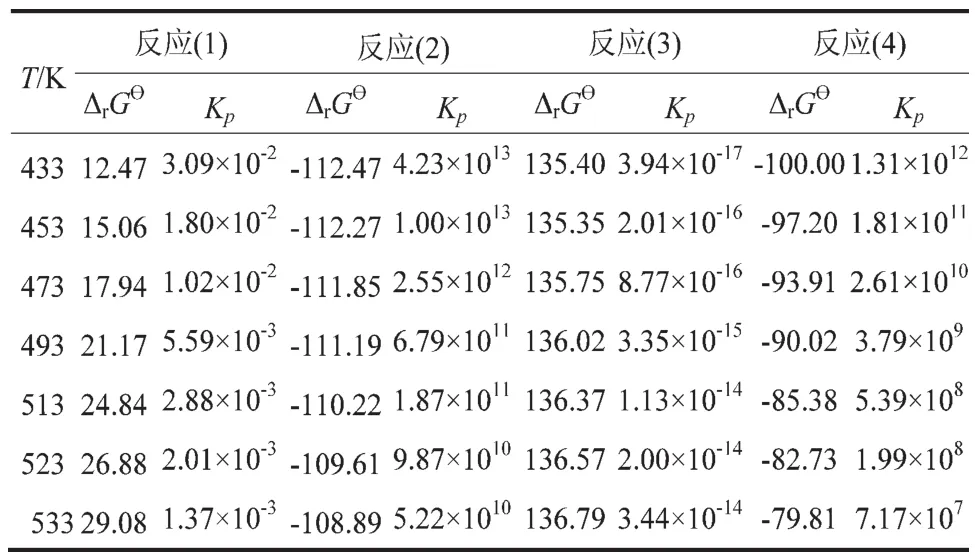
表6 不同温度下反应(1)~(4)的ΔfGθ和Kp
2 结果与讨论
从表5可看出,反应(1)和反应(3)的 ΔrHθ均为正值,说明两个反应均为吸热反应;反应(2)和反应(4)的ΔrHθ均为负值,说明两个反应均为放热反应。因此,从热力学角度分析,升高温度不利于反应式(1)和反应式(3)的进行。
表6的结果表明,反应(1)和反应(3)的ΔrGθ均为正值,说明在433K~533K温度范围内该反应为非自发过程。随温度的升高,ΔrGθ逐渐增加,平衡常数逐渐减少。反应(2)和反应(4)的ΔrGθ均为负值,说明在433K~533K温度范围内该反应为自发过程,随温度的升高,总趋势为ΔrGθ逐渐减少,平衡常数减小。由表6得知,反应(2)的平衡常数较反应反应(3)的大,说明反应(2)较反应(3)易进行。DMSu与EC耦合反应的可能的机理是DMSu分子上的甲氧基进攻EC分子上羰基碳,反应生成中间产物,中间产物再进一步DMSu反应生成预聚体丁二酸乙二醇酯,预聚体缩聚生成PBS。
3 结论
(1)热力学分析表明,反应(1)和反应(3)的 ΔrHθ均为正值,为吸热反应;反应式(2)和反应式(4)的ΔrH?均为负值,为放热反应;
(2)在 433 K~533K 范围内,反应(1)和反应(3)的ΔrGθ均为正值,为非自发过程;反应(2)和反应(4)的的ΔrGθ均为负值,为自发过程。
(3)与反应(3)相比,反应(2)的平衡常数较大。因此,反应(2)进行更易进行。
[1]马楷,刘绍英,李建国,等.氧化锌催化丁二酸二甲酯和碳酸乙烯酯的耦合反应 [J].化工学报,2012,63(11):3525-3530.
[2]马楷,刘绍英,王公应.聚丁二酸乙二醇酯的合成研究进展[J].中国塑料,2012,26(5):1-6.
[3]Ma K,Liu S Y,Wang G Y.Research progress in synthesis of poly(ethylene glycol succinate)[J].China Plastics,2012,26(5):1-6.
[4]董新法,方利国,陈砺.物性估算原理及计算机计算[M].北京:化学工业出版社,2006:152-161,167-168.
[5]梁云霄,乔园园,胡波,等.计算机辅助BENSON基团加和法估算有机分子的热力学数据 [J].计算机与应用化学,1995,12(1):63-66.
[6]曹平,杨先贵,唐聪明,等.碳酸二甲酯和醋酸苯酯合成碳酸二苯酯热力学分析[J].天然气化工,2008,33(2):43-46.
[7]Steele W V,Chirico R D,Knipmeyer S E,et al.Thermodynamic properties and ideal-gas enthalpies of formation for dicyclohexyl sulfide,diethylenetriamine,din-octyl sulfide, dimethyl carbonate, piperazine,hexachloroprop-1-ene,tetrakis(dimethylamino)ethylene,N,N-bis-(2-hydroxyethyl)ethylenediamine,and 1,2,4-triazolo[1,5-a]pyrimidine[J].Chem Eng Data,1997,42(6):1037-1052.
[8]波林 B E,普劳斯尼次 J M,奥康奈尔 J P.气液物性估算手册[M].第5版.赵红玲,王凤坤,陈圣坤,等,译.北京:化学工业出版社,2005:45-182.

