神经节苷脂治疗新生儿缺氧缺血性脑病的疗效及安全性分析
陈兴月
海南省人民医院新生儿科 海口 570311
新生儿缺氧缺血性脑病(hypoxic-ischemic encephalopathy,HIE)为新生儿期常见病、多发病,是指围产期窒息导致的脑缺氧缺血性损害[1]。重度脑病可引起新生儿死亡,存活患儿易遗留永久性神经功能损害[2]。临床研究显示[3],缺氧缺血性脑病新生儿早期给予及时治疗,可迅速减轻脑缺氧缺血性损害,促进脑细胞恢复,提高脑组织对氧的耐受力,挽救濒死的脑细胞。选择2012-10—2014-10我院新生儿科收治的180例缺氧缺血性脑病新生儿为研究对象,观察其临床诊治过程,现报道如下。
1 资料与方法
1.1 一般资料 180例缺氧缺血性脑病新生儿,经头颅CT确诊,均符合中华医学会儿科分会新生儿学组于2005年制订的《新生儿缺氧缺血性脑病诊断标准》的相关诊断标准[6]。随机分为对照组与观察组,对照组90例,男57例,女33例,中度62 例,重度28 例,胎龄(39.4±1.2)周,出生体质量(3.6±0.21)kg,Apgar评分为(3.8±1.3)分;观察组90例,男54例,女36例,中度65例,重度25例,胎龄(39.8±1.6)周,出生体质量(3.5±0.19)kg,Apgar评分为(3.7±1.4)分。2组性别、胎龄、分级、评分等经统计学分析差异无统计学意义(P>0.05),具有可比性。
1.2 治疗方法 2组均给予常规治疗,包括维持通气、换气功能,给予降颅压、控制惊厥、维持血糖正常等治疗。对照组在常规治疗的基础上加用胞二磷胆碱治疗,给予胞二磷胆碱0.125g溶于5%葡萄糖溶液20mL 中静滴,1次/d,连续治疗7d为1疗程。观察组在常规治疗的基础上加用神经节苷脂治疗,给予神经节苷脂20mg,溶于5%葡萄糖溶液20mL中静滴,1次/d,连续治疗7d为1疗程。
1.3 疗效标准 参考的相关标准判定治疗效果[7],即:治疗5d内患儿临床症状大部分/完全消失,意识转清,原始反射恢复正常,四肢肌张力恢复正常为显效;治疗10d内患儿临床症状大部分/完全消失,意识转清,原始反射恢复正常,四肢肌张力恢复正常为有效;治疗10d后,上述症状、体征仍未恢复甚至加重、死亡为无效。总有效率=(显效例数+有效例数)/总例数×100%。采用新生儿神经行为评分[8]评价治疗前、治疗后15d神经功能改善情况,内容包括行为能力6项,被动肌张力4项,主动肌张力4项,原始反射3项,一般状况3项。每项分3个维度,0分,1分,2分,总分为40分。分值越高,神经行为功能恢复越好。
1.4 统计学分析 数据分析采用SPSS 20.0统计学软件进行,计量资料以¯x±s表示,组间比较采用t检验;计数资料以率(%)表示,采用χ2检验;P<0.05为差异有统计学意义。
2 结果
2.1 2 组治疗效果比较 观察组经治疗后总有效率达93.3%,显著高于对照组的73.3%,差异有统计学意义(P<0.05)。见表1。

表1 2组治疗效果比较 [n(%)]
2.2 2组治疗前后神经功能改善情况比较 观察组治疗前NBNA 评分为(24.9±1.8)分,治疗后(36.5±1.4)分;对照组治疗前后分别为(25.2±1.7)分,(34.2±1.5)分。2组治疗前NBNA 评分差异无统计学意义(P>0.05),观察组治疗后NBNA 评分显著高于对照组,差异有统计学意义(P<0.05)。
2.3 2组治疗前后血清TNF-α、IL-6变化比较 2组治疗前血清TNF-α、IL-6水平差异无统计学意义(P>0.05)。观察组治疗后TNF-α、IL-6显著低于对照组,差异有统计学意义(P<0.05)。见表2。
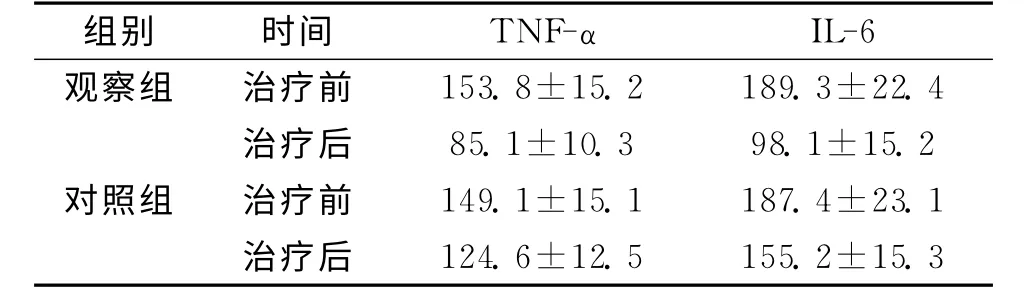
表2 2组治疗前后血清TNF-α、IL-6变化比较 (pg/L)
3 讨论
新生儿缺氧缺血性脑病(HIE)为新生儿窒息后的严重并发症,病情重,病死率高,存活患儿多合并永久性神经功能障碍[9]。患儿主要病理改变为脑细胞水肿,选择性神经元坏死,矢状旁区神经元损伤及基底神经节大理石状损害。近年的研究显示[10],脑细胞的死亡有凋亡参与。神经节苷脂为常用的神经保护剂,在治疗成人神经疾病方面疗效肯定,但在新生儿脑损伤治疗中较少见报道。神经节苷脂分布于所有哺乳动物细胞膜上,在神经系统中含量尤为丰富,可保护细胞膜,促进神经细胞分化、发育,参与神经元的生长、分化、再生,可介导细胞间、细胞与微生物、细胞与基质间相互作用,调控细胞膜中蛋白功能。多种动物试验研究证实[11],缺氧情况下外源性神经节苷脂可通过血脑屏障进入中枢神经系统,嵌入神经细胞膜保护神经细胞膜的完整性,可拮抗兴奋性氨基酸的神经毒性,减少钙离子内流,从而减轻脑水肿。可加速损伤的神经组织再修复,促进神经支配功能恢复,对神经组织有良好的保护作用。
HIE发病机制的分子生物学研究证实,免疫系统功能异常,细胞因子、免疫球蛋白、补体水平异常可能参与了新生儿窒息及HIE 等脑损伤性疾病的发病过程。肿瘤坏死因子(TNF)为可直接杀伤肿瘤细胞的小分子多肽类物质,TNF-α主要来源于神经元、小胶质细胞、星形细胞。IL-6为多功能细胞因子,可由单核细胞、B 细胞、T 细胞等多种细胞产生。IL-6与TNF-α均为关键前炎性神经免疫介质,在新生儿窒息及HIE等脑损伤性疾病中均为上调。本组研究在常规治疗的基础上给予神经节苷脂治疗后,血清TNF-α、IL-6水平均显著下降,分析原因可能为神经节苷脂可通过改善缺氧缺血后再灌注损伤,导致星形胶质细胞反应性增生,使星形胶质细胞增生抑制,从而使TNF-α、IL-6分泌减少。
总之,常规治疗基础上加用神经节苷脂治疗新生儿缺氧缺血性脑病临床效果显著,可有效促进神经功能恢复,安全可靠,值得临床推广应用。
[1] 金汉珍,黄德珉,官希吉.实用新生儿学[M].3版.北京:人民卫生出版社,2003:57-58.
[2] 陆亚东,李勇,周晓玉,等.单唾液酸四己糖神经节苷脂早期治疗中重度缺氧缺血性脑病新生儿的疗效[J].实用儿科临床杂志,2008,23(2):150-151.
[3] Li X,Zhang J,Chai S,et al.Progesterone alleviates hypoxic-ischemic brain injury via the Akt/GSK-3βsignaling pathway[J].Exp Ther Med,2014,8(4):1 241-1 246.
[4] 赵幽燕,平鹦,封云,等.单唾液酸四己糖神经节苷脂治疗新生儿缺氧缺血性脑病临床疗效[J].药学与临床研究,2010,18(1):67-69.
[5] 吕为萍,李建友,王杰.高压氧联合神经节苷脂对新生儿缺氧缺血性脑病的临床疗效观察与分析[J].中华妇幼临床医学杂志,2007,3(1):50.
[6] Wang N,Zhang Y,Guan B.Evaluation of neonatal hypoxic-ischemic encephalopathy by ultrasound measurement of the hemodynamics in the central branches of the middle cerebral artery[J].Nan Fang Yi Ke Da Xue Xue Bao,2014,34(8):1 199-1 202.
[7] 晏长红,江英,刘红霞.神经节苷脂治疗新生儿缺氧缺血性脑病的疗效及其对TNF-α和IL-6的影响[J].广东医学,2010,31(24):3 263-3 265.
[8] Marret S,Jadas V,Kieffer A,et al.Hypoxic-ischemia and encephalopathy in at-term newborn[J].Arch Pediatr,2014,21(9):1 026-1 034.
[9] 赵浦,赵雪妮,梁洁竞,等.神经节苷脂治疗新生儿缺氧缺血性脑病的疗效及随访[J].中华妇幼临床医学杂志,2012,8(5):578-580.
[10] Pei XM,Gao R,Zhang GY,et al.Effects of erythropoietin on serum NSE and S-100Blevels in neonates with hypoxic-ischemic encephalopathy[J].Zhongguo Dang Dai Er Ke Za Zhi,2014,16(7):705-708.
[11] Tang XJ,Xing F.Calcium-permeable AMPA receptors in neonatal hypoxic-ischemic encephalopathy(Review)[J].Biomed Rep,2013,1(6):828-832 .

