响应曲面优化柠檬酸淀粉清料发酵培养基
乔 君,赵祥颖,马钦元,张家祥,韩延雷,刘建军,*(.山东省食品发酵工程重点实验室,山东济南5003;.潍坊英轩实业有限公司,山东潍坊5003)
响应曲面优化柠檬酸淀粉清料发酵培养基
乔君1,赵祥颖1,马钦元2,张家祥1,韩延雷1,刘建军1,*
(1.山东省食品发酵工程重点实验室,山东济南250013;2.潍坊英轩实业有限公司,山东潍坊250013)
运用响应面法对淀粉清料发酵生产柠檬酸的培养基进行了优化。根据单因素实验结果,利用Plackett-Burman设计对相关因素进行评估并筛选出具有显著效应的3个因素:玉米浆、尿素、pH。用最陡爬坡实验逼近以上3个因子的最大响应区域后,采用Box-Behnken设计以及响应面分析法,确定其最佳培养基:玉米浆5.15g/L、尿素1.83g/L、初始pH=4.15、磷酸氢二钾0.4g/L、硫酸镁0.2g/L。在优化培养基条件下,淀粉清料发酵柠檬酸产量为147.52g/L,比优化前提高了约12.19%,与玉米粉带渣发酵相比,柠檬酸平均产量和转化率都提高了约10%,发酵残糖降低了约88%。
柠檬酸,清料发酵,培养基优化,响应曲面
柠檬酸,又名枸橼酸,其具有令人愉悦的酸味,入口爽快,无后酸味,安全无毒,主要作为酸味剂应用于食品、饮料行业且在医药、化工、环保、化妆品、纺织、印染、建筑等领域也有广泛应用[1-2]。
我国自20世纪60年代开始,经过几代人的不懈努力,培育出以薯干粉为原料的黑曲霉生产菌株,与国外酵母菌清料生产柠檬酸相比具有适应性强(能采用山芋干、玉米、木薯、大米等多种淀粉质原料)、遗传性能稳定、产酸高等优点,开创了具有中国特色的柠檬酸带渣发酵工艺[3]。该工艺能很好的配合钙盐法分离技术。但是随着经济发展环保意识的增强,人们意识到钙盐法分离技术操作过程复杂、生产成本高,产生大量废渣、废气和废水,严重污染环境。而采用色谱法提取技术则能基本实现柠檬酸行业零污染[4]。但是,色谱法对料液清洁度要求很高,否则,极易造成色谱柱污染,降低提取效率,增加生产成本。我国柠檬酸生产采用带渣发酵,发酵液成分复杂,不适用于色谱法分离技术。因此,我国亟待研发柠檬酸清料发酵技术,既保留了我国柠檬酸发酵的众多优点,又能实现“零污染”。清料发酵具有培养基成分均一稳定,减少了发酵过程中副产物的产生,减轻了后期提取的负荷,也减少了培养基中不参加代谢杂质的能源消耗[5-7]。
1 材料与方法
1.1材料与仪器
黑曲霉(Aspergillus niger)潍坊英轩实业有限公司;邻苯二甲酸氢钾天津化学试剂有限公司,分析纯;α-高温淀粉酶20000酶活/mL,潍坊英轩生物技术有限公司;碘化钾天津化学试剂有限公司,分析纯;氢氧化钠莱阳化工有限公司,分析纯;碘天津化学试剂有限公司,分析纯;淀粉市售;麸皮市售;玉米浆潍坊英轩生物技术有限公司;琼脂海南省青葛琼脂厂;尿素天津化学试剂有限公司,分析纯;MgSO4·7H2O天津同鑫化工厂,分析纯。
SBA-40C型葡萄糖测定仪山东省科学院生物研究;THZ-C型生化培养箱江苏太仓市实验设备厂;PHS-3C型便携式pH计上海雷磁仪器厂;HYG-A型回转式恒温调湿摇瓶柜上海新星自动化控制设备成套厂;HH-S型恒温水浴锅江苏金坛县国华仪器厂;CJ型超净工作台苏州净化设备厂;YXQSG41280型蒸汽消毒器无锡市第二医疗器械厂;JY2002型电子天平上海仪器仪表有限公司。
1.2培养基
1.2.1察氏培养基NaNO33g/L,KCl 0.5g/L,FeSO40.01g/L,MgSO4·7H2O 0.5g/L,蔗糖30g/L,琼脂20g/L,pH6.7,121℃灭菌15min。
1.2.2麸曲培养基取市售、无霉变麸皮过筛去除细粉(50目筛),称取30g麸皮,按麸皮∶水=1∶1混合均匀,加入500mL三角瓶中,于121℃灭菌30min。
1.2.3发酵培养基
1.2.3.1淀粉液化[8]自来水与淀粉按质量比4∶1的比例混合,95℃保温并不断搅拌,并加入α-高温淀粉酶,恒温20~30min,用碘指示剂检验不变蓝,冷却,回复原来体积,得到淀粉液化液。
1.2.3.2发酵培养基淀粉液化液中分别加入玉米浆5g/L,尿素0.5g/L,硫酸镁0.05g/L,磷酸氢二钾0.02g/L。
1.3培养方法
冰箱保存的斜面菌种转接于察氏培养基上,37℃培养3d长满大量黑色孢子,取一环斜面种子接种于麸曲瓶中,37℃培养约7d。取适量培养好的麸曲接至适量无菌水中,充分混匀,调整孢子浓度为1× 108个/mL,将适量孢子悬液接入装有50mL发酵培养基的500mL摇瓶中,37℃,200r/min振荡培养96h,过滤去菌体,取适当清液测定总酸。
1.4分析方法
1.4.1总酸测定方法[9]用0.1429mol/L的NaOH溶液滴定,所消耗的NaOH毫升数即为发酵液中柠檬酸的含量。
1.4.2总糖测定[10-11]初始总糖:发酵液接种后,经水解,按斐林氏定糖法测定。残糖:发酵结束后,发酵液经水解,按斐林氏定糖法测定。
1.4.3葡萄糖浓度的测定SBA-40D生物传感分析仪测定。
1.5实验设计
1.5.1主要因素筛选本文经前期单因素实验发酵培养基的最佳组分比例为:初糖150g/L、玉米浆6g/L、尿素1g/L、初始pH=3.0、磷酸氢二钾0.4g/L、硫酸镁0.2g/L,柠檬酸产量为128g/L,转化率为85.3%。在此基础上,采用Minitab 15软件,选用N=12的6因素的Plackett-Burman[12]实验设计,考察各因素对柠檬酸产量影响的显著性。
1.5.2最陡爬坡实验最陡爬坡法以实验值变化的梯度方向为爬坡方向,根据各因素效应值的大小确定变化步长,能快速、经济的逼近最佳区域[13]。
1.5.3响应面分析法根据Box-behnken的中心组合实验设计原理,进行3因素3水平的响应面分析实验,使用Minitab 15软件对实验数据进行二次回归拟合。15个实验点可以分为两类:其一是析因点,自变量取值在X1、X2、X3所构成的三维顶点,共有12个析因点;其二是零点,为区域的中心点,零点实验重复3次,用以估计实验误差[13]。
以筛选出的玉米浆、尿素、pH3个主要因素为自变量,以柠檬酸产量为响应值,根据最陡爬坡实验的结果确定实验中心和水平,实验因素与水平的选取见表1。
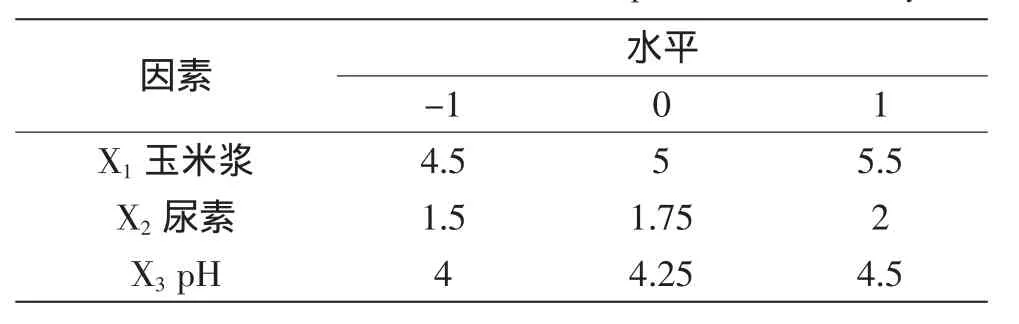
表1 响应面分析实验因素与水平Table 1 Factors and level value of response surface analysis
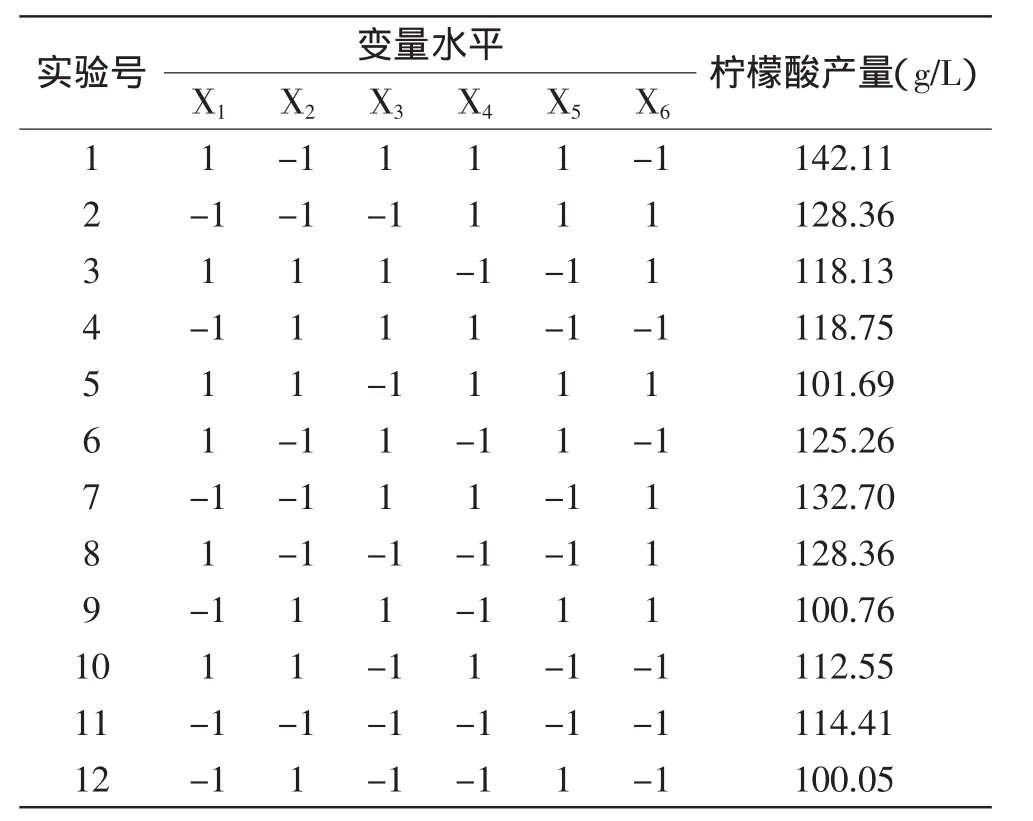
表2 N=12的Placket-Burman实验设计及结果Table 2 Placket-Burman design and responding value of N=12
2 结果与讨论
2.1确定影响柠檬酸产量的主要因素
Plackett-Burman实验设计是一种二水平的多因子设计方法,能用最少实验次数从众多的考察因素中快速有效地筛选出最为重要的几个因素。根据前期对黑曲霉清料生产柠檬酸发酵培养基的初步优化,选用N=12的Plackett-Burman实验设计,对初始总糖(X1)、玉米浆(X2)、尿素(X3)、pH(X4)、磷酸氢二钾(X5)、硫酸镁(X6)6个因素进行考察,每个因素分别取两个水平(-1,+1),响应值为柠檬酸产量,实验设计及柠檬酸产率结果见表2和表3。

表3 各因素效应值及显著性分析Table 3 Effect of different factors
采用Minitab15对实验结果进行分析,各因素效应结果见表3。从表3可以看出,实验选取的6个因素对柠檬酸产率影响的显著性顺序为:玉米浆、尿素、pH、初始总糖、磷酸氢二钾和硫酸镁。其中玉米浆的可信度在95%以上,具有显著性影响(p<0.05),尿素和pH对实验的影响较X1、X5、X6大,所以选取玉米浆、尿素、pH三个因素做爬坡实验。
2.2最陡爬坡实验
由Plackett-Burman实验可知,玉米浆、尿素、pH这3个因素对柠檬酸的产量影响较大,其中尿素和pH为正效应,应增加,玉米浆为负效应,应降低。根据这三个因素效应大小的比例设定它们的变化方向以及步长,实验设计及结果见表4。
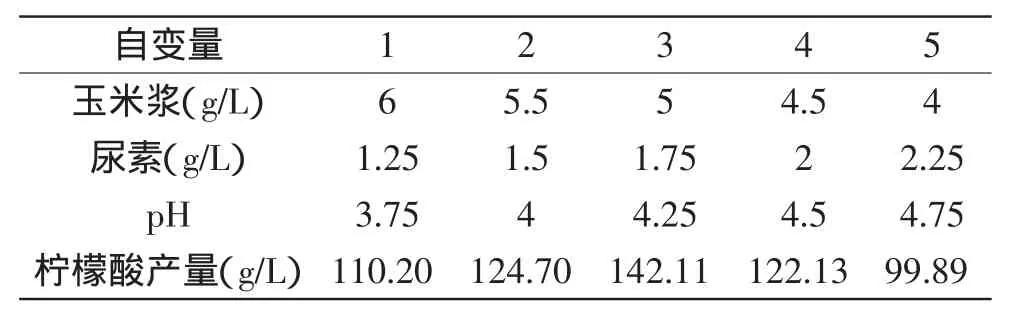
表4 最陡爬坡实验设计及结果Table 4 Experimental design and results of steepest asent
从表4中可以看出,沿着变化方向,柠檬酸的产量呈现先上升后后下降的趋势,第三步时的柠檬酸产量达到最高值(142.11g/L),因此选择该步对应的变量因子作为下一步Box-Behken设计的中心点。
2.3响应面分析设计
2.3.1二次回归模型拟合及方差分析根据Box-Behnken的中心组合设计原理,利用Minitab 15软件设计三因素三水平的响应面实验,以玉米浆、尿素、pH3个因素为自变量,以柠檬酸产量为响应值,中心组合响应面实验设计及结果见表5。
以柠檬酸的产量为响应值,根据表5的实验结果,用Minitab软件进行多元回归分析,根据实验结果,通过Minitab软件获得拟合方程:
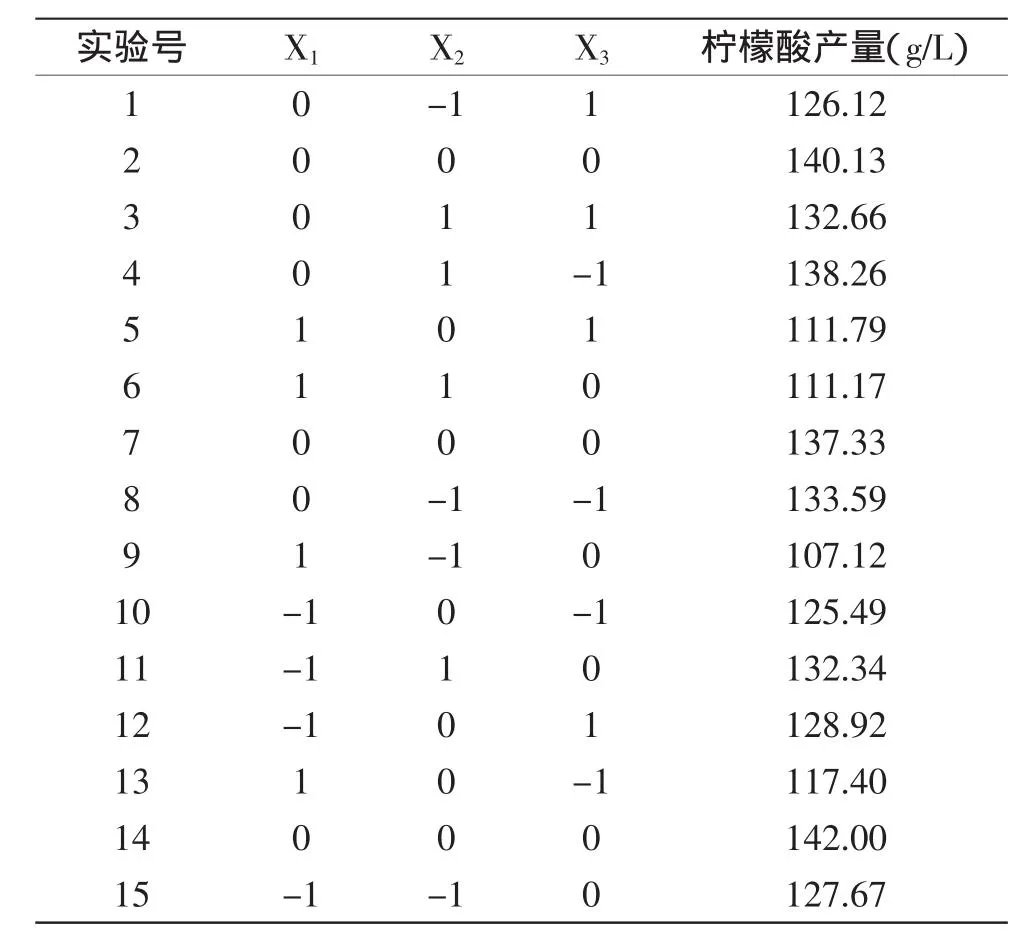
表5 中心组合响应面设计及结果Table 5 Response surface central composite design and corresponding response
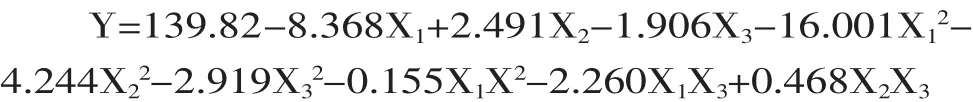
回归方程的方差分析及模型显著性分析结果见表6、表7。
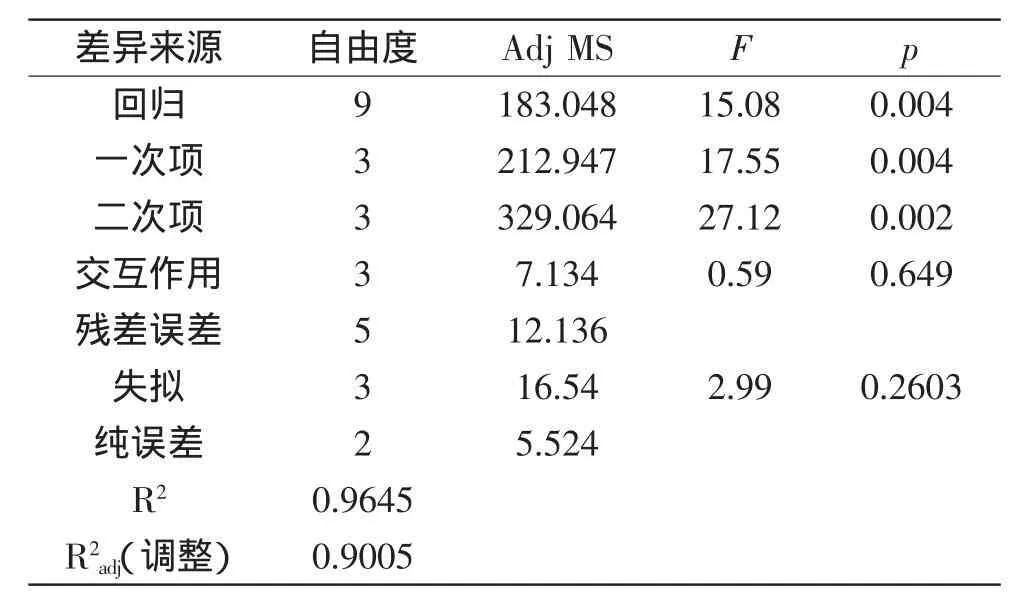
表6 回归方程的方差分析Table 6 Analysis of variance for the regression equation
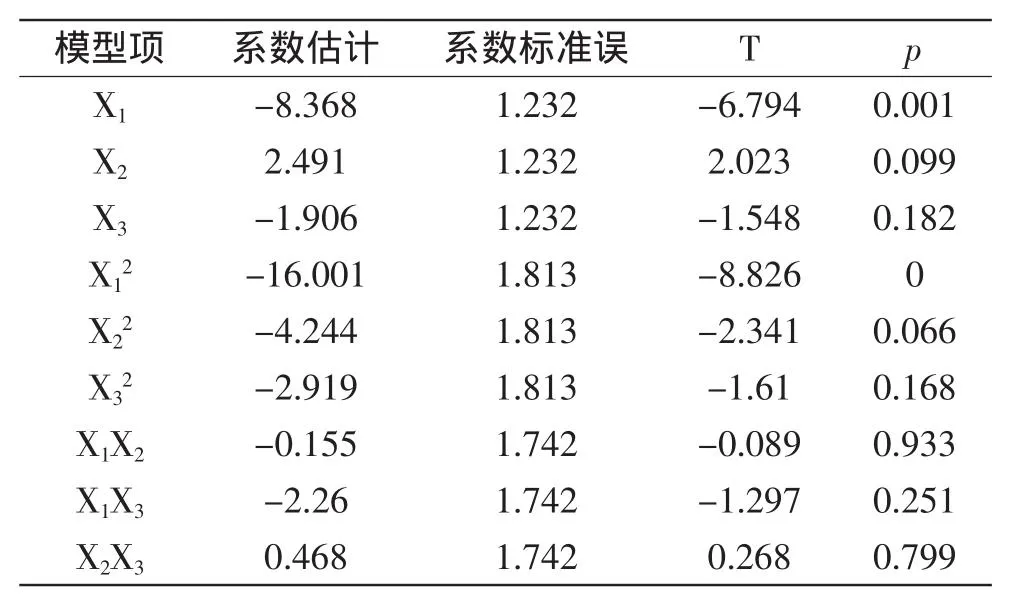
表7 回归方程系数显著性检验表Table 7 The significance test for the regression equation
从表6中可以看出,模型回归高度显著(p<0.01),R2=0.9645,失拟项不显著(p=0.2603),说明该模型与实际实验拟合很好,调整后的R2为0.9005,即表明模型可以解释90.05%的发酵产柠檬酸水平的变化,进一步说明了回归方程的拟合程度较好。方程一次项、二次项的影响极显著(p<0.01),整体交互作用不显著(p=0.649)。表7中p值表明,此处X1X3(p=0.251)、X2X3(p=0.799)不显著,且X1X2(p=0.933)也是不显著的,此数据进一步验证表6中“交互作用”项不显著的结果。
由响应面回归分析和回归方程拟合可以绘出响应面图形,见图1~图3。
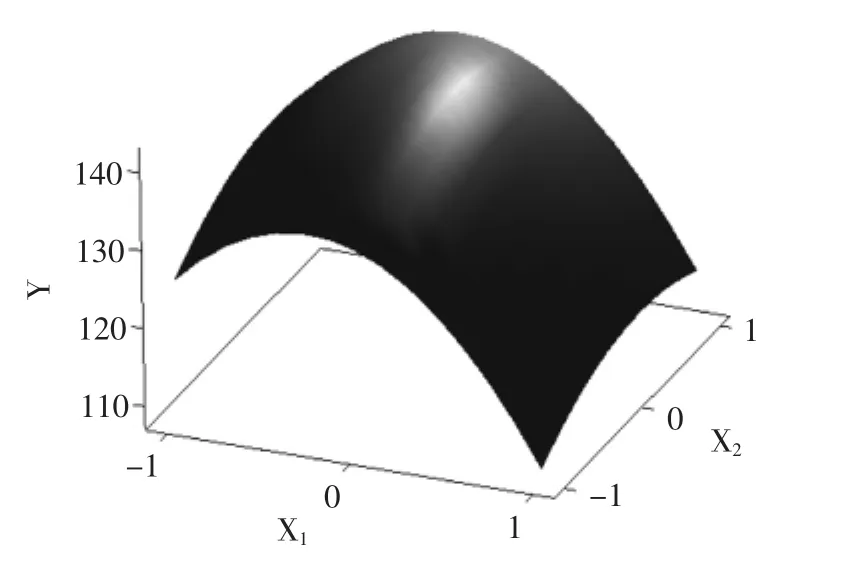
图1 Y=f(X1,X2)的响应面立体分析Fig.1 Surface layer Analysis of X1and X2
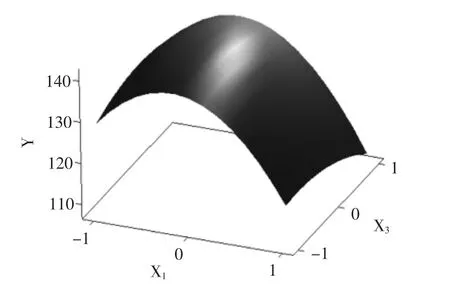
图2 Y=f(X1,X3)的响应面立体分析Fig.2 Surface layer Analysis of X1and X3

图3 Y=f(X2,X3)的响应面立体分析Fig.3 Surface layer Analysis of X2and X3
2.3.2最佳培养基成分的确定为了求得培养基最佳的浓度,对所得的回归拟合方程分别对各自的变量求一阶偏导数,并令其为0可得到曲面的稳定点,即最大点:
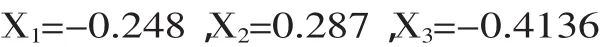
以上代码值换算可得:X1=5.15g/L,X2=1.83g/L,X3=4.15,在此条件下理论预测柠檬酸产量可达148.3g/L。2.3.3最佳发酵培养基的验证为了确定建立的模型与实验结果是否相符,根据以上实验结果确定的主要影响因素浓度来配制发酵培养基,进行3组平行实验,并于玉米粉带渣发酵实验结果进行对比,实验结果见表8。
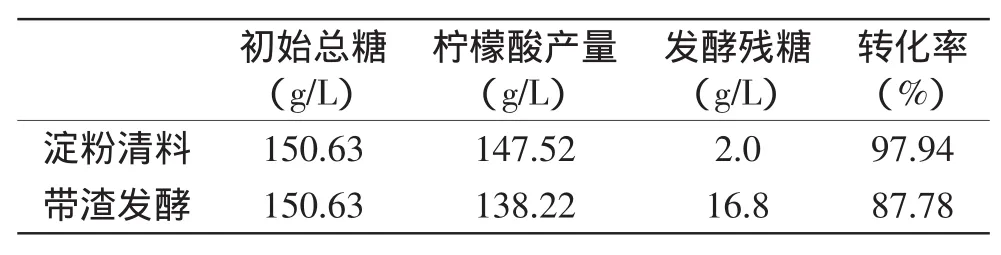
表8 柠檬酸淀粉清料发酵与带渣发酵对照Table 8 The contrast between Clarifying and unrefined starch fermentation
黑曲霉产柠檬酸的平均产量为147.52g/L,与预测值接近,同优化前产量128g/L相比,提高了约12.19%。表明所得的模型有一定的实践指导意义。与带渣发酵实验结果相比,柠檬酸产量和转化率都提高了约10%,发酵残糖降低了约88%。这可能是由于玉米渣中含有部分不能被黑曲霉利用的多糖所致。另一方面,清料发酵的溶氧效果增强等原因造成的。
3 结论与讨论
通过单因素实验和响应面实验分析对淀粉液化清液的发酵培养基组成和培养条件进行了研究,确定了最佳发酵培养基和较优培养条件:最佳培养基组成为:玉米浆5.15g/L、尿素1.83g/L、初始pH=4.15、磷酸氢二钾0.4g/L、硫酸镁0.2g/L。在最优培养基条件下,黑曲霉产柠檬酸的平均产量为147.52g/L,同优化前产率128g/L相比,提高了约12.19%。说明了响应面实验的有效性。与玉米粉带渣发酵相比,柠檬酸产量和转化率都提高了约10%,发酵残糖降低了约88%。
淀粉清料发酵生产柠檬酸技术,使柠檬酸提取工序的色谱分离技术的广泛使用成为可能,从而实现柠檬酸行业的零污染[3]。此外,清料发酵还可以提高玉米和菌丝体附加值,优化发酵工艺控制等,从而实现清洁高效生产。本研究主要采用摇瓶发酵的方法,很多因素(如溶氧、转速等)难以有效控制,不能充分发掘淀粉清料发酵的潜力,对于清料发酵的放大以及相关酶学性质,有待于进一步的研究,最终能够工业化生产奠定基础。
[1]Gurpreet Singh Dhillon,Satinder Kaur Brar,Mausam Verma,et al.Recent Advances in Citric Acid Bio-production and Recovery[J].FoodandBioprocessTechnology,2011,4(4):505-529.
[2]Ambati P,Ayyanna C.Optimizing medium constituents and fermentation conditions for citric acid production from palmyra jaggery using response surface method[J].World Journal of Microbiology&Biotechnology,2001,17:331-335.
[3]周永生,满云.我国柠檬酸行业的产业化现状及可持续发展[J].生物加工过程,2010,8(6):73-76.
[4]韩德新,高年发.减少CO2排放的柠檬酸生产新工艺[J].发酵科技通讯,2009,38(3):1-4.
[5]张博雅,王云峰.中国玉米深加工生产发展现状[J].河北北方学院学报:自然科学版,2008,24(4):28-31.
[6]曹健,殷蔚申.黑曲霉几丁质和壳聚糖的研究[J].微生物学报,1995,22(4):200-203.
[7]娄永江.从柠檬酸厂废菌丝体中提取壳聚糖的研究[J].浙江海洋学院学报:自然科学版,1999,18(2):129-132.
[8]S Anwar,S Ali,A A Sardar.Citric acid fermentation of hydrolysed raw starch by Aspergillus niger IIB-A6 in stationary culture[J].Sindh Univ Res Jour(Sci Ser),2009,41(1):1-8.
[9]Xiao-Yan Liu,Zhe Chi,Guang-Lei Liu,et al.Both Decrease in ACL1 Gene Expression and Increase inICL1Gene Expression in Marine-Derived YeastYarrowia lipolytica Expressing INU1
Gene Enhance Citric Acid Production from Inulin[J].Mar Biotechnol,2013,15:26-36.
[10]Ana María Torrado,Sandra Cortés,José Manuel Salgado,et al.Citric acid production from orange peel wastes by solid-state fermentation[J].Brazilian Journal of Microbiology,2011,42:394-409.
[11]GS Dhillon,SK Brar,M Verma,et al.Enhanced solid-state citricacidbio-productionusingapplepomacewaste through surface response methodology[J].Journal of Applied Microbiology,2011,110:1045-1055.
[12]Suzelle B,Jin W.Response surface optimization of medium components for citric acid production by Aspergillus niger NRRL 567 grown in peat moss[J].Bioresource Technology,2008,99:368-377.
[13]郝学财,余晓赋,刘志钰,等.响应面方法在优化微生物培养基中的应用[J].食品研究与开发,2006(27):38-41.
[2]Mohamed Elleuch,DorotheaBedigian,OlivierRoiseux,et al. Dietary fibre and fibre-rich by-products of food processing:characterization,technologicalfunctionalityand commercialapplications:a review[J].Food Chemistry,2010(6):2-8.
[3]魏炜,李杰,王华.汁用甜橙果肉膳食纤维研究进展[J].食品工业科技,2013,34(10):281-385.
[4]吴笑臣,王科军.钟金莲,等.响应面法优化脐橙渣中水溶性膳食纤维提取工艺[J].食品科学,2012,33(4):109-114.
[5]毛慧君,文良娟,李英,等.发酵法从西番莲果渣中制备膳食纤维的研究[J].食品科学,2010,31(3):193-197.
[6]曾祥燕,赵良忠.桔子皮渣水溶性膳食纤维提取工艺的优化[J].食品与械,2012,28(1):193-196.
[7]Fouad Abdulrahman Hassan,Amin Ismail,Azizah Abdul Hamid,et al.Characterization of fiber-rich powder and antioxidant capacity of Mangifera pajang Kort fruit peels[J].Food Chemistry,2011,126(1):283-288.
[8]李凤英,刘素稳,赵希艳.葡萄皮可溶性膳食纤维饮料的研制[J].食品研究与开发,2013,34(8):56-59.
[9]于丽娜,杨庆利,毕洁,等.花生壳水溶性膳食纤维提取工艺的研究[J].现代化工,2008,28(2):324-327.
[10]黄群,杨万根,余佶,等.超声波辅助碱法提取杜仲籽粕可溶性膳食纤维的工艺优化[J].食品科学,2013,34(22):70-74.
[11]杜彬,李凤英,范长军,等.响应面法优化葡萄皮渣中可溶性膳食纤维的酸法提取工艺[J].食品科学,2011,32(22):128-134.
[12]罗章,孙术国,方军,等.杨梅渣膳食纤维提取工艺[J].食品与发酵工业,2011,37(3):215-219.
[13]李昊虬,王国泽,孙晓宇.响应面法优化河套蜜瓜水溶性膳食纤维提取工艺的研究[J].食品工业科技,2012,7:254-259.
[14]花旭斌,杨丽琼.响应面法优化酸法提取蕨菜中水溶性膳食纤维的工艺研究[J].安徽农业科学,2011,39(35):21775-21777.
Response surface optimization of medium components for citric acid production using clarifying solution of starch
QIAO Jun1,ZHAO Xiang-ying1,MA Qin-yuan2,ZHANG Jia-xiang1,HAN Yan-lei1,LIU Jian-jun1,*
(1.Food&Fermentation Engineering Key Lab of Shandong Province,Ji’nan 250013,China;2.Weifang Ensign Industry Co.Ltd.,Weifang 250013,China)
Response surface methodology(RSM)had been employed to optimize the clarifying starch medium for citric acid production by Aspergillus niger.Firstly,according to the results of amono-factor experiment,a Plackett-Burman design was used to investigate the effects of different factors in the ferment medium,with the three statistically significant factors being identified as:corn steep liquor,urea and pH.Secondly,the steepest ascent procedure wasemployed to define the optimal response region for these three factors.Finally,the Box-Behnken method was employed to design the reaction system.The results of the experiments were analyzed by RSM with Minitab15.0 software.The optimal fermentation medium for production of citric acid consisted of the following(g/L):corn steep liquor 5.15g/L,urea 1.83g/L,pH4.15,MgSO40.2g/L,K2HPO40.4g/L.The average yield and conversion rate of citric acid,compared with unrefined starch culture,improved about 10%,meanwhile,the total residual sugar reduced about 88%.
citric acid;clarifying fermentation;media optimization;response surface methodology
TS201.3
A
1002-0306(2015)02-0231-05
10.13386/j.issn1002-0306.2015.02.041
2014-05-26
乔君(1985-),男,硕士研究生,助理工程师,研究方向:生物发酵。
刘建军(1962-),男,博士研究生,研究员,研究方向:生物发酵。
山东省自主创新专项(2012CX20505)。

