燕麦浊汁酶解工艺及其水溶性β-葡聚糖含量变化研究
朱 转,杨金芹,沈 群,陈燕卉,*(.中国农业大学食品科学与营养工程学院,北京00083;.山烟台工贸技师学院,山东烟台64003)
燕麦浊汁酶解工艺及其水溶性β-葡聚糖含量变化研究
朱转1,杨金芹2,沈群1,陈燕卉1,*
(1.中国农业大学食品科学与营养工程学院,北京100083;2.山烟台工贸技师学院,山东烟台264003)
以稳定性为评价指标研究了α-淀粉酶生产燕麦浊汁的酶解工艺,并用刚果红法探究了水溶性β-葡聚糖含量在饮料加工过程中的变化。结果表明,酶解的最佳工艺条件为:10%的燕麦溶液,温度55℃、pH6.4、酶用量为91.7U/100g溶液、时间180min,燕麦浊汁稳定性值为93.3%;燕麦原料中的水溶性β-葡聚糖含量为12.8mg/g,浸泡过程中会造成水溶性β-葡聚糖的流失,蒸煮、打浆能提高水溶性β-葡聚糖的含量,酶解、灭菌对水溶性β-葡聚糖含量没有明显影响。
燕麦浊汁,α-淀粉酶,稳定性,水溶性β-葡聚糖
燕麦是禾谷类作物中营养价值最高的作物之一,在世界谷物生产中位于小麦、玉米、稻米、大麦及高粱之后居于第六位[1]。我国燕麦加工企业总加工能力约为50万吨/年,总产值为60亿元,但燕麦粉及面制品等初加工产品占总量的70%[2],新型燕麦食品及深加工产品只占到燕麦加工总量的5%[3-4]。我国近年来开始重视对燕麦的深加工利用,其中以燕麦为原料的谷物饮料是研究热点之一[5-8]。燕麦中富含淀粉,其糊化后形成的凝胶状结构以及老化,是影响饮料稳定性的关键因素之一。徐康[7]、张明等[8]在研究燕麦饮料的工艺时,通过添加淀粉酶等,提高饮料的稳定性。
燕麦中的可溶性膳食纤维是其具有降低血清胆固醇、改善肠道等保健作用的主要原因[9-12],而β-葡聚糖是燕麦可溶性膳食纤维的主要成分。燕麦的β-葡聚糖主要存在于麸皮中,含量在3.20%~6.80%之间,其中35%~50%为可溶性β-葡聚糖[13]。β-葡聚糖分子量的不同会导致其溶液流变学行为的不同[14],而其生理功能与溶液流变性能有密切关系。燕麦加工中常用的工艺均有可能对β-葡聚糖分子产生影响。刘文胜等[15]探究了不同灭酶方式对燕麦β-葡聚糖含量的影响,发现蒸制灭酶(100℃下20min)组含量比空白组(未经处理的燕麦)高0.64%,而炒制灭酶组(2.5kg燕麦在炭火炒锅中炒制30min)比空白组高0.88%。Altan等[16]的研究认为挤压过程中的高温和剪切力能够降低β-葡聚糖分子量。Moura等[17]用H2O2溶液对燕麦麸进行氧化处理,发现β-葡聚糖发生降解,且分子中羧基和羰基增加。Kivela等[18]研究发现β-葡聚糖溶液均质后,粘度明显降低,β-葡聚糖的构象更接近于球形,同时溶解性提高。
燕麦饮料加工中的浸泡、蒸煮、打浆、杀菌等工艺可能对β-葡聚糖分子造成不同程度的影响;此外,燕麦麸皮由于难易达到理想的粒度,由于在饮料成品中影响感官品质,通常在过滤等操作中被除去,也会影响饮料中β-葡聚糖的含量。本文所研究的燕麦浊汁饮料通过添加α-淀粉酶水解淀粉,提高饮料的稳定性,并探究了加工过程对饮料中水溶性β-葡聚糖含量的影响。
1 材料与方法
1.1材料与仪器
燕麦坝莜3号;α-淀粉酶丹尼斯克公司;β-葡聚糖标品Sigma公司;刚果红Fluka公司;麦芽糖、磷酸氢二钠、磷酸二氢钠等均为分析纯。
DK-S24型电热恒温水浴锅上海精宏实验设备有限公司;VORTEX QL-902型涡旋混合器海门市其林贝尔仪器制造有限公司;WFZ UV-2102C型紫外可见分光光度计尤尼柯(上海)仪器有限公司;HITACHI CF16RXⅡ型离心机立工机有限公司;SHA-BA型水浴恒温振荡器金坛市荣华仪器制造有限公司;FD115型热鼓风循环干燥箱德国Binder公司;AR5120型电子精密天平奥豪斯国际贸易(上海)有限公司;ALC-110.4型电子天平德国赛多利斯集团;打浆机九阳公司;LS-B35L型立式自动电热压力蒸汽灭菌器北京美科美生物技术开发有限公司。
1.2α-淀粉酶活力测定
酶活力定义为单位时间内(1min)每毫升酶催化反应所得1mg麦芽糖为一个活力单位(U)。采用3,5-二硝基水杨酸法(DNS)测定酶活力,DNS试剂的配制参照马晶晶等的方法[19],具体操作参照邢楠楠等的方法[20]。
1.3燕麦浊汁工艺及具体操作
具体工艺:原料→清洗→浸泡→蒸煮→打浆→酶解→灭酶→过滤→调配→灌装→杀菌。
浸泡:按照每克燕麦加1.25mL水的比例,将清洗后的燕麦于40℃下浸泡1h。
蒸煮:燕麦和浸泡液再加入适量水,于常压沸水浴中蒸煮1h,使燕麦充分糊化。
打浆:蒸煮后的燕麦迅速冷却后,加入水使得燕麦-水为1∶9,在打浆机中先低速打浆2次,再高速打浆2次,得到10%的燕麦浓浆。
酶解条件:探究温度、pH、加酶量、酶解时间对燕麦浊汁稳定性的影响。温度单因素时,固定pH6.4、酶用量65.5U/100g溶液、时间60min,探究温度40、45、50、55、60、65℃对稳定性的影响。pH单因素时,固定温度55℃、酶用量65.5U/100g溶液、时间60min,探究pH5.6、6.0、6.4、6.8、7.2、7.6对稳定性的影响。酶用量单因素时,固定温度55℃、pH6.4、时间60min,探究加酶量26.2、39.3、52.4、65.5、78.6、91.7U/100g溶液对稳定性的影响。时间单因素时,固定温度55℃、pH6.4、加酶量78.6U/100g溶液,探究30、60、90、120、150、180min对稳定性的影响。单因素实验结束后,采用适宜水平进行四因素三水平的正交实验。正交实验因素水平表见表1。
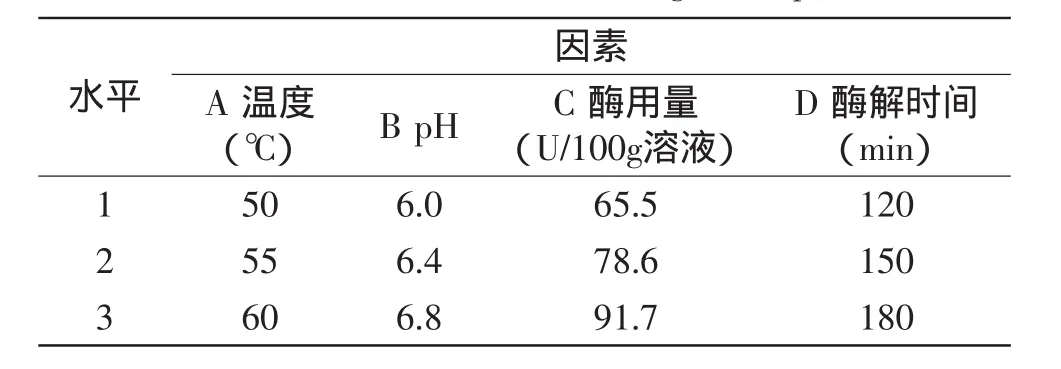
表1 正交实验因素水平表Table 1 Factors and levels of orthogonal experiment
灭酶、过滤:酶解后的燕麦浊汁立即放入沸水浴中加热10min灭酶,再用200目筛网过滤大颗粒物质。
杀菌:采用高温杀菌,将调配好的燕麦浊汁加入预先灭菌的玻璃瓶中,用立式电热杀菌器在121℃条件下杀菌20min。
1.4稳定性的测定
参考杨海红等的方法[21]。酶解后的燕麦浊汁转入50mL离心管中,5000r/min下离心20min,倒出上清液后,将装有沉淀的离心管倒置0.5h,测定离心沉淀率SR(Centrifugal Sedimentation Rate)。SR值越大表示稳定性越差。
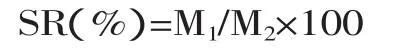
式中:M1—燕麦浊汁离心、倒置后沉淀物的重量(g);M2—燕麦浊汁离心前的重量(g)。
1.5燕麦中β-葡聚糖的提取
燕麦磨粉后过50目筛,按照1∶9的比例加入75%的酒精在80℃下回流2~4h,混合物冷却至30℃后倒出上清液,加入无水乙醇浸泡15min后过滤,在35℃下干燥脱除溶剂。称取500mg干燥粉末,加入20mL水溶液,用20%Na2CO3溶液调节pH10,在40℃下浸提4h后,冷却,于4000r/min下离心10min,收集上清液,将沉淀再次加入10mL水后,用20%Na2CO3溶液调节至pH10,于室温下放置10h,离心后合并上清液。上清液经过淀粉酶除淀粉、等电点法除蛋白(用20%的HCl溶液调pH为4.5),于4000r/min下离心10min得上清液,定容后测定β-葡聚糖含量。燕麦浊汁经除去淀粉、蛋白质后进行测定[13,22]。
1.6刚果红法测β-葡聚糖
1.6.1β-葡聚糖标准溶液准确称取0.0500g β-葡聚糖标品,加入少量去离子水于70℃下水浴溶解,冷却后定容至50mL,配成1mg/mL β-葡聚糖标准母液,使用前稀释10倍。
1.6.2刚果红溶液准确称取0.1000g刚果红溶于0.2mol/L pH8.0的磷酸缓冲溶液中,用pH8.0的磷酸缓冲溶液定容至1000mL。
1.6.3检测波长的确定用2mL蒸馏水+4mL刚果红溶液(空白组)、1mL蒸馏水+1mLβ-葡聚糖溶液+4mL刚果红溶液(实验组)在25℃下反应20min后,用酶标仪扫描两者的最大吸收光谱和差谱,测得空白组的最大吸收光谱在489nm处,反应液的最大吸收光谱在500nm处,在544nm处有最大差谱,故选择544nm为测定波长。
1.6.4具体测定方法分别吸取0.1mg/mL的β-葡聚糖标准溶液0、0.2、0.4、0.6、0.8、1.0mL于试管中,补充蒸馏水至2mL,加入4mL刚果红溶液,在25℃下显色20min后,在544nm处测定吸光值。每组3个平行,根据标准曲线算出β-葡聚糖含量[13,23]。
2 结果与讨论
2.1α-淀粉酶活力
根据吸光值结果,绘制麦芽糖标准曲线,得到计算公式为y=0.5451x-0.0416(R2=0.9982),其中,x为麦芽糖含量(mg),y为吸光值。
准确吸取0.05mL酶溶液于100mL容量瓶中加蒸馏水定容后,吸取0.02mL酶溶液稀释液于25mL具塞刻度管中,加入0.8mL pH6.0的磷酸盐缓冲溶液(0.2mol/L),于60℃下保温10min后,加入1mL的1%可溶性淀粉,保温5min,加入2mL DNS,在沸水浴中加热5min,迅速冷却,加蒸馏水定容至20mL,于540nm处测定吸光值。空白组的设置,以第一次保温前加入DNS试剂作为对照平行3次。根据公式计算,得到酶活力为1048U/mL。
2.2燕麦浊汁酶解工艺条件
2.2.1酶解工艺单因素实验
2.2.1.1温度单因素温度影响结果见图1,随着温度的升高,饮料稳定性先增加后减小,55℃时稳定性最大,原因是该淀粉酶在55℃时活性最大,对淀粉的水解效率最高,离心过程中沉淀下来的大分子淀粉最少。由此可知,55℃为最佳温度。
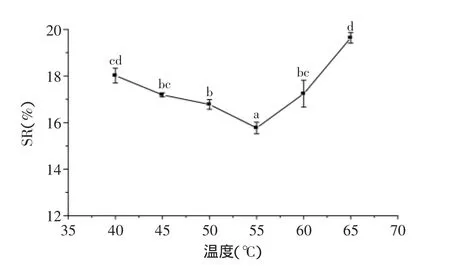
图1 酶解温度对燕麦浊汁稳定性的影响Fig.1 Effect of temperature on stability of turbid oats beverage
2.2.1.2pH单因素pH影响结果见图2,pH为6.4时,SR值最小,饮料稳定性最佳,原因是α-淀粉酶在pH6.4时活性最高,对淀粉的水解效率最高。选取pH6.4为后续单因素实验的pH。
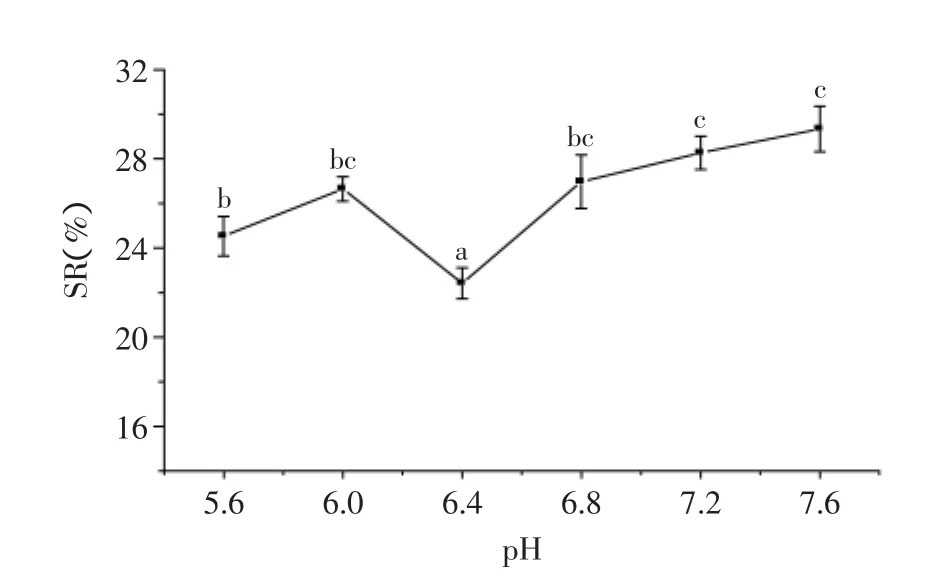
图2 酶解pH对燕麦浊汁稳定性的影响Fig.2 Effect of pH on stability of turbid oats beverage
2.2.1.3酶用量单因素加酶量影响结果见图3,随着酶用量的增加,饮料稳定性增加,当酶用量超过78.6U/100g燕麦溶液时,稳定性变化趋势平缓。选择加酶量78.6U/100g燕麦溶液,既能使饮料达到较好的稳定性,同时又节约生产成本、防止酶本身不良气味给饮料风味带来破坏作用。
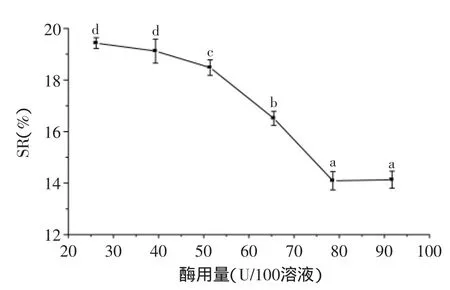
图3 加酶量对燕麦浊汁稳定性的影响Fig.3 Effect of enzyme dosage on stability of turbid oats beverage
2.2.1.4时间单因素时间影响结果见图4。随着时间的延长,饮料稳定性增加,原因是淀粉分子不断被水解,当时间为150min时,溶液中淀粉的浓度很小,与酶接触的几率大大减少,从而稳定性不再发生明显变化。酶解时间过长,不但对饮料稳定性没有贡献,反而会影响生产效率,故选择酶解时间150min。
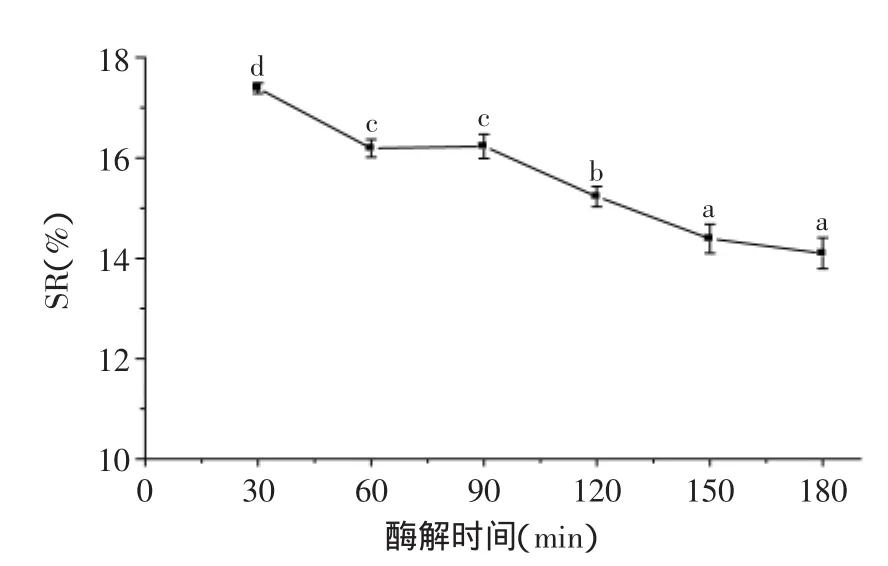
图4 酶解时间对燕麦浊汁稳定性的影响Fig.4 Effect of hydrolyzing time on stability of turbid oats beverage
2.2.2最佳酶解条件的确定单因素实验表明,当酶解温度为55℃、pH6.4、酶用量78.6U/100g燕麦溶液或者酶解时间150min时燕麦浊汁可获得最佳稳定性。但酶解的最佳条件并非各个单因素实验的最佳结果的简单叠加,需正交实验考察多因素的叠加效果。正交实验设计及结果见表2。
从表2可以看出:影响因素为温度(A)>酶用量(C)>酶解时间(D)>pH(B),燕麦浊汁的最佳悬浮稳定下的酶解工艺为A2B2C3D3,即温度55℃,pH6.4,酶用量为91.7U/100g燕麦溶液,时间180min。验证实验中,在最佳悬浮稳定酶解工艺条件下,燕麦溶液经过酶解后,过40目网筛,所得燕麦浊汁离心沉淀率为6.7%,即悬浮稳定性值为93.3%;结果优于表2中其他组合。
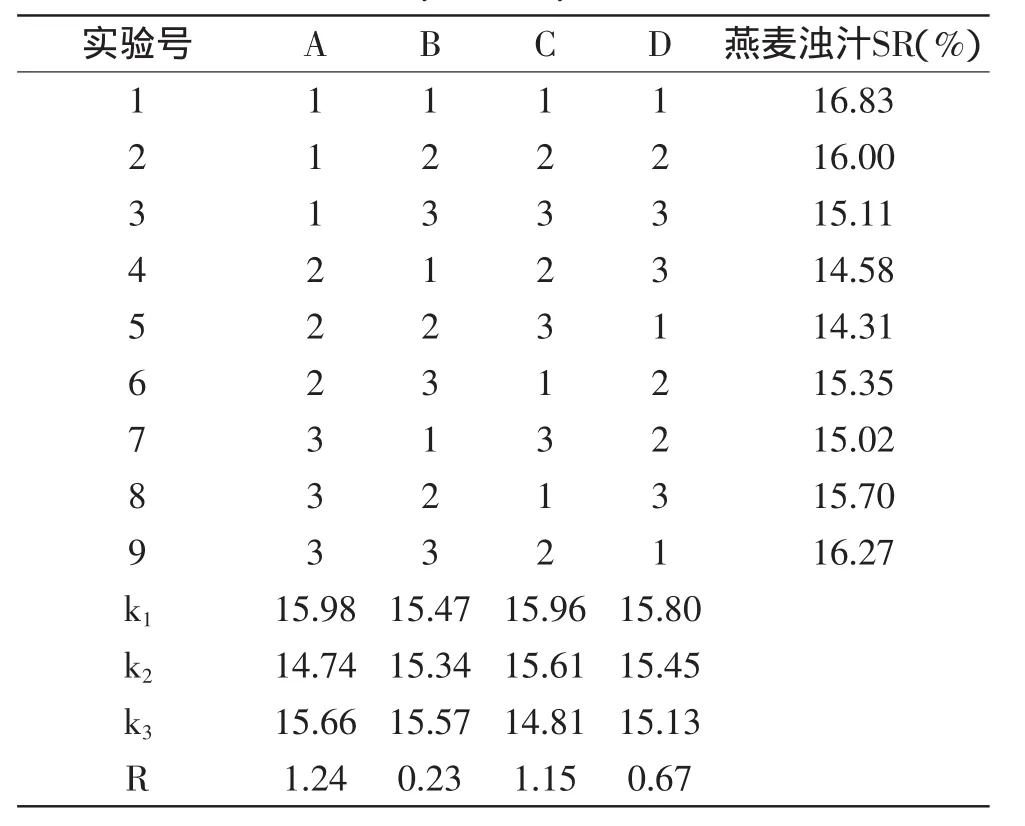
表2 α-淀粉酶解L9(34)正交实验结果Table 2 The results of L9(34)orthogonal experiment for α-amylase enzymation
2.3刚果红法测水溶性β-葡聚糖含量
2.3.1β-葡聚糖标准曲线根据β-葡聚糖含量(mg)与对应吸光值,绘制标准曲线,得计算公式y=2.3900x+ 0.0130(R2=0.9978),其中,y表示吸光值,x表示β-葡聚糖。
2.3.2燕麦浊汁加工过程中β-葡聚糖含量变化β-葡聚糖是燕麦中重要的功能性成分,尤其水溶性β-葡聚糖的作用效果更显著。燕麦原料中水溶性β-葡聚糖的含量为12.80mg/g,相对偏低,可能是由于贮存时间过长,被燕麦中所含的内源β-葡聚糖酶分解或者脂肪氧化而降解。燕麦经过浸泡、蒸煮、打浆、酶解过滤、灭菌等工艺处理后,测定燕麦固体或者溶液中的β-葡聚糖的含量(分析前对溶液进行定容,根据溶液的体积计算出总量),结果用β-葡聚糖相对含量(即与原料中β-葡聚糖含量的比例)来表示,见图5。
浸泡后燕麦籽粒中β-葡聚糖的相对含量为78.68%,由于燕麦中的β-葡聚糖主要存在于麸皮中,麸皮位于燕麦的外层,水溶性的β-葡聚糖浸泡过程中溶解于水,而使燕麦籽粒中含量减少,邓万和[13]、张娟等[24]用水提法提取麸皮或燕麦粉中的β-葡聚糖原理即为此。因此,燕麦在浸泡时应控制合适的温度和时间,防止水溶性β-葡聚糖大量流失,或者将浸泡液加入后续加工中。
蒸煮时,将浸泡液倒入容器中,再加入适量蒸馏水。蒸煮后燕麦籽粒中β-葡聚糖相对含量为105.87%,相比原料提高5.87%,但与原料中的β-葡聚糖含量不存在显著差异。可能原因是高温长时间的蒸煮,促使部分非水溶性β-葡聚糖分子断裂,转变为水溶性β-葡聚糖;原料中β-葡聚糖测定时,燕麦未经过蒸煮,使得浸提过程中存在于胚乳里面的少量β-葡聚糖难以溶出,而蒸煮过程使得胚乳细胞破裂,内部的β-葡聚糖更加容易释放。研究结果与刘文胜等[15]的研究相同,他们采用100℃下蒸制20min的方法对燕麦进行灭酶处理,发现其中β-葡聚糖含量相对于未经处理的燕麦含量提高0.64%。Johansson等[25]的研究也表明水煮能够提高燕麦可溶性β-葡聚糖的含量。
打浆后,燕麦中β-葡聚糖相对含量为109.76%,与原料中β-葡聚糖含量有显著差别(p<0.05),较蒸煮后含量有所上升,但两者无显著差别,可能是打浆过程中的剪切力使得部分非水溶性β-葡聚糖分子断裂。Kivelä等[26]研究表明,均质能够使大分子的β-葡聚糖降解,Tosh等[27]发现,挤压能够显著增加β-葡聚糖的溶解性,即部分不溶性的大分子β-葡聚糖转变为水溶性的β-葡聚糖,打浆与挤压和均质均不同,但是工作过程中均产生剪切力,尤其是燕麦溶液在打浆时粘度很大,高速打浆产生的剪切力可能使部分不溶于水的β-葡聚糖分子被切割成可溶性小分子片段。

图5 不同加工过程对β-葡聚糖相对含量的影响Fig.5 β-glucan relative content of turbid oats beverage influenced by different processing stages
酶解过滤后燕麦浊汁中β-葡聚糖的相对含量为66.03%,相对于“打浆”等含量显著降低,原因是在该实验条件下溶液体系不是很利于β-葡聚糖的溶出,且燕麦麸皮相对于其余结构来讲,其中含有大量的纤维素不被水解,且打浆过程中不易被破碎,故过滤后被除去,存在麸皮中未溶出的β-葡聚糖可能会因此损失。
为了探究饮料中加糖酸调配对β-葡聚糖含量的影响,采用两种饮料配方进行灭菌。“灭菌1”、“灭菌2”中β-葡聚糖的相对含量分别为63.14%、62.47%,结果表明该灭菌工艺对水溶性β-葡聚糖几乎没有影响。
3 结论
稳定性是评价饮料品质的关键指标之一,尤其在燕麦饮料产品的开发过程中是常见的难题,通过α-淀粉酶水解淀粉,可以提高饮料的稳定性。利用10%的燕麦溶液,在最佳酶解工艺条件下(温度55℃、pH6.4、酶用量91.7U/100g溶液、时间180min),所得燕麦浊汁稳定性为93.3%。
浸泡、蒸煮、打浆等工艺对燕麦中水溶性β-葡聚糖有影响,浸泡后β-葡聚糖相对含量为78.7%,部分β-葡聚糖溶于水而流失;蒸煮和打浆能提高水溶性的β-葡聚糖含量;α-淀粉酶水解燕麦有利于β-葡聚糖的溶出;过滤操作中除去了绝大部分麸皮,导致没有溶解出的β-葡聚糖损失;121℃、20min高温灭菌对水溶性β-葡聚糖含量无明显影响。
燕麦浊汁制作过程中,为尽量减少水溶性β-葡聚糖的损失,要使麸皮中的β-葡聚糖得到充分浸提,同时控制好浸泡条件或对浸泡液加以利用。
[1]周素梅,申瑞玲.燕麦的营养及其加工利用[M].北京:化学工业出版社,2009.
[2]路威.燕麦品种品质及饮料加工特性研究[D].北京:中国农业科学院,2013.
[3]程黔.我国杂粮产业发展现状与对策[J].粮油加工,2008(8):27-32.
[4]胡新中,李小平.燕麦荞麦产品加工现状与思考[J].农业工程技术:农产品加工业,2013,12:24-27.
[5]曹盼.燕麦果汁复合饮料的研制[D].无锡:江南大学,2012.
[6]葛磊.燕麦发酵饮料的研制[D].无锡:江南大学,2012.
[7]徐康.酶法制备燕麦乳饮料的工艺技术研究[J].广州:暨南大学,2010.
[8]张民,刘玉柱,刘洋.燕麦饮料的研制[J].食品科技,2010,35(5):93-96.
[9]吴绍涵,沈群,谭斌,等.燕麦β-葡聚糖对肠道的保健作用研究进展[J].食品工业科技,2012(17):388-391.
[10]Kerckhoffs D AJM,Hornstra G,Mensink R P.Cholesterolloweringeffectofβ-glucanfromoatbraninmildly hypercholesterolemic subjects may decrease when β-glucan is incorporated into bread and cookies[J].American Journal of Clinical Nutrition,2003,78:221-227.
[11]Othman R A,Moghadasian M H,Jones P JH.Cholesterollowering effects of oat β-glucan[J].Nutrition Reviews,2011,69(6):299-309.
[12]Katz D L,Nawaz H,Boukhalil J,et al.Effects of oat and wheat cereals on endothelial responses[J].Preventive Medicine,2001,33:476-484.
[13]邓万和.燕麦β-葡聚糖的含量分析及其性质研究[D].北京:中国农业大学,2005.
[14]汪海波,徐群英,刘大川,等.燕麦β-葡聚糖的流变学特性研究[J].农业工程学报,2008,24(5):31-35.
[15]刘文胜,胡新中.不同灭酶处理对燕麦粉品质的影响[J].麦类作物学报,2010,30(3):564-567.
[16]Altan A,McCarthy K L,Maskan M.Effect of extrusion process on antioxidant activity,total phenolics and β-glucan content of extrudates developed from barley-fruit and vegetable byproducts[J].International Journal of Food Science&Technology,2009,44(6):1263-1271.
[17]Moura F A D,Pereira J M,Silva D O D,et al.Effects of oxidative treatment on the physicochemical,rheological and functional properties of oat β-glucan[J].Food Chemistry,2011,128:982-987.
[18]Kivela R,Pitkanen L,Laine P,et al.Influence of homogenisation on the solution properties of oat β-glucan[J]. Food Hydrocolloids,2010,24:611-618.
[19]马晶晶,王际英,张利民,等.采用3,5-二硝基水杨酸比色法测定饲料总淀粉含量[J].中国饲料,2012(14):38-40.
[20]邢楠楠,赵雨,刘宏,等.不同产地、不同年限人参中淀粉酶、酯酶、酸性磷酸酯酶的活力比较[J].中国现代应用药学,2011,28(1):44-47.
[21]杨海红,麻建国,许时婴.卡拉胶及糖、盐存在时对勾兑牛奶酒稳定性的影响[J].无锡轻工大学学报,2003,22(1):29-30.
[22]汪雪丽,杜先锋.燕麦麸中β-葡聚糖的提取及荧光法测定[J].中国食品添加剂,2007(6):158-161.
[23]段中华,乔有民.不同因子对燕麦β-葡聚糖提取纯度影响的研究[J].食品科技,2007(8):122-126.
[24]张娟,杜先锋,饶砚琴.刚果红法测定燕麦中β-葡聚糖含量的研究[J].安徽农业大学学报,2007(1):23-26.
[25]Johansson L,Tuomainen P,Anttila H,et al.Effect of processing on the extractability of oatβ-glucan[J].Food Chemistry,2007,105(4):1439-1445.
[26]Kivelä R,Pitkänen L,Laine P,et al.Influence of homogenisation on the solution properties ofoat β-glucan[J]. Food Hydrocolloids,2010,24(6-7):611-618.
[27]Tosh S M,Brummer Y,Miller S S,et al.Processing affects the physicochemical properties of β-glucan in oat bran cerea[J]. Journal of Agricultural and Food Chemistry,2010,58(13):7723-7730.
Study on enzymatic processing and soluble β-glucan variation of turbid oats beverage
ZHU Zhuan1,YANG Jin-qin2,SHEN Qun1,CHEN Yan-hui1,*
(1.College of Food Science and Nutritional Engineering,China Agricultural University,Beijing 100083,China;2.Yantai Industry and Trade Technician College of Shandong,Yantai 264003,China)
By determining the stability of the beverage,application of alpha-amylase in the processing of oats turbid beverage was studied,and the content variation of β-glucan was determined in method of Congo Red. Results showed that the optimal process conditions of enzymatic hydrolysis:temperature was 55℃,pH was 6.4,enzyme dosage was 91.7U/100g,hydrolysis time was 180min,and under this conditions the suspension stability was 93.3%.β-glucan in the oat was 12.8mg/g,soaking process resulted in loss of β-glucan,while cooking and beating increased the content of β-glucan.Enzymolysis of alpha-amylase and sterilization had no significant effect on β-glucan content.
oats turbid beverage;α-amylase;stability;soluble β-glucan
TS210.1
A
1002-0306(2015)02-0190-05
10.13386/j.issn1002-0306.2015.02.032
2014-03-17
朱转(1989-),女,硕士研究生,研究方向:粮食、油脂与植物蛋白质工程。
陈燕卉(1957-),女,博士,副教授,研究方向:营养与食品安全。
杂豆代餐饮品的研究开发品质评价研究(2012BAD34B08-05)。

