乙醇体系中酶抑制法检测氨基甲酸乙酯的研究
张佳佳,刘丽斌,刘智钧,黄秋婷,黄惠华,*(.华南理工大学轻工与食品学院,广东广州50640;.广州市酒类检测中心,广东广州5060)
乙醇体系中酶抑制法检测氨基甲酸乙酯的研究
张佳佳1,刘丽斌1,刘智钧1,黄秋婷2,黄惠华1,*
(1.华南理工大学轻工与食品学院,广东广州510640;2.广州市酒类检测中心,广东广州510160)
研究了在乙醇-水溶液和乙醇-缓冲液体系中,以乙酰胆碱酯酶对底物碘化硫代乙酰胆碱进行水解。根据氨基甲酸乙酯对乙酰胆碱酯酶的抑制率与吸光度的线性关系,测定体系中氨基甲酸乙酯的含量。实验发现,在乙醇-水溶液中,此方法不可行;而在低浓度乙醇-缓冲液体系中,氨基甲酸乙酯对乙酰胆碱酯酶的抑制率与其浓度在一定范围内呈线性关系。在5%、10%和15%乙醇-缓冲液体系中测定氨基甲酸乙酯的线性范围分别为2~10、1~5、1~5mg/L,相关系数在0.992~0.997之间,最低检出限为0.00895、0.04259、0.02916mg/L,RSD分别在1.41%~2.17%、0.34%~0.55%和3.61%~6.44%范围内。该法快速简便,所用仪器设备简单,检测成本低。本研究为酒精饮料及发酵食品中氨基甲酸乙酯的快速、简便、低成本检测方法的研究及相关产品的开发提供一定的理论和数据支持。
乙酰胆碱酯酶,酶抑制法,氨基甲酸乙酯,乙醇
氨基甲酸乙酯(Ethyl Carbamate,简称EC,又称Urethane),是发酵食品(如面包、奶酪、酱油等)和酒精饮料(如中国黄酒、日本清酒等)生产过程中的伴随产物[1]。早期研究表明,EC对于老鼠、猴子和仓鼠等多种动物具有基因毒性和致癌性,对人类存在潜在的致癌风险[2]。Nettleship在1943年证明了它是一种致癌物质[3]。2002年联合国粮农组织将其列为重点监控物质并制定了在食品中含量不得超过20μg/L的国际标准[4]。2007年国际癌症研究机构认定EC为2A类致癌物质,对人类具有潜在的致癌作用,与丙烯酰胺危险性同等[5]。
目前国内外对于酒精饮料中EC的检测方法有气相色谱法、气相色谱-质谱法、液相色谱法、傅立叶变换红外色谱法等[6],但尚不能满足快速、简便、低成本的要求。酶抑制法是蔬菜中有机磷和氨基甲酸酯类农药残留量的快速检测方法[7]。研究表明,酶抑制法可以用于酒中的EC含量的检测,并且在缓冲液体系中通过氧化剂溴水衍生,可以明显增大抑制率[8]。
一般来说,酶溶于水,而不溶于有机溶剂。同时,有机溶剂会降低许多酶的催化活性。酶和底物在有机溶剂中的扩散限制、立体障碍和酶构象的可变性都会对酶的催化活性造成影响[9],因此酒中复杂的有机溶剂对酶抑制法的影响需要进行深入研究。乙醇是酒中含量最大的有机溶剂,不能忽略其在酶抑制法测定EC时对酶活的影响。
国内外关于酶抑制法应用中有机溶剂对AChE活力的影响的研究报道不多,而对于酶抑制法检测EC时有机溶剂对酶活的影响方面的报道更少,基本上都未考虑有机溶剂对AChE的影响。因此,针对于这种现状,以及EC快速、简便的检测方法和有机溶剂对酶活的影响的重要性,本研究基于酶抑制法,在乙醇体系中研究EC的检测方法,探寻乙醇对酶抑制法测定EC的影响,为进一步开发和研究快速、简便、低成本检测EC的方法及产品提供理论和技术支持。
1 材料与方法
1.1材料与仪器
碘化硫代乙酰胆碱(ATCHI,10mg/mL)、二硫代二硝基苯甲酸(DTNB,10mg/mL,溶解于10mg/mL的碳酸氢钠溶液中)、乙酰胆碱酯酶(AChE)(BR,酶活力>200U/g,溶解于0.1mol/L pH9.0磷酸盐缓冲液中,13mg/mL)广州菲博生物科技有限公司;磷酸二氢钠(AR)、磷酸氢二钠(AR) 天津市科盟化工工贸有限公司;溴水(AR)、亚硝酸钠(AR) 天津市福晨化学试剂厂;氢氧化钠(AR)南京化学试剂有限公司;无水乙醇(AR) 国药集团化学试剂有限公司;碳酸氢钠(AR) 天津市化学试剂一厂。
UV1800型紫外-可见分光光度计日本岛津公司;PHS-25型pH计上海虹益仪器仪表有限公司;HH-1数显恒温水浴锅常州澳华仪器有限公司;XW-80A旋涡混合器上海精科仪器有限公司;BSA124SCW分析天平赛多利斯科学仪器(北京)有限公司。
1.2实验方法
1.2.1乙酰胆碱酯酶活性的测定参照Ellman法[10],于试管中加入5mL 0.1mol/L pH9.0 PBS,再加入100μL乙酰胆碱酯酶溶液(13mg/mL),混匀,于30℃水浴保温15min,加入100μL DTNB(10mg/mL)、100μL碘化硫代乙酰胆碱(10mg/mL),混合后,立即在412nm处比色,在3min内每隔0.1min连续测定吸光度值,记3min前后的吸光度变化值△A,每组3个平行样取平均值。应使AChE空白对照样△A3min>0.3才可继续操作。
乙酰胆碱酯酶活力定义为在30℃,0.1mol/L pH9.0的PBS中,每毫克酶蛋白每分钟分解底物碘化硫代乙酰胆碱的微摩尔数,按式(1)计算酶活力:
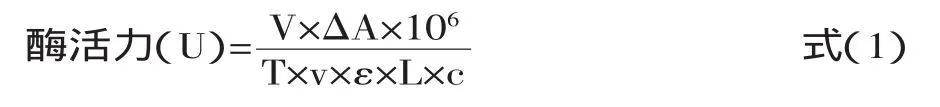
式中:V—反应体系的总体积,本体系为5.3×10-3L;△A—3min前后的吸光度变化值;T—反应时间,本法为3min;v—酶活测定时所用酶液体积,本法为0.1mL;ε—黄色产物摩尔消光系数,为1.36×104L/(mol×cm);L—比色皿光程(1cm)c—酶液浓度,mg/mL。
1.2.2酶抑制率的测定在试管中加入5mL样品溶液,加入100μL氧化剂溴水(3%)-氢氧化钠(0.01mol/L)[8],混匀,作用10min,用300μL 10%(w/v)亚硝酸钠还原过量的氧化剂[11],再加入100μL AChE溶液,混匀,加入100μL DTNB溶液、100μL碘化硫代乙酰胆碱溶液,混匀,立即在412nm处比色,在3min内每0.1min记录吸光度值。
以含有EC的磷酸盐缓冲溶液作为样品,以不含EC的磷酸盐缓冲溶液作为参照样,按式(2)计算酶抑制率:

式中:△Ac—参照样3min后与3min前吸光值之差;△As—样品3min后与3min前吸光值之差。
1.2.3不同浓度乙醇溶液对AChE的抑制配制5%、10%、15%、20%、25%、30%、35%、40%、45%、50%乙醇-水溶液、乙醇-缓冲液(PBS),分别在上述酒精溶液中,按1.2.1的方法测定酶活,以不加乙醇的蒸馏水或缓冲液(PBS)做对照。按下式(3)计算抑制率:

式中:△A—酒精溶液中3min前后的吸光度变化值;△A0—对照管3min前后的吸光度变化值。
1.2.4低浓度乙醇溶液中AChE的Km、Vmax的测定配制0.01、0.025、0.05、0.075、0.1、0.2、0.3mol/L碘化硫代乙酰胆碱,研究在5%、10%、15%乙醇-水溶液、乙醇-缓冲液(PBS)中、30℃保温15min的反应条件下,不同底物浓度的产物吸光度变化值规律。反应速度V按式(4)计算:

式中:T—反应时间,本法为3min;ε—黄色产物摩尔消光系数,为1.36×104L/(molcm);L—比色皿光程(1cm)。
根据Hanes-Woolf作图法求Km、Vmax。
1.2.5低浓度乙醇溶液中EC对AChE的抑制的测定选取5%、10%、15%乙醇-水溶液、乙醇-缓冲液(PBS),分别配制0.5、0.75、1.0、2.0、3.0、4.0、5.0、7.5、10mg/L的EC浓度,按1.2.2测定酶抑制率,绘制出工作曲线。
1.2.6检出限的确定分别在5%、10%、15%乙醇-缓冲液(PBS)中,首先做6次空白测定,获得空白测定结果的标准差SD空白,按公式(检出标准=t空白×SD空白)计算检出标准。然后分别在5%乙醇-缓冲液(PBS)中对2mg/L EC标准溶液进行6次测定,在10%、15%乙醇-缓冲液(PBS)中对0.75mg/L EC标准溶液进行6次测定,获得测定结果的标准差SD,查出相应的t,按公式(检出限=检出标准+SD×t)计算检出限。
1.2.7精密度的确定分别在5%、10%、15%乙醇-缓冲液(PBS)体系中,选择2.0、3.0、5.0、10mg/L四个浓度EC标准溶液,按1.2.2测定酶抑制率,每一浓度重复测定6次,求出相对标准偏差。
1.2.8数据处理方法实验结果采用软件Excel 2007进行数据处理并作图分析。
2 结果与分析
2.1不同浓度的乙醇溶液对AChE的抑制情况
由图1和图2可知,在乙醇-水溶液和乙醇-缓冲液(PBS)体系中,随着乙醇浓度的增加,乙酰胆碱酯酶的酶活力都呈不同程度减小的趋势,当乙醇浓度增加到一定浓度后,呈波动状态。在乙醇-缓冲液(PBS)体系中,当乙醇浓度增加至10%时,乙醇对乙酰胆碱酯酶的抑制率接近50%;当乙醇浓度增加至20%时,抑制率已达到了86%。在乙醇-水溶液中,当乙醇浓度增加至10%时,乙醇对酶的抑制率接近10%,当乙醇浓度继续增大至20%时,抑制率达到了88%。但乙醇浓度在20%~50%之间时,乙醇-水溶液比乙醇-缓冲液(PBS)体系中酶抑制率高。

图1 乙醇溶液浓度对酶活力的影响Fig.1 Influence of concentration of ethanol on enzyme activity

图2 乙醇溶液浓度对AChE的抑制率的影响Fig.2 Influence of concentration of ethanol on AChE inhibition rate
乙醇导致酶活下降的原因可能是:一是当体系中乙醇浓度增加时,乙醇可能会夺取酶分子表面的必需水,从而导致酶活力下降[12];二是由于酶不溶于大部分的有机溶剂,乙醇浓度过大时,还会出现悬浮颗粒状,酶与底物的接触受到扩散限制,或者酶活中心可能被其他酶分子遮挡住,从而导致酶活下降;三是有机溶剂介电常数低,疏水性改变了乙酰胆碱酯酶分子与水分子之间的非共价作用力,使得酶分子之间静电作用力增加,结构趋于刚性,分子柔性下降,影响了酶活力[13]。
分析可知,酶抑制法要想用于检测乙醇体系中的EC含量,必须在低浓度乙醇体系中进行,或者使用大孔吸附树脂吸附乙醇等方法进行前处理降低乙醇的浓度,使得该方法可以应用到更大范围的酒精饮料和发酵食品中EC的检测上;或者也可以采用一定方法将EC萃取出来,再应用酶抑制法进行测定。因此,后续实验中选择5%、10%、15%的低乙醇溶液体系进行酶抑制法的实验。研究乙醇对酶活的影响,为进一步分析有机体系对酶抑制法的影响提供部分数据和理论支持,有利于完善酶抑制率法在酒中检测EC的应用。
2.2低浓度乙醇对AChE的Km、Vmax的影响
2.2.1乙醇-水溶液体系中低浓度乙醇对AChE的Km、Vmax的影响图3所示为5%、10%、15%乙醇-水溶液中,AChE的米氏方程。0%(PBS)、5%、10%、15%乙醇-水溶液中AChE的Km、Vmax的对比如表1所示。
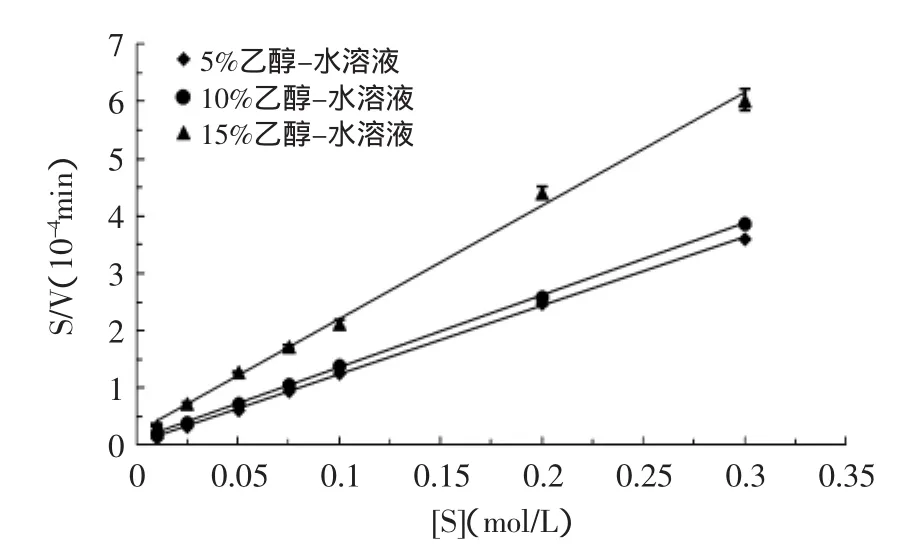
图3 不同浓度乙醇-水溶液中AChE的米式方程Fig.3 M type equation at different concentrations in ethanol aqueous solution
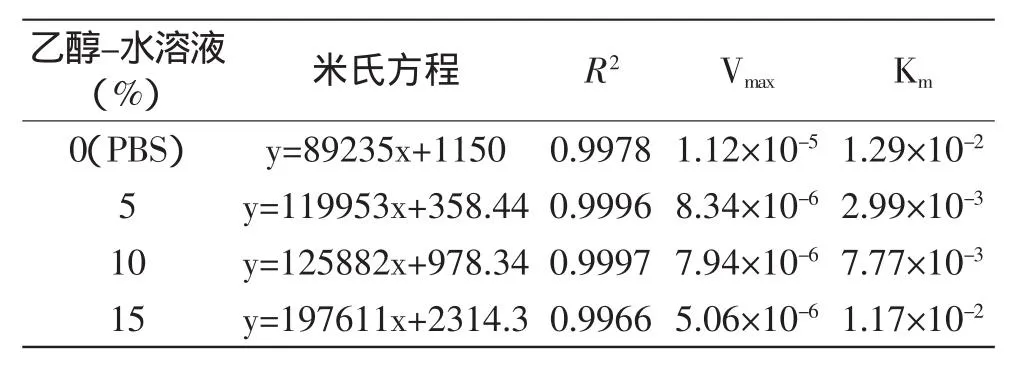
表1 不同浓度乙醇-水溶液中AChE的Km、VmaxTable 1 Kmand Vmaxof AChE at different concentrations in ethanol aqueous solution
由图3和表1可知,与缓冲液(PBS)体系相比,乙醇-水溶液体系中乙酰胆碱酯酶的Vmax降低了一个数量级,Km也明显比缓冲液(PBS)中的Km值小,并且随着乙醇浓度的增加,Vmax呈减小的趋势,但是Km随乙醇浓度增加不断地增加。可能是因为乙醇的加入,由于扩散限制影响了酶与底物的接触,从而降低了反应速度,Km值也自然增大。
2.2.2乙醇-缓冲液(PBS)溶液体系中低浓度乙醇对AChE的Km、Vmax的影响图4所示为5%、10%、15%乙醇-缓冲液(PBS)溶液中,AChE的米氏方程。0%(PBS)、5%、10%、15%乙醇-缓冲液(PBS)中AChE的Km、Vmax的对比如表2所示。
由图4和表2可知,在5%和10%的乙醇-缓冲液(PBS)体系中乙酰胆碱酯酶的Vmax与缓冲液(PBS)体系中的Vmax相比,稍微增加,Km明显增大。当乙醇浓度达到15%时,与缓冲液(PBS)中的Vmax、Km相比,乙醇-缓冲液(PBS)体系中酶的Vmax明显减小,Km明显增大。也就是酶活力的大小与体系中乙醇含量的关系呈现钟形曲线。可能是酶在有机溶剂中的构型更加刚性,且限制了部分水相中的热不可逆失活的共价作用,酶稳定性增加[14]。所以低浓度乙醇中虽然酶活稍有抑制,但总体还是增加,但乙醇浓度过高时,大部分酶活被抑制,且浓度可能已经过了提高酶稳定性的最佳比例,所以Vmax下降。
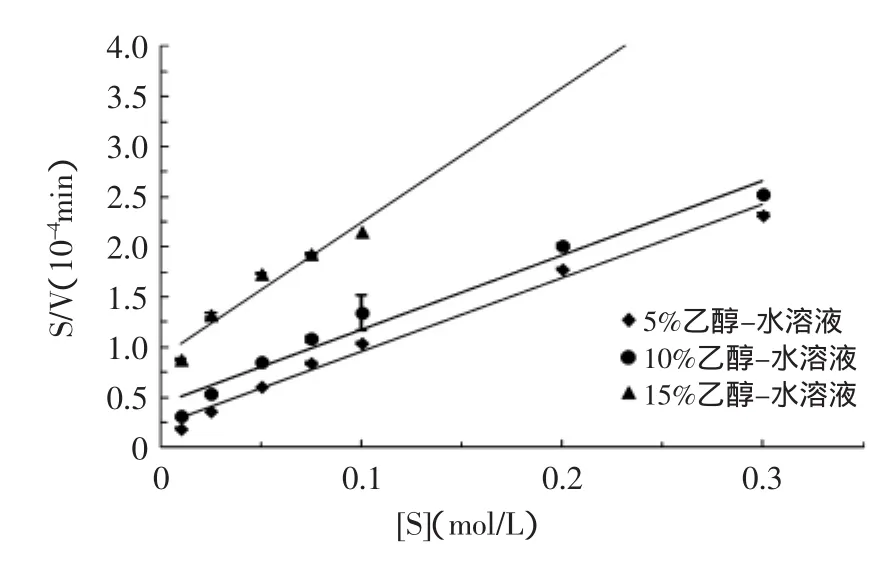
图4 不同浓度乙醇-缓冲液中AChE的米式方程Fig.4 M type equation at different ethanol concentrations in ethanol-buffer
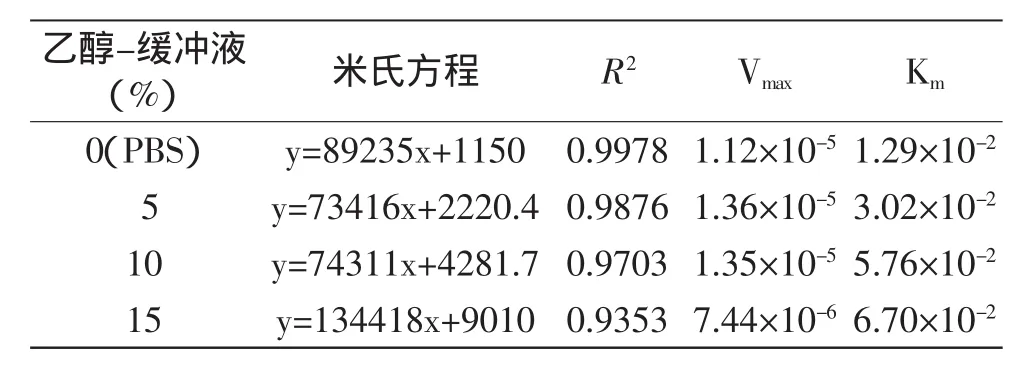
表2 不同浓度乙醇-缓冲液中AChE的Km、VmaxTable 2 Kmand Vmaxof AChE at different ethanol concentrations in ethanol-buffer
2.3低浓度乙醇溶液中EC对AChE的抑制情况
在乙醇-水溶液体系中,EC对AChE的抑制情况如图5所示。
由图5可知,在5%的乙醇-水溶液中,按照1.2.2加入溴水处理做对照组后,吸光值与时间的关系并不呈直线,而是无线性规律的缓慢增长的曲线;加入EC的组也出现相同的情况。因此,吸光度随时间的变化曲线并不能反映出生成物的含量随时间的变化,也就无法反映出EC对AChE的抑制情况。在10%和15%的乙醇-水溶液体系中测定时也出现了这种情况。所以无法做出在乙醇-水溶液体系中的工作曲线。这种现象可能是由于乙酰胆碱酯酶对体系pH的要求比较高,也可能是不符合溴水反应或者DTNB显色的反应条件。因此,酶抑制率法不能应用在乙醇-水溶液体系中。
在乙醇-缓冲液(PBS)体系中,EC对AChE的抑制情况,即工作曲线如图6所示,EC对AChE的抑制率线性方程如表3所示。
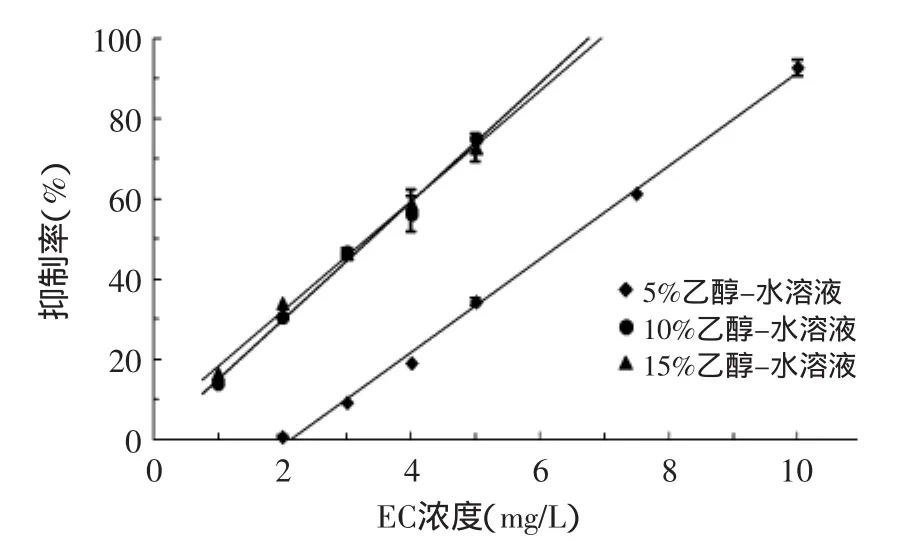
图6 不同浓度乙醇-缓冲液中EC的工作曲线Fig.6 Work curve of EC at different ethanol concentrations in ethanol-buffer
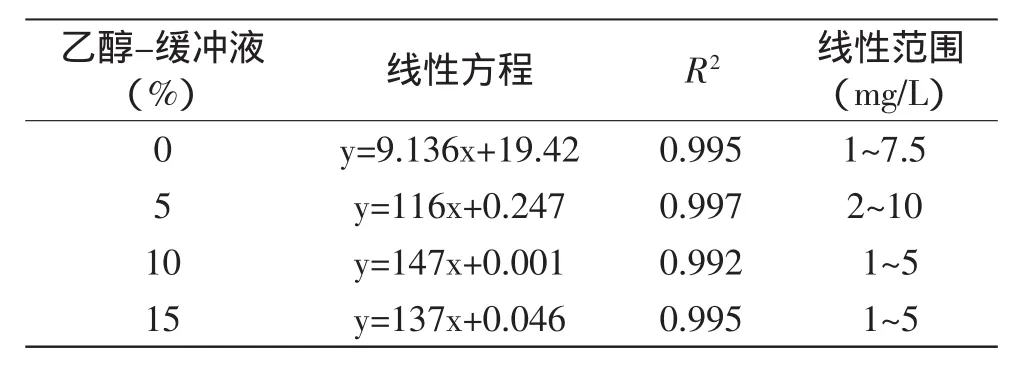
表3 不同浓度乙醇-缓冲液中EC的工作曲线Table 3 Work curve of EC at different ethanol concentrations in ethanol-buffer
由图6和表3可知,在5%、10%和15%的乙醇-缓冲液(PBS)体系中,EC对AChE的抑制率与EC的浓度呈良好的线性关系。相关系数在0.992~0.997之间,乙醇浓度为5%时,线性范围是2~10mg/L;乙醇浓度为10%和15%时,线性范围是1~5mg/L。
本文就低浓度乙醇体系中的两种体系,即低浓度乙醇-水溶液体系和低浓度乙醇-缓冲液(PBS)体系进行研究。低浓度乙醇-水溶液体系中无法得到工作曲线,说明不能在此体系中进行EC含量的检测;而低浓度乙醇-缓冲液(PBS)体系中得到了工作曲线,且线性关系良好,说明在低浓度酒精饮料及发酵食品检测EC时要将低浓度乙醇样品置于缓冲液体系中再进行检测。对于高浓度酒精类饮料或发酵食品,可以对其进行脱醇等前处理,或者萃取EC后进行酶抑制法的测定。乙醇是复杂有机体系中的一种,除了乙醇以外的有机溶剂对酶活的影响还有待继续进行深入的研究,方可进一步完善酶抑制法在EC检测上的应用。
2.4检出限的确定
乙醇-缓冲液(PBS)体系中,酶抑制法检测EC的检出限如表4所示。
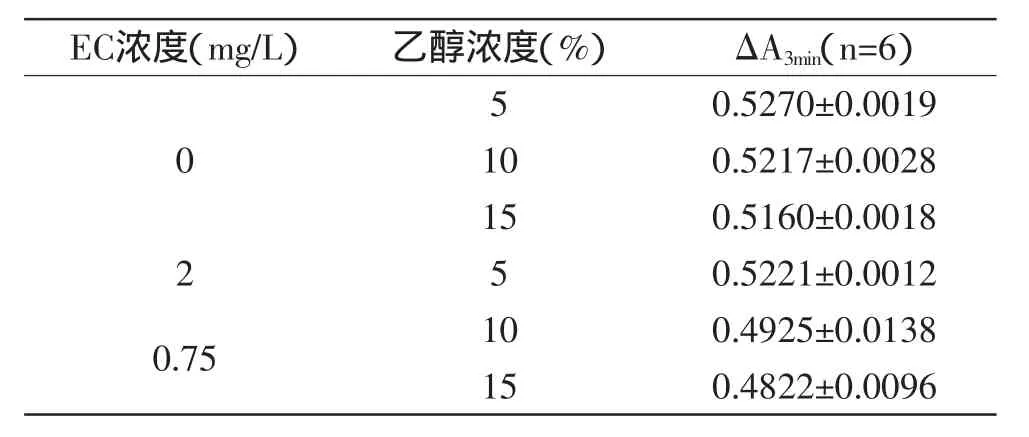
表4 乙醇-缓冲液体系中酶抑制法检测氨基甲酸乙酯的检出限Table 4 Detection limit of EC based on inhibition rate in ethanol-buffer
由表4可知,在5%、10%、15%乙醇-缓冲液(PBS)体系中,酶抑制法检测EC的检出限分别为0.00895、0.04259、0.02916mg/L。
2.5精密度的确定
乙醇-缓冲液(PBS)体系中,酶抑制法检测氨基甲酸乙酯的精密度实验结果如表5所示。
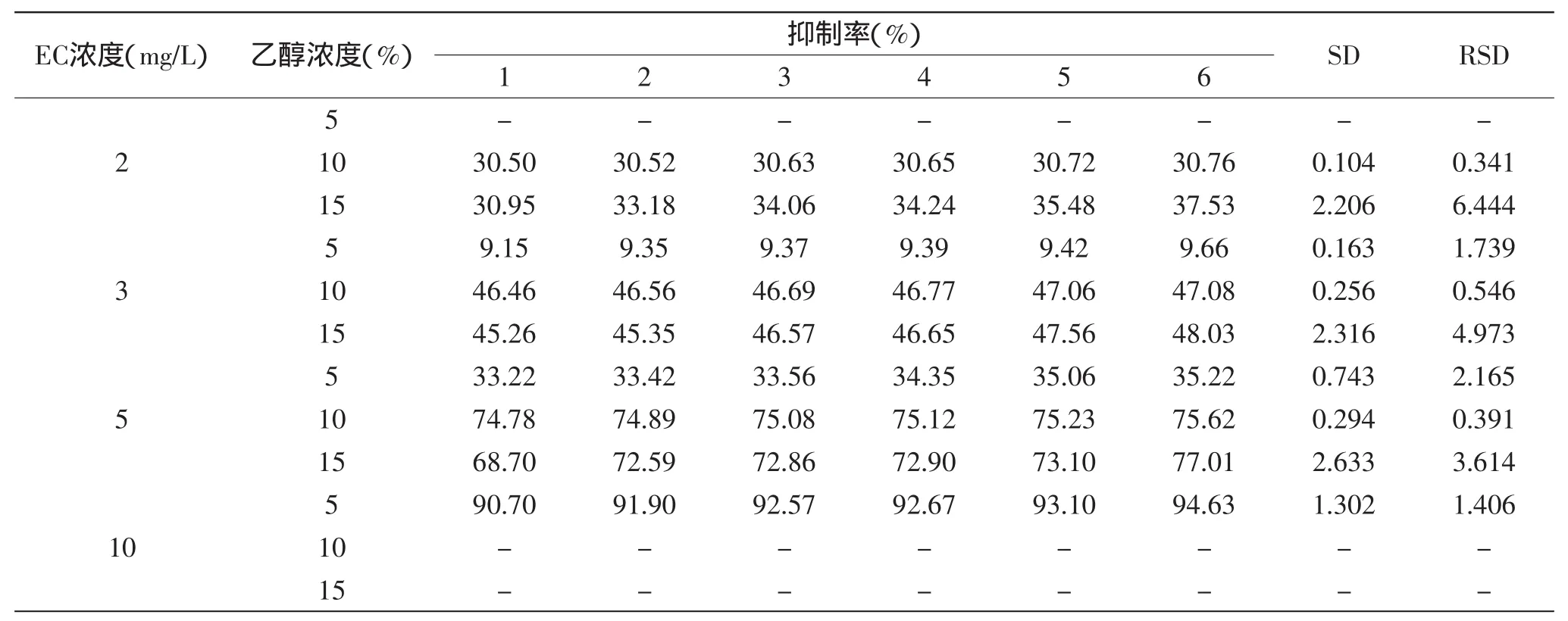
表5 乙醇-缓冲液体系中酶抑制法检测氨基甲酸乙酯的精密度(%)Table 5 Precision(%)of ethyl carbamate based on inhibition rate in ethanol-buffer
由表5可知,在5%和10%的乙醇-缓冲液(PBS)体系中,RSD分别在1.41%~2.17%和0.34%~0.55%;在15%的乙醇-缓冲液(PBS)体系中,RSD在3.61%~6.44%之间。因此,5%和10%的乙醇-缓冲液(PBS)体系精密度良好,而15%的乙醇-缓冲液(PBS)体系精密度有所下降。所以酶抑制法可以在低浓度乙醇-缓冲液(PBS)体系中检测EC的含量。
3 结论
3.1在乙醇-水溶液和乙醇-缓冲液(PBS)体系中,随乙醇浓度的增加,乙酰胆碱酯酶的活力都不同程度的减小,且当乙醇浓度增加至20%时,酶活力已被抑制了88%左右。因此,酶抑制法用于检测乙醇体系中的EC含量时,必须在低浓度乙醇体系中进行。
3.2在低浓度乙醇-水溶液体系中,无法得到EC的工作曲线。因此,在进行酒类及发酵类食品中EC含量的检测时不能在低浓度乙醇-水溶液体系中,而应在低浓度乙醇-缓冲液(PBS)体系中进行。本研究得到在5%、10%和15%的乙醇-缓冲液(PBS)体系中测定EC的线性范围分别为2~10、1~5、1~5mg/L,相关系数在0.992~0.997之间,RSD分别在1.41%~2.17%、0.34%~0.55%、3.61%~6.44%之间,最低检出限分别为0.00895、0.04259、0.02916mg/L。
3.3该方法所用试剂成本低,方法快速简单、条件温和易于控制、所用设备少,易于操作。本研究有利于酒精饮料及发酵食品中的氨基甲酸乙酯检测方法及产品的研究与开发。
[1]Kim Y L,Koh E,Chung H,et al.Determination of ethyl carbamate Korean foods and beverages[J].Food Additives and Contaminants,2000,17(6):469-475.
[2]Beland F A,Benson W R,Mellick P W,et al.Effect of ethanol on the tumoriginity of urethane(ethyl carbamate)in B6C3F1 mice[J].Food Chemical Toxicology,2005,43:1-19.
[3]Anderson N,Henshaw P S.Induction of pulmonary tumors in mice with ethyl carbamate(urethane)[J].Journal of the National Cancer Cancer Institute,1943,4:309-319.
[4]高年发,宝菊花.氨基甲酸乙酯的研究进展[J].中国酿造,2006(9):1-4.
[5]Ajtony Z,Szoboszlai N,Bencs L,et al.Determination of ethyl carbamate in wine by high performance liquid chromatograph[J]. Food Chemistry,2013,141:1301-1305.
[6]Leca J M,Pereira V,Pereira A C,et al.Rapid and sensitive methodology for determination of ethyl carbamate in fortified winesusingmicroextractionbypackedsorbentandgas chromatography with mass spectrometric detection[J].Analytica Chimica Acta,2014,811:29-35.
[7]中华人民共和国卫生部.GB/T 5009.199-2003蔬菜中有机磷及氨基甲酸酯农药残留量的快速检测[S].2003.
[8]刘丽斌,黄秋婷,彭程.乙酰胆碱酯酶抑制率法测定氨基甲酸乙酯的研究[J].食品工业科技,2014,35(5):299-302.
[9]彭立风.有机溶剂对酶催化活性和选择性的影响[J].化学进展,2000,12(3):296-304.
[10]Ellman G L,Courtney D,Andres V,et al.A new and rapid colorimetric determination of acetyl cholinesterase activity[J]. Biochem ical Pharmacology,1961,7(2):88-95.
[11]梁新红,赵瑞香,周全霞.酒精饮料中氨基甲酸乙酯的检测方法研究进展[J].食品工业科技,2010,31(8):400-408.
[12]杨缜.有机介质中酶催化的基本原理[J].化学进展,2005,17(5):924-930.
[13]王春光,颜冬云,秦文秀.典型有机溶剂对乙酰胆碱酯酶活性抑制的影响[J].农药,2011,55(11):799-801.
[14]邱树毅,姚汝华.有机溶剂中的酶催化-水和有机溶剂的影响[J].工业微生物,1996,26(3):40-45.
Determination of ethyl carbamate in ethanol system based on enzyme inhibition method
ZHANG Jia-jia1,LIU Li-bin1,LIU Zhi-jun1,HUANG Qiu-ting2,HUANG Hui-hua1,*
(1.College of Light Industry and Food Sciences,South China University of Technology,Guangzhou 510640,China;2.Alcohol Testing Center of Guangzhou,Guangzhou 510160,China)
Acetylcholine was hydrolyzed by acetylcholinesterase in ethanol aqueous solution and ethanol-buffer respectively.The content of ethyl carbamate was determined and calculated,according to the linear relationship between ethyl carbamate and acetylcholinesterase activity.The results showed that this method was unfeasible in ethanolaqueous solution system.It was found that while there was a linear relationship between inhibition rate of acetylcholinesterase activity and concentration of ethyl carbamate in certain range in ethanolbuffer.At 5%,10%and 15%ethanol-buffer systems,the linear detection scales showed from 2~10,1~5,1~5mg/L respectively,with the correlation coefficients 0.997,0.992 and 0.995 respectively.The detection limit reached 0.00895,0.04259,0.02916mg/L respectively and RSD showed ranges from 1.41%~2.17%,0.34%~0.55%,3.61%~6.44%respectively.The method exhibited the merits not only in detection time,few use of instruments and equipment,but also in less cost.The study provided data and theoretical support for fast,simple and cheap methods and relative products of determining ethyl carbamate in alcohol beverages and fermented foods.
acetylcholinesterase;enzyme inhibition method;ethyl carbamate;ethanol
TS207.3
A
1002-0306(2015)02-0065-06
10.13386/j.issn1002-0306.2015.02.005
2014-05-23
张佳佳(1990-),女,硕士研究生,研究方向:食品工程。
黄惠华(1959-),男,博士研究生,教授,研究方向:农产品深加工与高值化利用。
广州市科技计划项目(201300000079)。

