表面等离子共振传感器检测3 种果汁中亚胺硫磷残留
宋 洋,王 静,陈晓明*
(1.天津师范大学生命科学学院,天津市动植物抗性重点实验室,天津 300387;2.天津市林业果树研究所,天津 300384)
表面等离子共振传感器检测3 种果汁中亚胺硫磷残留
宋 洋1,王 静1,陈晓明2,*
(1.天津师范大学生命科学学院,天津市动植物抗性重点实验室,天津 300387;2.天津市林业果树研究所,天津 300384)
基于亚胺硫磷多克隆抗体,建立苹果汁、桃汁、橙汁中亚胺硫磷残留的表面等离子共振(surface plasmon resonance,SPR)传感器检测方法。采用磷酸盐缓冲液直接稀释样品10倍后,基本消除基质影响,加标回收率为84.88%~104.69%,变异系数低于6.70%,样品的最低检出限为0.1 μg/L,与高效液相色谱检测结果相关系数为0.992,所建立的SPR检测方法达到了快速准确检测的要求。SPR反应芯片对亚胺硫磷的检测时间为30 min,且在3 d内可反复检测30 次,可有效降低检测成本。通过与同源抗体建立的酶联免疫方法比较发现:SPR方法在检测限、精确度、灵敏度等方面有着一定优势,但对于单残留样品的检测,在时间上不具有明显优势,更适合于高通量、多残留的检测。
果汁;亚胺硫磷;表面等离子共振传感器;酶联免疫
果汁饮品在日常生活中被普遍接受,但是在种植过程中,为了保证水果品质及产量,各类农药被广泛使用,因此果汁也就无可避免地含有农药残留。2012年,可口可乐公司果粒橙被检出农药超标,果汁的农药残留问题受到广泛关注。由于不同国家的经济和科技发展水平都存在着较大差距,导致在发达国家已经遭到禁用的高毒性、高残留农药,在某些发展中国家可能仍在使用,造成了各国在食品安全标准上存在差距[1]。目前国内外还没有针对果汁中亚胺硫磷的限量标准,只以相应水果的最高残留限量标准(maximum residue limit,MRL)作为参考,日本肯定列表对食品中亚胺硫磷残留限量标准中规定:苹果、桃、橙子、杏的最大残留限量分别为10、10、10、5 mg/kg。因此,能够准确可靠地测定果汁中农药残留物的科学分析就显得非常重要。亚胺硫磷是中等毒性的有机磷农药,广泛应用在水果、蔬菜和粮食作物的生产中[2-3]。美国环保总署对亚胺硫磷在9 种作物上的使用(杏树、苹果、越橘、葡萄、海棠、李子、油桃、梨、桃)做出了限定使用次数的决定,并增加了在大部分作物上的限制使用时间间隔,要求附加工人生物监控数据和使用限制[4-6]。目前亚胺硫磷主要的检测手段是利用大型仪器设备,如气相色谱-质谱(gas chromatography-mass spectrometry,GC-MS)、高效液相色谱(high performance liquid chromatography,HPLC)、液相色谱-质谱(liquid chromatography-mass spectrometry,LC-MS)已建立了多种苹果[7]、西瓜[8]、蔬菜[9]、茶叶[10-11]及粮油[12]的仪器检测方法,其方法准确、灵敏,但仪器方法资本投入大,检测时间较长,因此不能完全满足目前食品安全检测的需要。21世纪初,酶联免疫吸附测定(enzyme-linked immunosorbent assay,ELISA)法作为灵敏、高效、快速的检测技术得到飞速发展。Liang Ying等[13-14]利用亚胺硫磷硫代磷酸酯半族进行结构衍生,制备出硫代磷酸酯有机磷农药广谱多克隆抗体,IC50达到159.7 ng/mL;Song Yang等[15]利用对亚胺硫磷结构邻苯二甲酰亚胺半族结构进行衍生,合成人工抗原,成功制备出多克隆抗体,IC50达到2 0.0 n g/m L,对苹果、桃、黄瓜、甘蓝等进行了检测,达到了满意的效果。
表面等离子体共振(surface plasmon resonance,SPR)是基于免疫学原理,兼有仪器方法和免疫学方法的优势[16]。在21世纪初,已有国外学者成功地利用SPR技术对环境水中的农药残留进行了检测[17-19]。Dong Jianwei等[20]利用分子印迹聚合物作为识别元件偶联在SPR芯片表面,对环境水中丙溴磷的半定量检测。结果表明,高灵敏的识别元件可以有效提高检测的准确度和稳定性。Liu Ming等[21]建立了猪肉中莱克多巴胺高灵敏度SPR间接检测方法,并对全抗原芯片敏感膜的稳定性、准确性、反应离子体系等进行了详尽的研究。目前,利用SPR技术检测食品中小分子农药的残留,其间接竞争法因稳定性及灵敏度较好,在SPR检测中使用最为多见,如2,4-二氯苯氧基乙酸(2,4-D)[22-23]、叶酸[24]等。Song Yang等[25]建立了蔬菜食品中亚胺硫磷的SPR检测方法,其检测限达到了ppt级的痕量检测。
本实验基于多克隆抗体研究,在修饰的金片表面结合了抗原,对3 种果汁样品中亚胺硫磷残留进行快速检测,经HPLC进行方法验证。该方法具有不需标记、自动化程度高、高效等优势,且偶联的芯片可反复使用多次,大大降低了成本,且偶联好的芯片可携带至检测机构,更加提高了现场检测的效率。本实验对样品检测的时间、芯片的稳定性及检测限等方面与同源抗体建立的ELISA方法进行了评价和比对,为果汁样品的快速检测提供了理论依托和技术保障。
1 材料与方法
1.1材料与试剂
100%苹果汁、100%桃汁、100%橙汁(经HPLC检测,均不含有亚胺硫磷) 市购。
亚胺硫磷(99%)、Tween-20、乙醇胺、碳二亚胺盐酸盐(1-(3-dimethylaminopropyl)-3-ethylcarbodiimide h y d r o c h l o r i d e,E D C)、N-羟基琥珀酰亚胺(N-hydroxysuccinimide, 1-hydroxypyrrolidine-2,5-dione,NHS)、十二烷基磺酸钠(sodium dodecyl sulfonate,SDS)(99%) 美国Sigma公司;巯基十一酸 百灵威科技有限公司;乙腈、甲醇(均为色谱纯) 德国Merck公司。
1.2仪器与设备
ESPRIT表面等离子共振生物传感器、芯片 荷兰Auto Lab公司;LC-10AT高效液相色谱 日本岛津公司。
1.3方法
1.3.1常用缓冲溶液
0.01mol/LpH7.4的磷酸盐缓冲生理盐水(phosphate buffered saline,PBS);10mmol/LpH4.5醋酸-醋酸钠缓冲液;PBST缓冲液;100mmol/L NHS溶液;400 mmol/L EDC溶液;1 mmol/L巯基十一酸溶液;1mol/L乙醇胺(pH 8.5)。
1.3.2多克隆抗体
亚胺硫磷多克隆抗体建立在对其结构的衍生化,得到的半抗原(hapten-PH),经过与钥孔血蓝蛋白偶联得到的免疫原,对新西兰大白兔进行免疫得到多克隆抗体anti-PH。经Protein A-Sepharose 4B纯化得到的抗体质量浓度为3.50 mg/mL。建立的亚胺硫磷直接竞争ELISA方法灵敏度为20.00μg/L,检测限为0.60μg/L[15]。
1.3.3SPR亚胺硫磷标准曲线的建立
以无待测小分子抑制的响应值为B0值,一定质量浓度的待测小分子抑制时的响应值为B值,可按式(1)计算抑制率:

以小分子质量浓度的负对数为横坐标,以B/B0为纵坐标,绘制标准曲线,获得回归方程。每个质量浓度测得3 个重复值,对其响应值(y)进行测定,见式(2)。

式中:x为亚胺硫磷的质量浓度/(ng/L);A为空白溶液的响应值,即不加亚胺硫磷竞争抗原的响应值;D为亚胺硫磷质量浓度趋于无穷大时所对应的响应值,可用溶液的背景值代替。
1.3.4样品前处理
SPR:取1 mL果汁于管中,加入的亚胺硫磷标准品后的质量浓度水平为0.1、0.2、0.5 μg/L,样品经PBS稀释10 倍后,过0.22 μm滤膜,待用。
ELISA:取1 mL果汁于管中,加入的亚胺硫磷标准品后的质量浓度水平为30、100、200 μg/L,样品经PBS稀释20 倍,待用。
HPLC:取样前先将果汁摇匀,在分液漏斗中倒入量取100 mL果汁,并依次加入50 mL乙腈、5 g氯化钠,用力摇动分液漏斗5 min,待氯化钠溶解完全后,将漏斗静置10 min;弃去水层后再反复萃取3 次,提取液经旋转蒸发仪旋蒸至小体积,后用氮气吹至尽干,用1 mL甲醇定容,过0.22 μm滤膜,供HPLC分析。
1.3.5色谱条件
采用LC-10AT HPLC仪,确定亚胺硫磷的HPLC检测条件为:检测器:Waters 2998PDA;检测波长:218 nm;色谱柱:C18(15 cm×4.6 mm i.d.,5 μm);流动相:乙腈-水 (45∶55,V/V);流速:1.0 mL/min;柱温箱温度:35 ℃。
1.3.6SPR芯片稳定性研究
对同一芯片与抗体多次反应,考察其响应值变化,判断固定化后的芯片使用上限;对芯片进行PBS封闭保存,分别在1、2、3 d对其与抗体反应的响应值进行比较,通过变异系数的考量,判断其保存时间。
2 结果与分析
2.1亚胺硫磷SPR标准曲线的构建
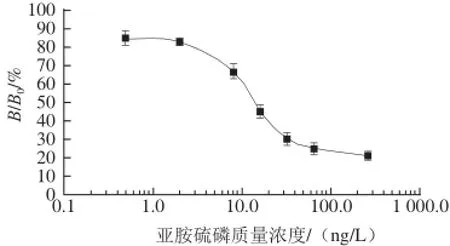
图1 亚胺硫磷SPR标准曲线Fig.1 SPR standard curve of phosmet
在巯基十一酸溶液自组装芯片上偶联20 mg/L PHBSA,将16 mg/L的抗体anti-PH与将不同质量浓度的亚胺硫磷标准溶液等体积混合,使得亚胺硫磷标准溶液质量浓度分别为(0.0、0.5、2.0、8.0、16.0、32.0、64.0、256.0 n g/L),反应缓冲液为1 0 m m o l/L pH 7.4 PBS,工作温度25 ℃,再生液 0.1 mol/L HCl溶液,抗体反应时间30 min。如图1所示,建立的SPR亚胺硫磷标准曲线,其最低检出限为1.6 ng/L,IC50为10.0 ng/L,线性范围为8.0~60.0 ng/L(RSN= 3)[25]。
2.2果汁基质影响的消除
消除基质影响是为了最大化地降低样品中影响抗原抗体结合的影响因子的作用,使样品的基质曲线与标准曲线基本重合。果汁中的糖和色素是基质影响的主要因子,通常通过SPE小柱进行净化后去除。SPR建立在免疫学基础上,结合光学测定原理,可对浑浊或不透明的样品进行测定,因此可省去复杂的前处理。由图2可以看出,果汁通过PBS缓冲液稀释10 倍后,其SPR基质曲线与标准曲线基本重合;通过PBS稀释20 倍后,其ELISA基质曲线与标准曲线基本重合,说明基质的影响基本消除,可以进行添加回收实验。
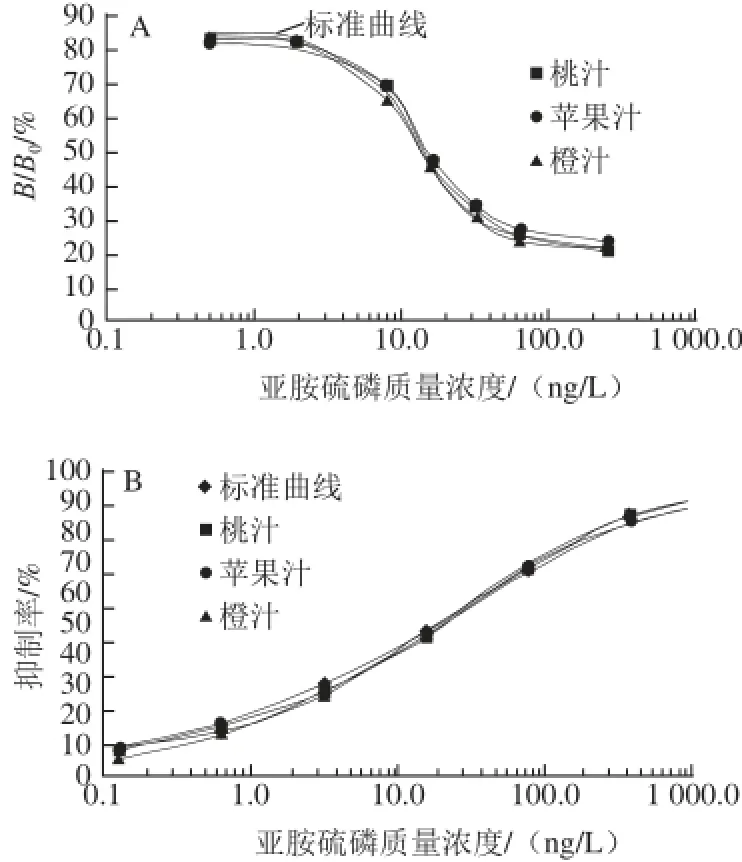
图2 亚胺硫磷样品的SPR(A)及ELISA(B)基质曲线Fig.2 SPR and ELISA standard curves of phosmet in juice samples
2.3SPR方法准确度评价
表1表明,SPR方法回收率为84.88%~104.69%,变异系数低于6.7 0%;E L I S A方法回收率为79.17%~104.98%,变异系数低于8.02%。与HPLC方法的线性相关系数R2值分别为0.992和0.985,均满足准确度要求。
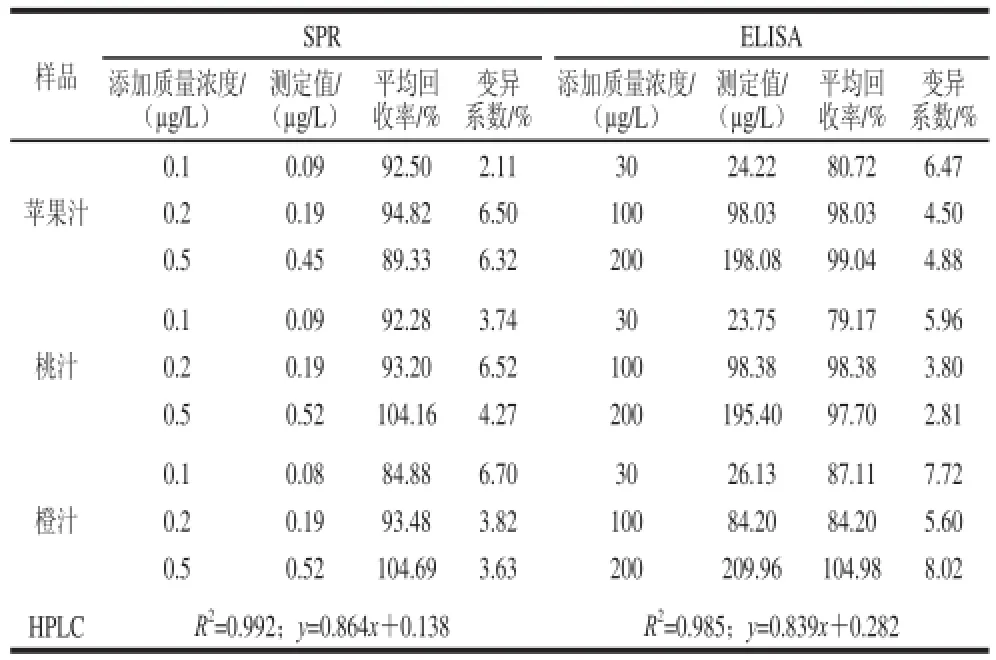
表1 SPR、ELISA添加回收结果与HPLC相关系数(n=4)Table 1 Recoveries of phosmet in spiked juices by SPR and ELISA and linear correlations of the two methods with HPLC (n= 4)
2.4芯片的稳定性评价
自组装芯片表面的裸金层和在巯基修饰后是很稳定的,一般在极端pH值和中等质量浓度的有机试剂条件下具有较强耐受,可在4 ℃的实验条件下放置3 个月,稳定性较好。当配体被固定于传感芯片表面上,传感器芯片对于各种试剂和条件的耐受程度就主要取决于所连配体的性质,如配体浓度、抗酸碱度、结构稳定性等,因此不同反应芯片的稳定性各不相同。
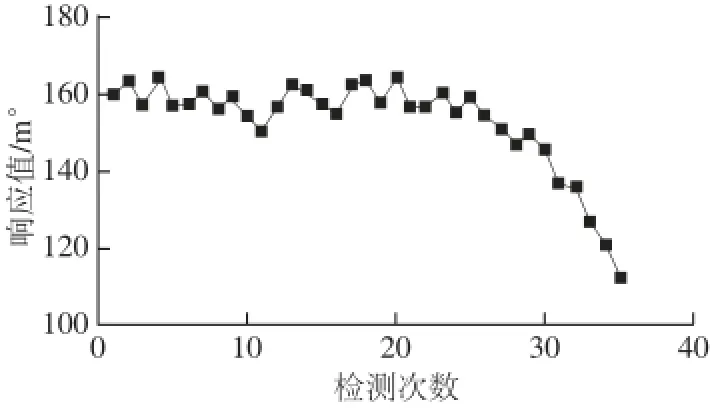
图3 芯片的使用次数与响应值关系Fig.3 Relationship between repeated chip use and response value
考察一个固定化后的反应芯片在与抗体反应多次后,响应值的变化情况。同一反应芯片在1、2、3 d时,与抗体反应的响应值分别为68.50、157.62、142.33 m°,结合图3可以看出,反应芯片与抗体反应30 次,响应值均比较稳定,无明显变化,而之后再次反应,即出现下降趋势,表示亚胺硫磷反应芯片的使用上限为30 次。反应芯片在PBS封闭条件下保存3 d,将1、2、3 d的响应值比较,得到3 d的响应值变异系数为8.4%,说明芯片在液体封闭条件下可保存3 d。为了节省实验成本,实验中共反复使用1、2、3 g 3 个芯片进行测定,抗体反应的响应值分别为168.50、154.6、148.7 m°,不同芯片与抗体响应值变异系数为6.46%,表明偶联全抗原芯片的稳定性较好,该检测芯片具有应用和推广意义。
2.5SPR样品检测时间评价
16 μg/mL的抗体anti-PH与芯片上的完全抗原结合,对亚胺硫磷进行SPR检测。将抗原抗体反应时间分别设定为10、20、30 min进行检测,其他工作条件保持不变,对建立的标准曲线进行分析,比较各检测质量浓度的变异系数。由表2可知,反应时间在30 min时,各质量浓度的变异系数较低,有稳定的响应信号,表明重现性较好,当反应时间不充分时,各质量浓度值具有较大的偏差。因此亚胺硫磷SPR检测时间设定为30 min。
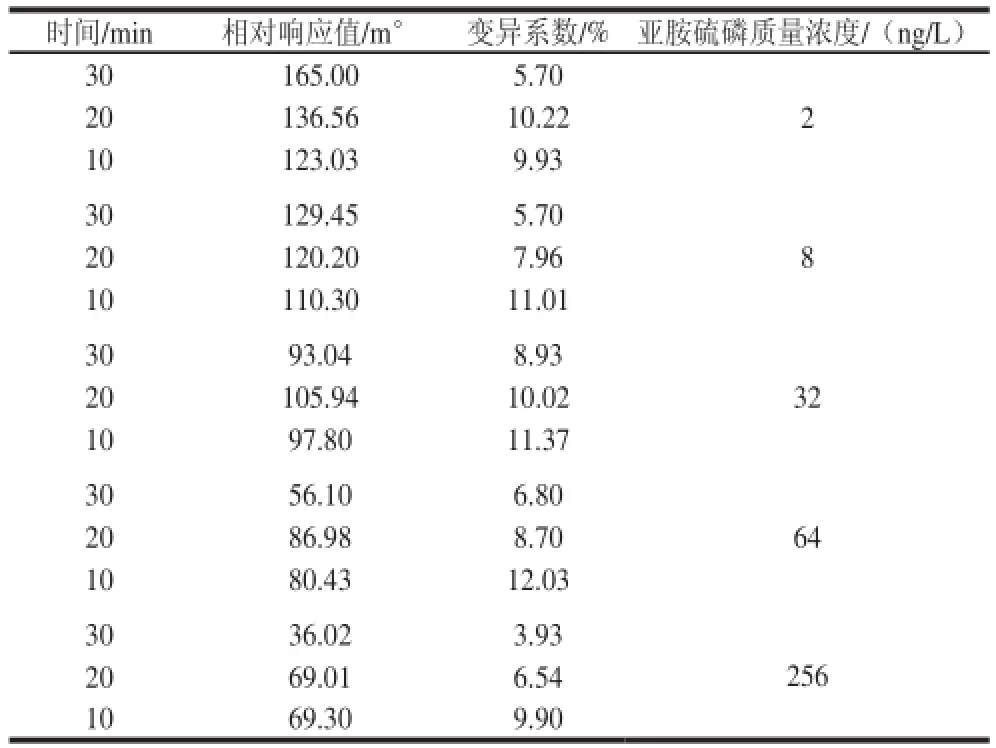
表2 抗体在芯片表面反应不同时间对应的相对响应值及标准差(n= 7)Table 2 Relative response values with standard deviations for the antibody on the chip surface at different reaction times (n= 7)
2.6SPR与ELISA对果汁检测方法比较

表3 SPR与ELISA检测果汁方法对比Table 3 Comparison of SPR biosensor and ELISA used for phosmet detection in juices
对3 种果汁中亚胺硫磷残留进行了SPR样品检测,并在样品前处理方法、添加回收实验、与HPLC对照实验相关系数、检测时间、抗体质量浓度等方面进行了系统比较。如表3所示,SPR和ELISA在样品前处理方面较仪器方法有着明显优势,且SPR在灵敏度和准确度均高于ELISA方法。SPR检测时间为30 min,并且同一固定化芯片可在3 d内重复检测30 次,大大节省了检测成本。ELISA方法能2~3 h检测几十个样品,由此可见SPR在单残留的检测中,其优势并不明显。为了更好地发挥SPR高质量、高通量快速现场检测的优势,今后应大力发展SPR在多残留检测中的应用。
3 结 论
SPR技术是近些年来在食品安全快速检测领域的发展的新技术,因其灵敏度高、前处理方法简单、自动化程度高、省时等特点,适合于大批量样品的现场检测。本实验在多克隆抗体的基础上,建立了果汁中亚胺硫磷SPR检测方法,样品最低检出限为0.1 μg/L,远低于国际限量标准,添加回收率在84.88%~104.69%,与HPLC方法的线性相关系数R2为0.992,为果汁中亚胺硫磷农药残留的快速检测提供了新的技术支持。
[1] 邹小南, 谭红, 钟英鹏, 等. 食品安全风险评估及其在农药残留上的应用[J]. 贵州农业科学, 2008, 36(3): 169-172.
[2] 冷饮夫, 唐振华, 王荫长. 杀虫剂分子毒理学及昆虫抗药性[M]. 北京: 中国农业出版社, 1996: 2.
[3] 陈万义. 农药生产与合成[M]. 北京: 化学工业出版社, 2000: 89-92.
[4] 杨东鹏, 张春荣, 董民. 用于检测蔬菜有机磷和氨基甲酸酯类农药残留的酶抑制分光光度法研究进展[J]. 中国农学通报, 2004, 20(2):37-40.
[5] 赵丽丽, 陈宁, 张克旭. 果蔬中常用有机磷农药快速检测方法的研究[J]. 食品科学, 2001, 22(6): 54-57.
[6] TOPUZ S G, ALPERTUNGA B. Simultaneous determination of various pesticides in fruit juices by HPLC-DAD[J]. Food Control,2005, 16(1): 87-92.
[7] LACASSIE E, DREYFUSS M F, DAGUET J L, et al. Liquid chromatography electrospray mass spectrometry multiresidue determination of pesticides in apples and pears[J]. Journal of Chromatography A, 1999, 830(1): 135-143.
[8] WANG Chun, WU Qiuhua, WU Chunxia. Determination of some organophosphorus pesticides in water and watermelon samples by microextraction prior to high-performance liquid chromatography[J]. Journal of Separation Science, 2011, 34(22): 3231-3239.
[9] 韩梅, 易盛国, 杨哓凤, 等. 蔬菜、水果中杀扑磷、伏杀硫磷、亚胺硫磷、蝇毒磷的气相色谱法测定[J]. 现代科学仪器, 2010, 5(1):99-102.
[10] 叶江雷, 弓振斌, 林芳, 等. 茶叶中水胺硫磷、亚胺硫磷、甲基对硫磷和伏杀硫磷农药残留的高效液相色谱法测定[J]. 厦门大学学报,2007, 5(3): 442-444.
[11] 上官良敏. 气相色谱-离子阱二级质谱测定茶叶中的亚胺硫磷、噻嗪酮和哒螨灵[J]. 分析测试技术与仪器, 2011, 17(2): 123-125.
[12] CUNHA S C, FEMANDES J O, BEATRIZ A, et al. Determination of phosmet and its metabolites in olives by matrix solid-phase dispersion and gas chromatography-mass spectrometry[J]. Talanta, 2007, 73(1):514-522.
[13] LIANG Ying, LIU Xianjin, LIU Yuan, et al. Synthesis of three haptens for the classs-pecific immunoassay of O,O-dimethyl organophosphorus pesticides and effect of hapten heterology on immunoassay sensitivity[J]. Analtica Chimica Acta, 2008, 5(2): 174-183.
[14] LIANG Ying, LIU Yuan, ZHU Jinfeng, et al. Production of broad specificity anti-methoxy organophosphorus pesticides antibody[J]. Chinese Journal of Analytical Chemistry, 2008, 5(5): 647-652.
[15] SONG Yang, GE Yu, ZHANG Yan, et al. Hapten synthesis and enzyme-linked immunosorbent assay for phosmet residues: assay optimization and investigation of matrix effects from different food samples[J]. Analytical and Bioanalytical Chemistry, 2009, 393(1):2001-2008.
[16] TANAKA H, YAN S Y, MIURA N, et al. Preparation of anti-2,4-dichlorophenol and 2,4-dichlorophenoxyacetic acid monoclonal antibodies[J]. Cytotechnology, 2003, 42(1): 101-107.
[17] MAURIZ E, CALLE A. Real-time detection of chlorpyrifos at part per trillion levels in ground, surface and drinking water samples by a portable surface plasmon resonance immunosensor[J]. Analytica Chimica Acta, 2006, 561: 40-47.
[18] MAURIZ E, CALLE A, MONTOYA A, et a1. Determination of environmental organic pollutans with a potable optical immunosensor[J]. Talanta, 2006, 7: 359-364.
[19] MICHAEL P. Recent applications of surface plasmon resonance biosensor[J]. Chemical Monthly, 2009, 140: 953-964.
[20] DONG Jianwei, GAO Na, PENG Yuan, et al. Surface plasmon resonance sensor for profenofos detection using molecularly imprinted thin fi lm as recognition element[J]. Food Control, 2012, 25: 543-549.
[21] LIU Ming, NING Baoan, QU Lijie, et al. Development of indirect competitive immunoassay for highly sensitive determination of ractopamine in pork liver samples based on surface plasmon resonance sensor[J]. Sensors and Actuators B, 2012, 161: 124-130.
[22] KIM S J, GOBI K V, TANAKA H, et al. A simple and versatile selfassembled monolayer based surface plasmon resonance immunosensor for highly sensitive detection of 2,4-D from natural water resources[J]. Sensors and Actuator, 2008, 130(1): 281-289.
[23] YU Q, CHEN S, TAYLOR A D, et al. Detection of low-molecularweight domoic acid using surface plasmon resonance sensor[J]. Sensors and Actuators B, 2005, 107(1): 193-201.
[24] HOMOLA J. Present and future of surface plasmon resonance biosensors[J]. Analytical and Bioanalytical Chemistry, 2003, 377(1):528-539.
[25] SONG Yang, LIU Ming, WANG Shuo. Surface plasmon resonance sensor for phosmet of agricultural products at the ppt detection level[J]. Journal of Agricultural and Food Chemistry, 2013, 61(1):2625-2630.
Surface Plasmon Resonance Detection of Phosmet Residues in Three Kinds of Juice
SONG Yang1, WANG Jing1, CHEN Xiaoming2,*
(1. Tianjin Key Laboratory of Animal and Plant Resistance, College of Life Science, Tianjin Normal University,Tianjin 300387, China; 2. Tianjin Institute of Forestry and Fruit Tree, Tianjin 300384, China)
In the present study, a polyclonal antibody-based method for the quantifi cation of phosmet residues in apple,peach and orange juice was presented using a surface plasmon resonance (SPR) sensor. Samples were directly diluted with PBS to eliminate the matrix effect. Good accuracy and precision were obtained with mean spiked recoveries between 84.88% and 104.69% and coeffi cients of variation less than 6.70%, and the limit of detection (LOD) of juice samples was 0.1 μg/L. The SPR method allowed rapid and accurate detection of phosmet and the correlation coeffi cient (R2) between the data obtained using the method and high-performance liquid chromatography (HPLC) was 0.992. The chip used in the SPR method detected phosmet in 30 min, and could be repeatedly used 30 times within 3 days, reducing the cost of tests. The SPR method was advantageous in the terms of detection limit, accuracy and sensitivity rather other time saving in single-residue analysis compared with the enzyme-linked immunosorbent assay (ELISA) and was more suitable for highthroughput detection of multi-residues.
juice; phosmet; surface plasmon resonance (SPR) sensor; enzyme-linked immunosorbent assay (ELISA)
R155
A
1002-6630(2015)18-0172-05
10.7506/spkx1002-6630-201518031
2014-12-25
国家自然科学基金青年科学基金项目(31301487);“十二五”国家科技支撑计划项目(2014BAD04B03);天津市自然科学基金项目(13JCQNJC14800)
宋洋(1983—),女,博士研究生,研究方向为食品安全与检测。E-mail:skysongy@mail.tjnu.edu.cn
陈晓明(1977—),男,助理研究员,博士,研究方向为食品营养与开发。E-mail:chxm001@126.com

