葛仙米多糖的单糖组成分析
莫开菊,赵 娜,朱照武,田盼盼,程 超
(1.湖北民族学院生物科学与技术学院,湖北 恩施 445000;2.生物资源保护与利用湖北省重点实验室,湖北 恩施 445000)
葛仙米多糖的单糖组成分析
莫开菊1,2,赵 娜1,朱照武1,田盼盼1,程 超1
(1.湖北民族学院生物科学与技术学院,湖北 恩施 445000;2.生物资源保护与利用湖北省重点实验室,湖北 恩施 445000)
采用1-苯基-3-甲基-5-吡唑啉酮柱前衍生高效液相色谱(high performance liquid chromatography,HPLC)法及HPLC-质谱联用法测定葛仙米多糖的单糖组成,两种方法测定结果相互吻合。同时采用HPLC法测定了相关单糖的标准曲线,相关系数达到0.995以上,经计算,葛仙米多糖的单糖组成物质的量比甘露糖∶葡萄糖醛酸∶葡萄糖∶半乳糖∶阿拉伯糖为1∶1.12∶3.24∶1.72∶1.21。
葛仙米多糖;单糖;柱前衍生;高效液相色谱;质谱
葛仙米(Nostoc sphaeroides Kützing)是蓝藻门念珠藻科的一种低等的单细胞蓝藻,古名天仙菜、天仙米,俗称水木耳[1],在世界上的分布稀少,我国的葛仙米主要分布在湖北省鹤峰县的走马坪[2]。有研究[3-4]表明,葛仙米不仅是含有多种人体必需氨基酸的高蛋白食品,还含有丰富的多糖类物质。科学研究已经证实,多糖类物质具有许多生物活性,包括抗肿瘤、激活免疫力、降血糖、抗病毒[5],近年来,我国对植物多糖尤其是具有中国特色的中草药多糖的药物活性展开了广泛研究[6],葛仙米中含量丰富的多糖具有极大的研究价值。多糖的活性与许多因素有关,特别是其空间结构,多糖的一级结构是空间结构的基础,而多糖的单糖组成又是一级结构的主要内容[7-8],因此,多糖的单糖组成是研究多糖的生物活性的基础。
由Honda等[9-11]发展和完善的1-苯基-3-甲基-5-吡唑啉酮(1-phenyl-3-methyl-5-pyrazolone,PMP)柱前衍生化高效液相色谱(high performance liquid chromatography,HPLC)法测定单糖含量的方法目前已被广泛应用于各种多糖的单糖组分研究[12-14],采用HPLC-质谱(mass spectrum,MS)联用法研究单糖组成还较少,但在其他方面的应用比较成熟,如游离氨基酸[15]、食品添加剂[16]、未知成分的鉴定[17-18]等。本研究选用PMP柱前衍生HPLC法研究葛仙米多糖的单糖组成,并采用HPLC-MS进行验证,以确定葛仙米多糖的单糖组分,为葛仙米多糖结构的研究提供参考依据。
1 材料与方法
1.1材料与试剂
葛仙米 湖北省鹤峰县走马镇。
D-甘露糖、D-半乳糖、L-鼠李糖、L-阿拉伯糖 德国Dr.Ehrenstorfer公司;D-葡萄糖、L-岩藻糖 美国Sigma公司;PMP、D-葡萄糖醛酸、D-半乳糖醛酸、磷酸氢二钾、磷酸二氢钾、氢氧化钠、盐酸、三氯甲烷(均为分析纯) 国药集团化学试剂有限公司;甲醇、乙腈(均为色谱纯) 美国Tedia公司;三氟乙酸(色谱纯)成都西亚化工股份有限公司。
1.2仪器与设备
P680 ALPG型HPLC仪(包括DAD-100检测器、TCC-100柱温箱和Chromeleon色谱工作站) 戴安中国有限公司;1290-G6224A型HPLC-MS联用仪(包括G4212-60008型紫外检测器) 美国安捷伦公司;MS1 Minishaker漩涡混合器 德国IKA公司;GZX-9140 MBE数显鼓风干燥箱 上海博迅实业有限公司医疗设备厂;KQ5200B型超声波清洗器 昆山市超声仪器公司;NBS-Ⅱ型氮吹仪 艾本森科学仪器有限公司。
1.3方法
1.3.1多糖的提取、分离与纯化
称取一定量的葛仙米清洗、脱色、粉碎、脱脂后,按料水比1∶90于90 ℃水浴锅中提取6 h,旋蒸浓缩,60%乙醇溶液沉淀,冷冻真空干燥。称取冻干葛仙米多糖,蒸馏水溶解,采用Sevag法脱蛋白,在用60%乙醇溶液沉淀,并再次冷冻干燥得到葛仙米多糖样品,备用。
1.3.2标准单糖的衍生化及标准曲线的绘制
分别配制浓度均为5 mmol/L的甘露糖、鼠李糖、葡萄糖醛酸、半乳糖醛酸、葡萄糖、半乳糖、阿拉伯糖及岩藻糖标准溶液;配制浓度分别为1、2、3、4、5 mmol/L的单糖混合标准液。分别取50 μL的单糖标准液及不同浓度梯度的混合标准溶液,各加50 μL 0.6 mol/L的NaOH溶液,置于5 mL的具塞试管中,漩涡混匀;再加100 μL 0.5 mol/L的PMP(0.435 5 g/5 mL)甲醇溶液,漩涡混匀,在70 ℃的烘箱中避光反应100 min,取出避光放置10 min冷却至室温,加100 μL 0.3 mol/L的HCl溶液中和,加水至2 mL,再加等体积的氯仿,漩涡混匀,静置,弃去氯仿相,如此萃取3 次。将水相用0.45 μm微孔膜过滤后供HPLC进行分析,作为定性定量的依据。
1.3.3样品的水解及衍生化
吸取100 μL质量分数为5 mg/mL的多糖样品溶液于5 mL的安瓿瓶中,加入100 μL浓度为4 mol/L的三氟乙酸(trifluoroacetic acid,TFA)溶液,充N2封管,在110 ℃的烘箱中水解4 h;冷却后将水解液转移至5 mL的离心管中,并用100 μL甲醇冲洗转移残余水解液,加200 μL甲醇后用N2吹干,如此重复加甲醇并用N2吹干3 次,去除TFA;加入50 μL超纯水溶解残渣,得水解样品。按1.3.2节方法衍生、中和、萃取,0.45 μm微孔膜过滤后,超声脱气,进行HPLC检测分析。衍生、中和、萃取后的样品稀释25 倍后过0.45 μm微孔膜过滤、超声脱气,再进行HPLC-MS分析。
1.3.4HPLC分析条件
Agilent ZORBAX Eclipse XDB-C18色谱柱(250 mm×4.6 mm,5 μm);流动相:A液:0.1 mol/L的pH 6.7磷酸钾盐缓冲液,B液:乙腈,梯度洗脱0~25 min,A-B体积比83.2∶16.8,25~36 min,A-B体积比80∶20;柱温:30 ℃;检测波长:250 nm;流速:1 mL/min;进样体积:20 μL。
1.3.5HPLC-MS分析条件
HPLC条件:DIKMA Endeavorsil C18色谱柱(100 mm×2.1 mm,1.8 μm);流动相:0.01 mol/L乙酸铵-乙腈溶液体积比82∶18;柱温:30 ℃;检测波长:250 nm;流速:0.2 mL/min;进样体积:2.5 μL。
MS条件:电喷雾离子源正离子模式(+),载气为氮气,流速10 L/min,温度350 ℃,雾化器压力30 psi,毛细管电压4 000 V,质谱扫描范围m/z 100~1 700。
2 结果与分析
2.1葛仙米多糖的HPLC分析
2.1.1单糖PMP衍生物的HPLC分离及标准曲线
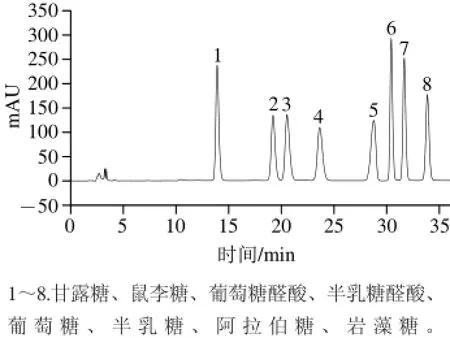
图1 8 种单糖的HPLC分离效果Fig.1 The separation of monosaccharide derivatives by HPLC
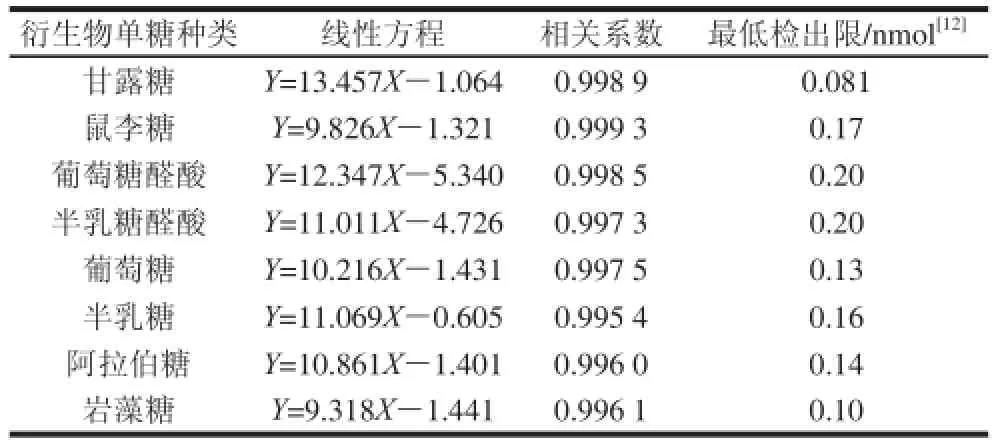
表1 标准曲线的线性方程与相关系数Table 1 Regression equations with correlation coeffi cients
8种单糖的PMP衍生物在HPLC中得到较好的分离,如图1所示,混合标准液中各单糖PMP衍生物的流出顺序及保留时间依次为甘露糖13.900 min、鼠李糖19.208 min、葡萄糖醛酸20.542 min、半乳糖醛酸23.633 min、葡萄糖28.775 min、半乳糖30.433 min、阿拉伯糖31.667 min和岩藻糖33.860 min。8 种单糖的浓度与峰面积的回归方程如表1所示,其相关系数为0.995 4~0.999 3。
2.1.2葛仙米多糖单糖组成的HPLC分析
5 mg/mL葛仙米多糖溶液水解、衍生后,在检测条件下进行HPLC分离定性。如图2所示,葛仙米多糖中单糖的保留时间与标准样品甘露糖、葡萄糖醛酸、葡萄糖、半乳糖、阿拉伯糖的保留时间十分吻合,初步说明葛仙米多糖由这5 种单糖组成。根据单糖的峰面积及标准曲线,计算得物质的量比为1∶1.12∶3.24∶1.72∶1.21。
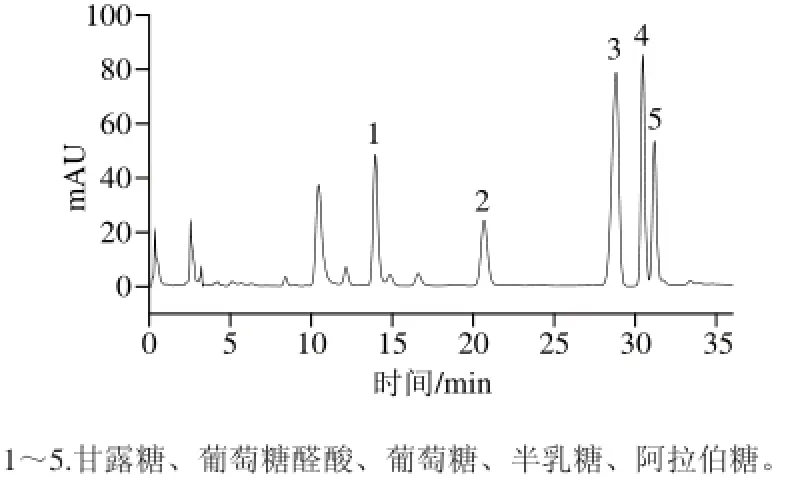
图2 葛仙米多糖水解样品衍生物的HPLC分离效果Fig.2 The separation of polysaccharide hydrolysate derivatives by HPLC
2.1.3方法的精密度
取混合单糖标准品的PMP衍生物,重复进样5 次,测试仪器的精密度,结果见表2,5 种单糖的相对标准偏差(relative standard deviation,RSD)均小于5%,说明仪器稳定性较良好。
取5 份葛仙米多糖溶液,分别水解、衍生后,在测定条件下进行HPLC分析,除葡萄糖醛酸衍生物外,组成葛仙米多糖的其余4 种单糖衍生物的峰面积RSD均小于5%,说明样品的处理测试方法可靠,见表2。

表2 方法精密度实验结果Table 2 Precision (relative standard deviation) of the HPLC method
2.2葛仙米多糖单糖组成的HPLC-MS分析
2.2.1单糖PMP衍生物的HPLC-MS分析
8 种单糖标准溶液和混合标准液进行PMP衍生后,利用HPLC-MS分析,结果表明8 种单糖衍生物能较好分离,混标的紫外吸收图谱及总离子流图如图3所示。
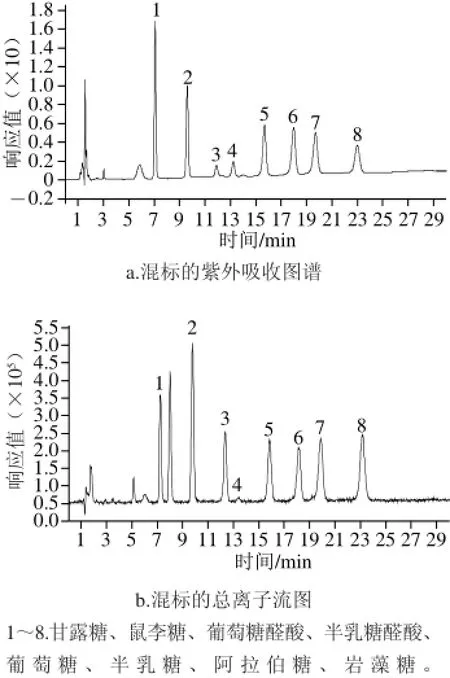
图3 8 种单糖衍生物的HPLC-MS分离效果图Fig.3 The separation of monosaccharide derivatives by HPLC-MS
如图3所示,混标中8 种单糖的PMP衍生物在HPLCMS中能很好的分离,流出顺序及保留时间依次为甘露糖7.073 min、鼠李糖9.607 min、葡萄糖醛酸11.900 min、半乳糖醛酸13.227 min、葡萄糖15.687 min、半乳糖17.933 min、阿拉伯糖19.707 min和岩藻糖23.000 min。
2.2.2葛仙米多糖单糖组成的HPLC-MS验证
葛仙米多糖水解衍生后,经HPLC-MS在检测条件下分析,样品的紫外及总离子流图如图4所示,葛仙米多糖中单糖的组成为甘露糖、葡萄糖醛酸、葡萄糖、半乳糖、阿拉伯糖,其质荷比及出峰时间与标准单糖十分吻合,如表3所示。
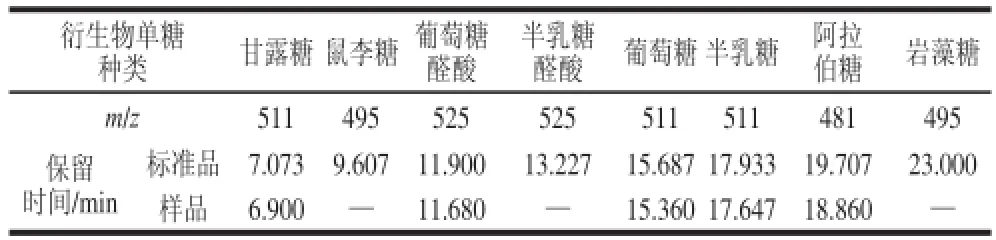
表3 葛仙米多糖水解液衍生物的HPLC-MS分析结果Table 3 The HPLC-MS results of polysaccharide hydrolysate derivatives
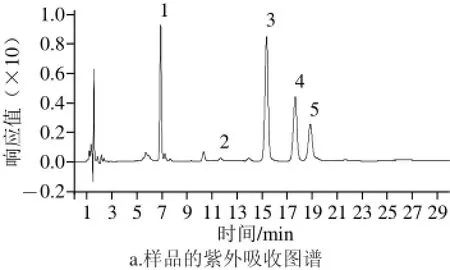
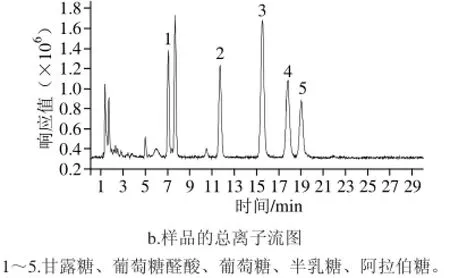
图4 葛仙米多糖水解液衍生物的HPLC-MS分离效果图Fig.4 The separation of polysaccharide hydrolysate derivatives by HPLC-MS
综合分析HPLC-MS的离子流图和紫外吸收图谱表明葛仙米多糖由甘露糖、葡萄糖、半乳糖和阿拉伯糖组成,与HPLC分析结果一致,验证了HPLC分析的准确性。
3 讨 论
本实验采用HPLC和HPLC-MS检测了葛仙米多糖的单糖组成,两种方法的结果互相验证,结果表明,葛仙米多糖由甘露糖、葡萄糖醛酸、葡萄糖、半乳糖和阿拉伯糖组成。同时还采HPLC法测定了相关单糖的标准曲线,经计算5 种单糖的物质的量比为1∶1.12∶3.24∶1.72∶1.21。
图2中HPLC的检测结果对照标准品图谱,在鼠李糖和半乳糖醛酸保留时间处有疑似色谱峰,经HPLC-MS验证,提取m/z 495的离子流图,在9.471 min处有明显离子流信号,但未发现紫外吸收。MS的检测灵敏度高于HPLC,对比鼠李糖标准品的紫外图谱及离子流图,峰高分别为1×101和2.9×105,而样品对应的离子流图中疑似鼠李糖处的峰高为7.2×103,若样品中含鼠李糖,按比例估算在紫外图谱中的峰高约0.25,较不明显,因此,样品可能含鼠李糖,其存在需进一步验证;提取m/z 525的离子流图,在13.227 min左右无离子流信号,样品中未检测到半乳糖醛酸。
图2样品HPLC的检测结果显示,在19.208、23.633 min疑似检出鼠李糖和半乳糖醛酸,在HPLCMS图谱中,其相应的保留时间分别在9.607 min和13.227 min。提取样品图谱相应时间点上的紫外和离子流图,在9.471 min发现m/z 495的明显离子流信号,但无紫外吸收,这可能是鼠李糖的含量低于紫外检测限,也可能是相同分子质量的其他无紫外吸收的物质;因此不能排除含有鼠李糖的可能性。但是HPLC法对鼠李糖的检出限为0.17 nmol,本实验所有浓度远高出检出限,却只出现了难以分辨的小峰,即使存在,其浓度也非常低。因此本研究不作报道。但是13.227 min的紫外检测图和m/z 525的离子流图,均未发现明显吸收峰。因此半乳糖醛酸未检出。
在实验中发现,同一样品放置过夜后再进行HPLC分析,峰面积减小。说明PMP单糖衍生物随时间推移可能降解,张萍等[19-20]曾提出过PMP衍生物稳定性不够的问题,徐瑾[21]对单糖PMP衍生物的稳定性进行了研究,发现24 h后,衍生物的峰面积均发生明显降低,而马定远等[22]的研究表明10.5 h后,甘露糖和鼠李糖衍生物的峰面积已经降低。因此样品衍生后应尽快测定,避免长时间存放。关于单糖PMP衍生物的降解规律将另文发表。
此外,图2中10.2 min处有明显出峰,但标准品图1谱中并没有,对比空白实验,此处为PMP峰,在萃取时未彻底除去,因此,有必要提高三氯甲烷萃取PMP的程度,而Castells等[23]曾指出在PMP萃取过程中伴随着单糖衍生物的损失。因此,使用PMP作为衍生剂时,需要平衡好PMP去除与样品损失的关系。
[1] 谭学儒. 葛仙米简介[J]. 中国食物与营养, 1985(5): 45.
[2] 朱玉婷, 谭姚, 莫开菊. 硫酸酯化修饰葛仙米多糖工艺研究[J]. 食品科学, 2011, 32(24): 46-49.
[3] 刘金龙. 葛仙米营养成分研究[J]. 中草药, 2000, 31(11): 862.
[4] 汪兴平, 程超. 野生葛仙米营养成分分析及评价[J]. 食品科学, 2002,23(8): 288-290.
[5] 田志环, 焦传珍. 葛仙米研究现状及其开发前景[J]. 食品研究与开发, 2007, 28(2): 170-172.
[6] 柳志宇. 玛咖多糖提取及其单糖组成的研究[D]. 北京: 北京林业大学, 2012.
[7] 王蓉, 吴剑波. 多糖生物活性的研究进展[J]. 国外医药: 抗生素分册,2001, 22(3): 97.
[8] 陈克克. 地瓜儿多糖的单糖组成实验中两种流动相的比较研究[J].陕西农业科学, 2009, 55(5): 41-45; 49.
[9] HONDA S, AKAO E, SU-UZKI S, et al. High-perfor mance liquid chromatography of reducing carbohydrates as strongly uitravioletabsorbing and electrochemically sensitive 1-phenyl-3-methyl-5-pyrazolone derivatives[J]. Analytical Biochemistry, 1989, 180: 351-357.
[10] HONDA S, TOGASHI K, TAGA A. Unusual separation of l-phenyl-3-mehtyl-5-pyrazolone derivatives of aldoses by capillary zone electrophoresis[J]. Journal of Chromatography A, 1997, 791: 307-311.
[11] HONDA S, SUUZKI S, TAGA A. Analysis of carbohydrates as l-phenyl-3-methyl-5-pyrazolone derivatives by capillary/microchip electrophoresis and capillary electrochromatography[J]. Journal of Pharmaceutical and Biomedical Analysis, 2003, 30: 1689-1714.
[12] 戴军, 朱松, 汤坚, 等. PMP柱前衍生高效液相色谱法分析杜氏盐藻多糖的单糖组成[J]. 分析测试学报, 2007, 26(2): 206-210.
[13] 郝蕾蕾, 张典瑞, 赵忠熙, 等. 柱前衍生化HPLC法测定黄河滩枣多糖的单糖组成[J]. 中国生化药物杂志, 2012, 33(6): 740-743.
[14] 范刚, 唐策, 李艳, 等. 柱前衍生HPLC分析黄连多糖的单糖组成[J].中国实验方剂学杂志, 2014(11): 74-78.
[15] 王一红, 冯家力, 潘振球, 等. 液相色谱-质谱/质谱联用技术分析18种游离氨基酸[J]. 中国卫生检验杂志, 2006, 16(2): 161-163; 239.
[16] 许秀敏, 吴西梅, 梁春穗, 等. 液相色谱-质谱联用检测食品中苯甲酸、山梨酸、糖精钠[J]. 中国卫生检验杂志, 2005, 15(9):1057-1059.
[17] 赵超群, 李樱红, 罗金文. 超高效液相色谱-串联质谱测定保健食品中添加的10 种化学药物[J]. 药物分析杂志, 2014(9): 1627-1633.
[18] STEPHAN B, MICHAEL O, CHRISTIAN D. Qualitative and quantitative analysis of carbonyl compounds in ambient air samples by use of an HPLC-MS method[J]. Analytical and Bioanalytical Chemistry, 2002, 3: 372; 622-629.
[19] 张萍, 王仲孚, 黄琳娟. 糖类物质的衍生化试剂: 氘代PMP和类似物的合成及其衍生化性能[J]. 合成化学, 2013, 21(3): 262-266; 293.
[20] 张萍. 1,3取代吡唑啉酮类试剂的合成及其用于糖类物质的衍生化和分析研究[D]. 西安: 西北大学, 2011.
[21] 徐瑾. 糖类物质的衍生化分离分析方法研究[D]. 南京: 南京理工大学, 2003.
[22] 马定远, 陈君, 李萍, 等. 柱前衍生化高效液相色谱法分析多糖中的单糖组成[J]. 分析化学, 2002, 30(6): 702-705.
[23] CASTELLS C B, ARIAS V C, CASTELLS R C. Precolumn derivatization of reducing carbohydrates with 4-(3-methyl-5-oxo-2-pyrazolin-1-yl)benzoic acid. Study of reaction, high-performance liquid chromatographic separation and quantitative performance of method[J]. Chromatographia, 2002, 56(3/4): 153-160.
Analysis of Monosaccharide Composition of Polysaccharide from Nostoc sphaeroides Kützing
MO Kaiju1,2, ZHAO Na1, ZHU Zhaowu1, TIAN Panpan1, CHENG Chao1
(1. School of Biological Science and Technology, Hubei University for Nationalities, Enshi 445000, China;2. Hubei Key Laboratory of Biological Resource Conservation and Utilization, Enshi 445000, China)
Two analytical methods, namely high performance liquid chromatography (HPLC) and HPLC-mass spectrometry(HPLC-MS) using precolumn derivatization with 1-phenyl-3-methyl-5-pyrazolone were established for analyzing the monosaccharide composition of polysaccharide from Nostoc sphaeroides Kützing. Consistent results were obtained using both methods. The standard curve developed using monosaccharide standards by HPLC exhibited a correlation coeffi cient of greater than 0.995. According to the standard curves, the polysaccharide in N. sphaeroides was composed of manose,glucuronic acid, glucose, galactose and arabinose at a molar ratio of 1:1.12:3.24:1.72:1.21.
Nostoc sphaeroides Kützing polysaccharide; monosaccharide; precolumn derivatization; HPLC; MS
TS201.2
A
1002-6630(2015)18-0089-04
10.7506/spkx1002-6630-201518016
2015-01-30
国家自然科学基金面上项目(31171670)
莫开菊(1965—),女,教授,博士,研究方向为食品加工及天然产物化学。E-mail:hbmymkj@163.com

