枇杷花总黄酮、总三萜的大孔树脂制备工艺
陈 晶,李 琪,黄春萍,张晓峰,徐 艳,丁 然,张 宏,3,*
(1.四川师范大学化学与材料科学学院,四川 成都 610068;2.四川师范大学生命科学学院,四川 成都 610101;3.四川师范大学植物资源应用与开发研究所,四川 成都 610101)
枇杷花总黄酮、总三萜的大孔树脂制备工艺
陈 晶1,李 琪2,黄春萍2,张晓峰2,徐 艳2,丁 然2,张 宏2,3,*
(1.四川师范大学化学与材料科学学院,四川 成都 610068;2.四川师范大学生命科学学院,四川 成都 610101;3.四川师范大学植物资源应用与开发研究所,四川 成都 610101)
以枇杷花中总黄酮、总三萜含量作为检测指标,考察D101、AB-8、聚酰胺3 种大孔树脂对枇杷花提取物中总黄酮、总三萜的分离性能,考察4 种不同干燥方法对枇杷花总黄酮、总三萜含量的影响。结果表明,大孔树脂AB-8作为最佳分离树脂,上样量2.1 mL、吸附时间4 h、洗脱速率2 BV/h、洗脱体积3 BV时,枇杷花洗脱液中总黄酮含量为74.82%,收率为76.56%,总三萜含量为15.57%,收率为46.48%;减压干燥作为最佳干燥方法,真空度0.07 MPa、温度45 ℃、干燥时间10 h时,纯化物中总黄酮含量为76.07%,收率为77.87%,总三萜含量为15.89%,收率为47.09%,含水量为4.07%。研究结果表明,此制备工艺可行,为枇杷花总黄酮、总三萜的开发利用提供理论依据。
枇杷花;总黄酮;总三萜;分离纯化;干燥
枇杷花作为我国的民间用药,已有多年历史。据相关资料记载,枇杷花性温和而不燥、驱寒化痰,有温肺、止咳、祛痰之功效,对感冒、咳嗽等疾病有着显著的疗效[1-3]。据文献[4-7]报道,枇杷花中的主要化学成分有黄酮类、三萜类、多酚类、有机酸以及挥发性成分等。由于其具有多种生物活性成分,可以用于治疗多种疾病,包括镇咳、抗炎、抗肿瘤、糖尿病等[8-12]。经研究[13-16]发现,枇杷花的止咳祛痰效果起显著作用的是黄酮类和三萜类化合物。
近年来,采用大孔树脂分离纯化总黄酮、总三萜的研究[17-21]越来越多。丁然等[22]考察了D-101、D-160、AB-8、NKA-9和聚酰胺5 种吸附树脂对枇杷花总黄酮的吸附与解吸附性能,筛选出性能较好的AB-8用于枇杷花提取物中总黄酮的分离纯化;杨晓艳等[23]通过研究发现AB-8大孔树脂适于分离纯化荚果蕨总三萜,在最优条件下总三萜回收率为86.27%,纯化倍数为2.88,但是少有同时分离纯化枇杷花中总黄酮、总三萜的研究。本实验筛选择了3 种常见的吸附树脂,并通过对洗脱溶剂、洗脱速率、吸附时间等因素的考察,确定了枇杷花总黄酮、总三萜的纯化工艺;考察了4 种干燥方法对枇杷花总黄酮、总三萜含量的影响,确定了最优干燥条件。本实验使用大孔树脂对枇杷花中总黄酮和总三萜两类化合物同时进行分离纯化,并对枇杷花分离纯化物进行干燥方法研究,为枇杷花的后期研究提供一定的理论依据。
1 材料与方法
1.1材料与试剂
枇杷花2010年10月采于四川攀枝花,经烘箱80 ℃烘干、粉碎后备用。
熊果酸标准品、芦丁标准品 中国药品生物制品检定所;D-101大孔吸附树脂(纯净级) 山东鲁抗立科药业有限公司;AB-8、聚酰胺树脂(纯净级) 沧州宝恩吸附材料科技有限公司;95%乙醇(食品级)、其余试剂(均为分析纯) 成都市科龙化工试剂厂。
1.2仪器与设备
UV-1700紫外-可见分光光度计 日本岛津公司;BP211D十万分之一天平 德国Sartoo-Rius公司;Ad Vantage冷冻干燥仪 美国Vir Tis公司;B-290喷雾干燥仪 瑞士Büchi公司。
1.3方法
1.3.1枇杷花提取物中总黄酮、总三萜含量的测定
1.3.1.1供试品溶液制备
精密称取枇杷花300 g,按照固液比1∶10加入50%乙醇溶液,在提取温度80 ℃、提取时间2 h的条件下,回流提取2次,抽滤,合并滤液,减压浓缩至一定量后定容于50 mL容量瓶中,加蒸馏水至刻度,摇匀即得。
1.3.1.2枇杷花提取物中总黄酮、总三萜标准曲线的绘制
精密称取芦丁对照品10.88 mg、熊果酸对照品11.19 mg,分别用50%乙醇溶液定容于50 mL容量瓶中,配制成质量浓度为217.6 mg/L和223.8 mg/L的对照品溶液。参考文献[24-25]绘制标准曲线,分别得芦丁线性方程:Y=0.011 72A-0.004 65,R2=0.999 9,线性范围为2.176~108.8 mg/L;熊果酸线性方程Y=0.011 37A-0.062 18,R2=0.999 9,线性范围为22.3~223.8 mg/L。其中Y代表质量浓度,A代表吸光度。
1.3.1.3样品测定
精密移取枇杷花提取液1.0 mL至50 mL容量瓶中,用50%乙醇溶液稀释至刻度,取1 mL稀释液按1.3.1.2节方法测定吸光度,根据线性方程计算总黄酮、总三萜的质量浓度。
1.3.1.4总黄酮和总三萜含量的计算
枇杷花提取液中总黄酮的含量(W1)为:

枇杷花提取液中总三萜的含量(W2)为:

枇杷花纯化物中总黄酮的含量(W1′)为:

枇杷花纯化物中总三萜的含量(W2′)为:

枇杷花纯化物中总黄酮的收率(S1)为:

枇杷花纯化物中总三萜的收率(S2)为:

式(1)~(6)中:Y1、Y2为枇杷花提取液的总黄酮、总三萜质量浓度/(mg/L),D1、D2为提取液体积/L;M为原材料质量/g;Y1′、Y2′为枇杷花纯化物的总黄酮、总三萜质量浓度/(mg/L),D1′、D2′为纯化液体积/L;M′为纯化物质量/g;m1、m2为枇杷花纯化物中总黄酮、总三萜的质量/g;m1′、m2′为用于分离纯化的枇杷花提取物中总黄酮、总三萜的质量/g。
1.3.2吸附树脂的预处理

表1 3 种大孔树脂的物理性能Table 1 Physical properties of three macroporous resins
取3 种型号的吸附树脂D-101、AB-8、聚酰胺(物理性能见表1),用95%乙醇溶液浸泡24 h后装柱,用蒸馏水冲洗树脂至流出液澄清且不再含有乙醇。依次以2 BV/h的速率用5%盐酸溶液、5%氢氧化钠溶液冲洗树脂,直至流出液呈中性后用95%乙醇溶液浸泡备用。
1.3.3大孔吸附树脂的筛选
将预处理好的D-101、AB-8、聚酰胺3 种吸附树脂分别装入柱体积为90 mL的玻璃层析柱。先用蒸馏水洗脱树脂直至流出液澄清,再准确移取1.7 mL枇杷花提取物溶液上样,依次用蒸馏水、95%乙醇溶液洗脱样品。按1.3.1节方法测定各洗脱片段中总黄酮、总三萜的含量并计算收率。
1.3.4洗脱溶剂对总黄酮、总三萜含量及收率的影响
准确移取1.7 mL枇杷花提取物溶液上样AB-8大孔树脂层析柱后,控制洗脱速率为2 BV/h(2 BV为2 倍柱体积),依次用蒸馏水、50%乙醇溶液、95%乙醇溶液洗脱样品,每个片段洗脱4 BV,分别收集3 个洗脱片段。各洗脱片段经减压浓缩后放入60 ℃烘箱干燥。按1.3.1节方法测定各洗脱片段中总黄酮、总三萜的含量并计算收率。
1.3.5枇杷花提取物中总黄酮、总三萜纯化工艺优化
1.3.5.1单因素试验
1)上样量对总黄酮、总三萜含量及收率的影响:准确移取枇杷花提取物溶液0.8、1.2、1.7、2.1、2.9、3.8 mL,分别上样AB-8大孔树脂层析柱,吸附4 h后,按1.3.4节方法进行洗脱,收集50%乙醇溶液洗脱片段,经减压浓缩后放入60 ℃烘箱内干燥。按1.3.1节方法测定50%洗脱片段中总黄酮、总三萜的含量并计算收率。2)洗脱速率对总黄酮、总三萜含量及收率的影响:准确移取枇杷花提取物溶液2.1 mL上样AB-8大孔树脂层析柱,吸附4 h后,控制洗脱速率分别为0.5、2、4 BV/h,按1.3.4节方法进行洗脱,后续操作同上。3)吸附时间对总黄酮、总三萜含量及收率的影响:准确移取枇杷花提取物溶液2.1 mL上样AB-8大孔树脂层析柱,分别吸附样品2、4、8、16、24 h后,按1.3.4节方法进行洗脱,后续操作同上。4)洗脱体积对总黄酮、总三萜含量及收率的影响:准确移取枇杷花提取物溶液2.1 mL上样AB-8大孔树脂层析柱,吸附4 h后,按1.3.4节方法进行洗脱,各片段分别洗脱2、3、4、5、6 BV,后续操作同上。
1.3.5.2正交试验
根据单因素试验结果,选取上样量、洗脱速率、吸附时间、洗脱体积4 个因素,每个因素考察3 个水平,进行L9(34)正交试验,以50%乙醇溶液洗脱片段中总黄酮收率作为评价标准。正交试验因素水平见表2。

表2 正交试验因素水平表Table 2 Factors and levels used in orthogonal array design
1.3.5.3最佳纯化工艺条件的验证实验
按1.3.5.2节所确定的最佳工艺条件进行验证实验(n=3)。按1.3.1节方法测定50%乙醇溶液洗脱片段中总黄酮、总三萜的含量并计算收率。
1.3.6枇杷花纯化物的干燥工艺
按1.3.5节所确定的纯化条件对枇杷花提取物进行分离纯化,收集50%乙醇溶液洗脱片段,减压浓缩至浸膏。精确量取浸膏50 mL作为一个待测样品。分别进行不同方式的干燥:常压干燥,温度设定为40、60、80 ℃;减压干燥,真空度设定为0.07 MPa,温度为45、55、65 ℃;冷冻干燥,升华温度设为30、40、50 ℃;喷雾干燥,进风温度为120、140、160、180 ℃,雾化器转速28 000 r/min,流量为0.9 mL/min。收集干粉,称质量。记录干燥至固体状态所需时间,按1.3.1节方法测定样品中总黄酮、总三萜的含量并计算收率。
2 结果与分析
2.1提取溶剂体积分数对枇杷花总黄酮、总三萜含量的影响
总黄酮、总三萜的极性有一定的差异,为了同时提取枇杷花中的总黄酮、总三萜,本实验考察了两种不同的提取方法,即50%乙醇溶液提取2 次和50%、95%乙醇溶液分别提取1 次。由表3可知,50%乙醇提取物中枇杷花总黄酮的含量明显较高,而总三萜的含量则略低于混合95%、50%乙醇溶液提取物。因此本实验选取50%乙醇溶液作为样品的提取溶剂。
表3 提取溶剂体积分数对枇杷花提取物中总黄酮、总三萜含量的影响Table 3 Effect of extraction solvents on the contents of flfl avonoids and triterpene

表3 提取溶剂体积分数对枇杷花提取物中总黄酮、总三萜含量的影响Table 3 Effect of extraction solvents on the contents of flfl avonoids and triterpene
提取溶剂50%乙醇溶液95%乙醇溶液和50%乙醇溶液总黄酮含量20.36±0.33516.76±0.344总三萜含量6.867±0.3017.403±0.340
2.23 种吸附树脂对枇杷花总黄酮、总三萜的纯化效果
表4 3 种树脂对总黄酮、总三萜的分离纯化效果Table 4 Effect of three resins on separation and purififi cation of flfl avonoids and triterpenoi
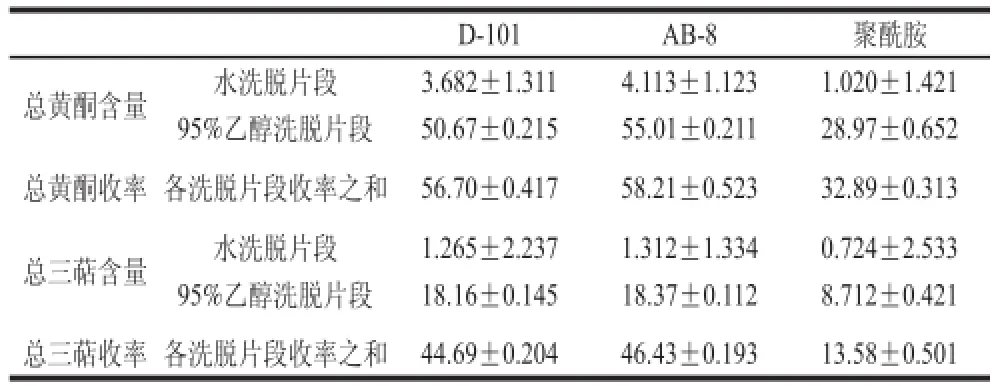
表4 3 种树脂对总黄酮、总三萜的分离纯化效果Table 4 Effect of three resins on separation and purififi cation of flfl avonoids and triterpenoi
D-101AB-8聚酰胺总黄酮含量水洗脱片段3.682±1.3114.113±1.1231.020±1.421 95%乙醇洗脱片段50.67±0.21555.01±0.21128.97±0.652总黄酮收率各洗脱片段收率之和56.70±0.41758.21±0.52332.89±0.313总三萜含量水洗脱片段1.265±2.2371.312±1.3340.724±2.533 95%乙醇洗脱片段18.16±0.14518.37±0.1128.712±0.421总三萜收率各洗脱片段收率之和44.69±0.20446.43±0.19313.58±0.501
由表4可知,3 种树脂分离纯化枇杷花总黄酮、总三萜的能力大小顺序为AB-8>D-101>聚酰胺。聚酰胺树脂由于极性较大,吸附性能强而解吸性能较弱,样品很难从树脂上洗脱下来。D-101大孔树脂在吸附及解吸性能上略低于AB-8大孔树脂,所以选择AB-8大孔树脂作为吸附材料。
2.3洗脱方法对枇杷花总黄酮、总三萜含量及收率的影响
5 各洗脱片段的总黄酮、总三萜含量及收率(x =3)Table 5 Contents and yields of flfl avonoids and triterpenes in the eluted fractions (x ± , = 3)
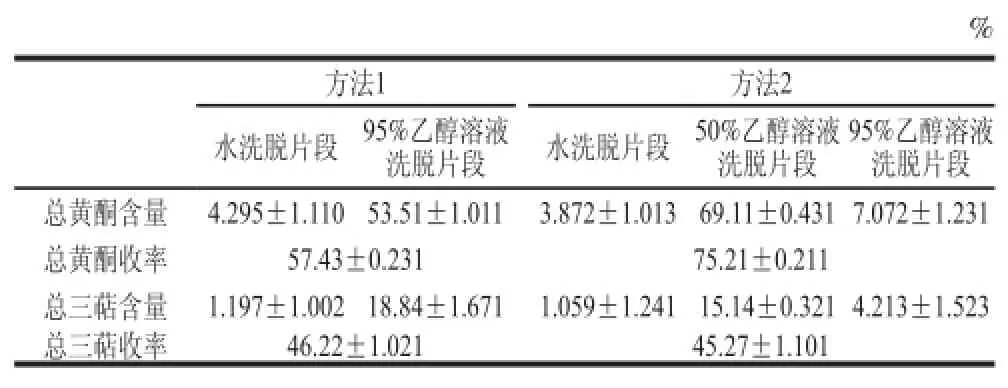
5 各洗脱片段的总黄酮、总三萜含量及收率(x =3)Table 5 Contents and yields of flfl avonoids and triterpenes in the eluted fractions (x ± , = 3)
%方法1方法2水洗脱片段95%乙醇溶液95%乙醇溶液洗脱片段总黄酮含量4.295±1.11053.51±1.0113.872±1.01369.11±0.431 7.072±1.231总黄酮收率57.43±0.23175.21±0.211总三萜含量1.197±1.002 18.84±1.6711.059±1.241 15.14±0.321 4.213±1.523总三萜收率46.22±1.02145.27±1.101洗脱片段水洗脱片段50%乙醇溶液洗脱片段
由表5可知,50%乙醇溶液洗脱片段的总黄酮含量及收率远高于方法1中95%乙醇洗脱片段,总三萜含量及收率则略低。考虑到总黄酮在枇杷花中的含量高于总三萜,50%乙醇溶液洗脱片段既能得到较高的总黄酮含量及收率,也能满足总三萜含量及收率的要求。因此选用洗脱方法2对枇杷花提取物进行纯化,洗脱片段分为水洗脱片段、50%乙醇溶液洗脱片段、95%乙醇洗脱片段。从表5可以看出,方法2中水洗脱片段、95%乙醇洗脱片段得到的总黄酮总三萜含量均较低,对收率的影响很小,因此用50%乙醇溶液洗脱片段中总黄酮、总三萜的含量及收率作为后续实验的评价标准。
2.4AB-8大孔树脂分离纯化枇杷花总黄酮、总三萜试验优化
2.4.1单因素试验结果
2.4.1.1上样量的选择
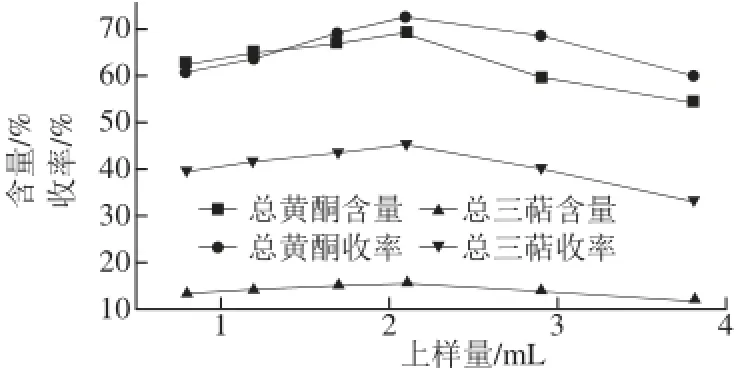
图1 上样量对总黄酮、总三萜含量和收率的影响Fig.1 Effect of sample volume on the contents of fl avonoids and triterpenes and their yields
由图1可以看出,上样量对枇杷花提取物中总黄酮、总三萜含量及收率有显著影响。随着上样量的增加,样品中总黄酮、总三萜的含量和收率也逐渐增加。当上样量为2.1 mL时,样品中总黄酮、总三萜的含量及收率都达到最大值。当上样量继续增加时,样品的纯度及收率都大大降低,开始出现泄漏趋势。2.1 mL是树脂的最大承载量,因此初步选择2.1 mL为最佳上样量。
2.4.1.2洗脱速率的选择
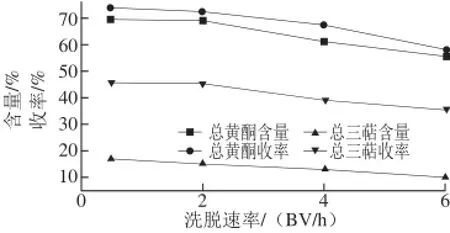
图2 洗脱速率对总黄酮、总三萜含量及收率的影响Fig.2 Effect of elution fl ow rate on the contents of fl avonoids and triterpenes and their yields
如图2所示,当洗脱速率为0.5 BV/h时,总黄酮、总三萜含量及收率均略高于洗脱速率2 BV/h,但是2 BV/h的洗脱速率可以减少洗脱时间,提高洗脱效率。因此选择洗脱速率为2 BV/h。
2.4.1.3吸附时间的选择

图3 吸附时间对总黄酮、总三萜含量及收率的影响Fig.3 Effect of adsorption time on the contents of fl avonoids and triterpenes and their yields
由图3可以看出,总黄酮、总三萜含量及收率先随着吸附时间的延长而增加,当吸附时间达到4 h时,树脂达到饱和状态,含量及收率达到最大值。随着吸附时间的延长,总黄酮、总三萜含量及收率几乎不再变化。因此选择吸附时间为4 h。
2.4.1.4洗脱体积的选择

图4 洗脱体积对总黄酮、总三萜含量及收率的影响Fig.4 Effect of elution volume on the contents of fl avonoids and triterpenes and their yields
由图4可以看出,总黄酮及总三萜的含量及收率随着洗脱体积的增加而增加。当洗脱体积达到3、4 BV时,总黄酮、总三萜含量及收率均较高。随着洗脱体积的增加,总黄酮、总三萜含量及收率呈下降趋势,这是因为洗脱下来的杂质的含量增加导致的。当洗脱体积为3 BV和4 BV时,总黄酮、总三萜含量及收率几乎相同,考虑到减少洗脱剂用量,减少成本,故选择洗脱体积为3 BV。根据单因素试验结果可知:影响AB-8大孔树脂分离纯化性能的因素有上样量、洗脱速率、吸附时间和洗脱体积;且根据纯化后总黄酮和总三萜含量及收率的变化,初步认为各因素对总黄酮、总三萜含量及收率的影响为:上样量>洗脱速率>洗脱体积>吸附时间。
2.4.2正交试验结果
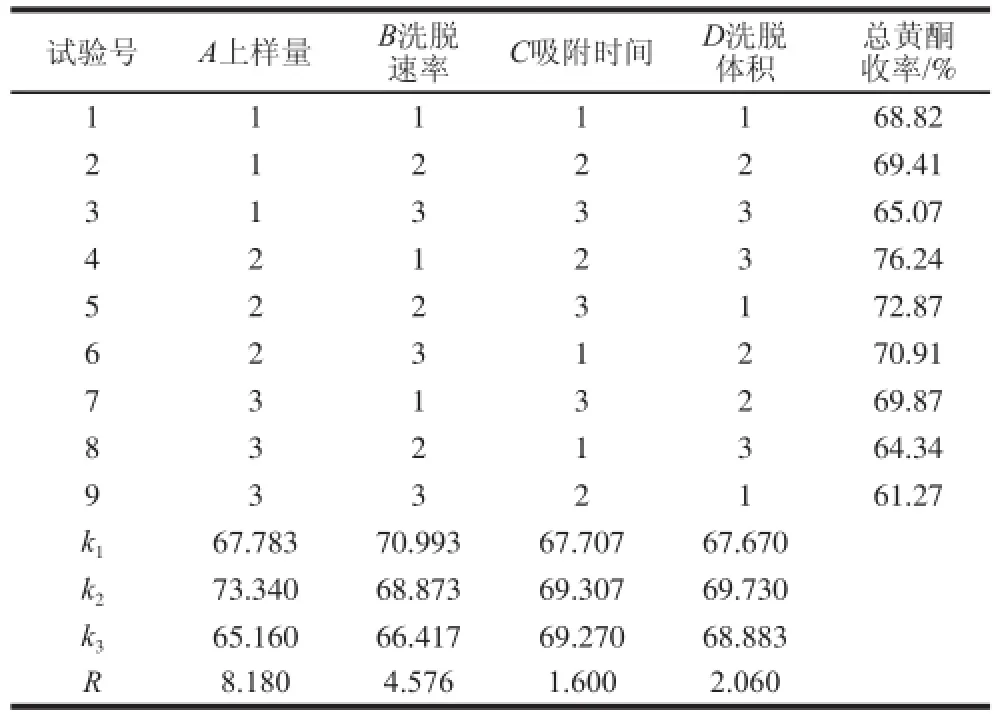
表6 正交试验设计与结果Table 6 Results of orthogonal array design
由表6可知,各因素对枇杷花提取物总黄酮收率影响的大小为:上样量>洗脱速率>洗脱体积>吸附时间,其中上样量对总黄酮收率的影响最大,吸附时间对总黄酮收率的影响最小。在试验范围内,最佳优选工艺组合是A2B1C2D2,即上样量2.1 mL、洗脱速率0.5 BV/h、吸附时间4 h、洗脱体积3 BV。根据正交试验数据分析,洗脱速率为0.5 BV/h和2 BV/h时,总黄酮收率相近,而0.5 BV/h的洗脱速率较慢,影响工作效率,不适宜工业化生产。故最终选择工艺组合是A2B2C2D2。正交试验方差分析结果见表7。
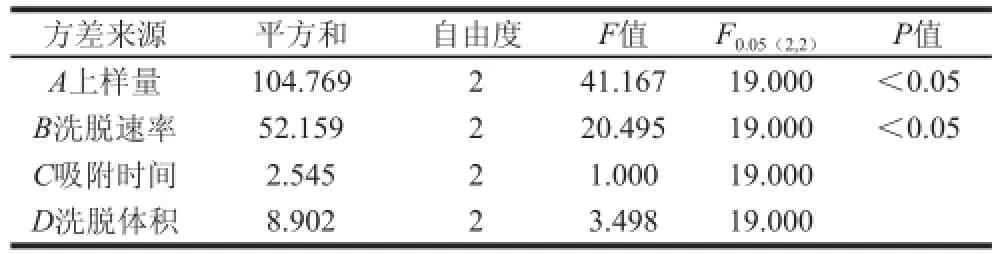
表7 正交试验方差分析结果Table 7 Analysis of variance for the orthogonal array design
2.4.3树脂最佳工艺条件验证实验
按1.3.5.2节所确定的最佳工艺条件进行验证实验(n=3),测得枇杷花提取物的50%乙醇溶液洗脱片段中总黄酮的含量为74.82%,收率为76.56%,总三萜的含量为15.57%,收率为46.48%,其总黄酮和总三萜的含量和收率均较高。结果表明,正交试验所得工艺条件最优。
2.5枇杷花纯化物干燥工艺
2.5.1常压干燥温度的选择

表8 常压干燥温度对总黄酮、总三萜含量及收率的影响Table 8 Effect of atmospheric drying temperature on the contents of fl avonoids and triterpenes and their yields
由表8可知,当烘箱温度为40 ℃和60 ℃时,总黄酮、总三萜含量和收率相近,当温度为80℃时,总黄酮、总三萜的含量明显降低,这是因为温度过高,样品的有效成分遭到部分破坏。40 ℃时的含量和收率略低于60 ℃,干燥耗时较长。从干燥后样品的含水量来看,当干燥温度为60、80 ℃时,含水量相近且比温度为40 ℃时较低。综合有效物质的含量及收率、干燥耗时及含水量,选择60 ℃作为常压干燥的最佳温度。
2.5.2减压干燥条件的选择
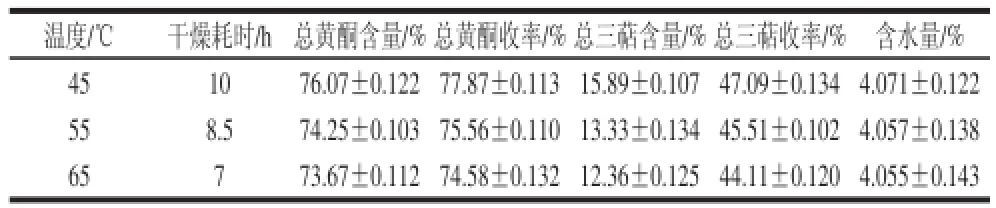
表9 减压干燥温度总黄酮、总三萜含量及收率的影响Table 9 Effect of vacuum drying temperature on the contents and yields of fl avonoids and triterpenes
由表9可以看出,在不同干燥温度条件下,样品干燥后含水量相当。当干燥温度为45 ℃时,枇杷花总黄酮、总三萜含量、收率均较高。因此选择干燥温度为45 ℃。
2.5.3冷冻干燥条件的选择

表10 真空冷冻干燥升华温度总黄酮、总三萜含量及收率的影响Table 10 Effect of sublimation temperature of freeze-drying on the contents of fl avonoids and triterpenes and their yields
由表10可以看出,当升华温度为30、40 ℃时,枇杷花总黄酮和总三萜含量、收率及干燥后样品的含水量均相当,但用40 ℃进行干燥时,可以缩短干燥时间;当温度升高至50 ℃时,对缩短冻干时间没有实质性影响,反而降低了总黄酮和总三萜的含量和收率。因此实验确定升华温度为40 ℃。
2.5.4喷雾干燥条件的选择喷雾干燥耗时均约为1 h,由表11可以看出,干燥后样品的含水量随进风温度的增加而降低,但下降趋势随进风温度升高而减弱。当进风温度低于140 ℃时,有部分样品在喷雾塔内壁附着,所得样品含水量比较大。当进风温度超过180 ℃时,样品含水量虽然较小,但却造成枇杷花止咳有效成分的损失,因此进风温度不宜太高。确定进风温度为160 ℃,出风温度为80 ℃时,产品质量较高。
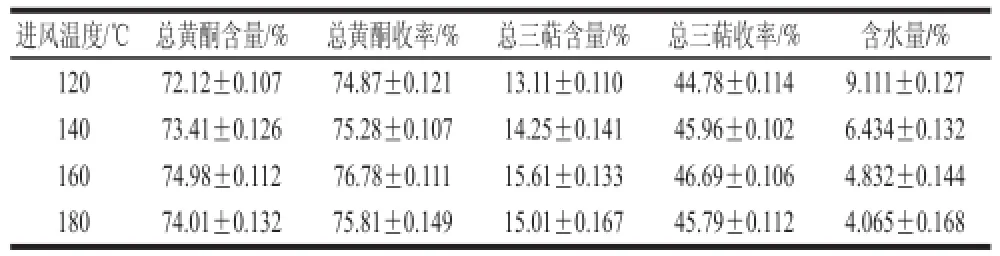
表11 喷雾干燥进风温度对总黄酮、总三萜含量及收率的影响Table 11 Effect of inlet temperature of spray drying on the contents of fl avonoids and triterpenes and their yields
2.5.54 种干燥方法的综合比较
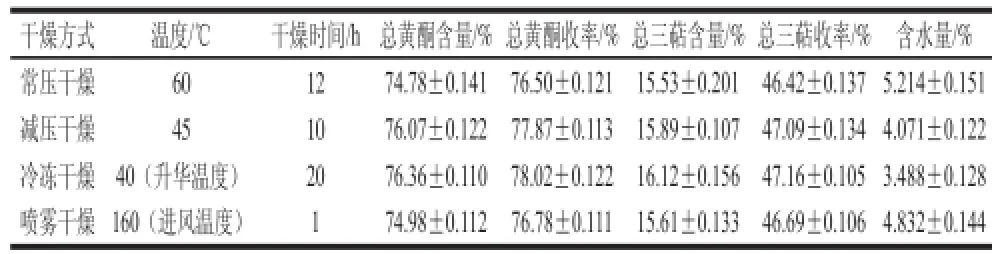
表12 干燥方法对总黄酮、总三萜含量及收率的影响Table 12 Effect of different drying methods on the contents of fl avonoids and triterpenes and their yields
为比较4 种干燥方法的优劣,各取其最佳条件来进行比较,结果见表12。根据样品中总黄酮、总三萜含量、收率以及样品含水量来比较4 种干燥方法的干燥效果,冷冻干燥的效果最好,减压干燥次之。喷雾干燥的效果较常压干燥要好。冷冻干燥时由于低温条件下各种化学反应的速率低,样品有效成分也不易遭到破坏。就干燥耗时而言,喷雾干燥耗时最短。减压干燥使水的沸点降低,传热温差增大,传热效率提高,达到相同干燥程度时,减压干燥比常压干燥所需时间少。冷冻干燥过程较其他几种干燥方法复杂,所需干燥时间最长。经冷冻干燥后样品中有效成分的品质最好,但该法需要的干燥条件较为苛刻,且设备昂贵,周期长,成本高。考虑到后续实验,选择减压干燥作为干燥枇杷花总黄酮、总三萜的方法。
3 结 论
本实验对枇杷花中有效成分的制备工艺进行了研究,实验结果表明,AB-8大孔树脂比较适合于枇杷花中有效成分的分离纯化,纯化工艺参数为上样量2.1 mL、洗脱速率2 BV/h、吸附时间4 h、洗脱体积3 BV,在此条件下得到的总黄酮含量为74.82%,收率为76.56%,总三萜含量为15.57%,收率为46.48%;减压干燥适用于干燥枇杷花中总黄酮、总三萜,干燥条件为真空度0.07 MPa、温度45 ℃、干燥耗时10 h,所得样品总黄酮含量为76.07%,收率为77.87%,总三萜含量为15.89%,收率为47.09%,含水量为4.07%。
[1] 国家中医药管理局《中华本草》编委会. 中华本草[M]. 4版. 上海:上海科学技术出版社, 1999: 145.
[2] 江纪武, 靳朝东. 药用植物辞典[M]. 天津: 天津科学技术出版社,2005: 31.
[3] 李时珍. 本草纲目[M]. 北京: 宗教文化出版社, 2003: 332.
[4] 孙苏邈, 孟宪丽, 李春雨, 等. 枇杷花的研究进展及其药效评价思路的探讨[J]. 现代药物与临床, 2011, 26(3): 199-201.
[5] 李琪. 枇杷花化学成分及生物活性的研究[D]. 成都: 四川师范大学, 2009.
[6] 闫永芳, 孙钧, 孟天真, 等. 枇杷花研究及开发进展[J]. 食品工业科技, 2011, 12(32): 545-546.
[7] 蒋际谋, 胡文舜, 姜帆, 等. 贵妃枇杷花提取液挥发性成分GC-MS分析[J]. 福建农业学报, 2013, 28(6): 545-551.
[8] 张娜, 吴绍康, 沈先荣, 等. 枇杷叶水提物祛痰止咳及抗炎作用研究[J].中华中医药学刊, 2014, 32(9): 2175-2177.
[9] 陈晓芳, 张倩, 吴文倩, 等. 枇杷花醇提物止咳化痰作用实验研究[J].中成药, 2013, 35(1): 167-169.
[10] AQUILA S, GINER R M, RECIO M C, et al. Anti-in-flammatory activity of flavonoids from Cayaponia tayuya roots[J]. Journal of Ethnopharmacology, 2009, 121: 333-337.
[11] MOTABAR O, SHI Z D, GOLDIN E, et al. A new resorufin-based α-glucosidase assay for high-throughput screening[J]. Analytical Biochemistry, 2009, 390: 79-84.
[12] MUSLIN E H, KANIKULA A M, CLARK S E, et al. Overexpression,purification and characterization of a barley α-glucosidase secreted by Pichia pastoris[J]. Protein Expression and Purifi cation, 2000, 18: 20-26.
[13] 王静波, 杨必坤, 张宏, 等. 枇杷花提取物止咳药效研究[J]. 中草药,2009, 40(7): 1106-1109.
[14] 鞠建华, 周亮, 林耕, 等. 枇杷叶中三萜酸类成分及其抗炎、镇咳活性研究[J]. 中国药学杂志, 2003, 38(10): 752-757.
[15] 王静波. 枇杷花止咳抗炎药效学研究[D]. 成都: 四川师范大学, 2009.
[16] 麦合苏木·艾克木, 努尔江·肉孜, 阿不都热依木·玉苏甫. 维药神香草总黄酮抗炎、止咳、祛痰及平喘作用研究[J]. 新疆医科大学学报, 2014, 37(4): 403-406.
[17] 吴绍康, 沈先荣, 梅威威, 等. 大孔吸附树脂分离纯化枇杷花总黄酮工艺研究[J]. 中华中医药学刊, 2014, 32(9): 2185-2188.
[18] 董媛媛, 邓翀, 柴思佳. 大孔树脂吸附南五味子总三萜的动力学和热力学分析[J]. 中国实验方剂学杂志, 2014, 20(17): 5-9.
[19] 骆党委, 叶静, 黄雅燕, 等. AB-8大孔树脂精制芦柑皮总黄酮及黄酮类化合物的分离[J]. 食品科学, 2014, 35(6): 30-35. doi: 10.7506/ spkx1002-6630-201406006.
[20] 孙京沙, 张朝辉. 大叶藻总黄酮的大孔树脂纯化工艺[J]. 食品科学,2014, 35(14): 5-10. doi: 10.7506/spkx1002-6630-201414002.
[21] 尹忠平, 上官新晨, 张月红, 等. 大孔树脂吸附纯化青钱柳叶三萜化合物[J]. 食品科学, 2011, 32(6): 61-65.
[22] 丁然, 黎霞, 李琪, 等. 吸附树脂分离纯化枇杷花总黄酮的研究[J].离子交换与吸附, 2014, 30(6): 560-568.
[23] 杨晓艳, 马骥, 彭飞, 等. 大孔树脂法分离纯化荚果蕨总三萜[J]. 食品工业科技, 2015, 36(2): 238-142.
[24] 李琪, 杨必坤, 张晓喻, 等. 枇杷花主要有效成分的含量[J]. 广西植物, 2009, 29(5): 698-702.
[25] 郭辉, 王玉珍, 崔福顺. 响应面法优化元蘑总三萜提取及大孔树脂纯化工艺研究[J]. 食品工业, 2014, 35(5): 137-140.
Preparation of Flavonoids and Triterpenoids from Flowers of Eriobotrya japonica (Thunb.) Lindl by Macroporous Resins
CHEN Jing1, LI Qi2, HUANG Chunping2, ZHANG Xiaofeng2, XU Yan2, DING Ran2, ZHANG Hong2,3,*
(1. College of Chemistry and Materials Science, Sichuan Normal University, Chengdu 610068, China;2. College of Life Sciences, Sichuan Normal University, Chengdu 610101, China;
3. Institute of Application and Development of Plant Resources, Sichuan Normal University, Chengdu 610101, China)
The total fl avonoids and triterpenoids of loquat fl ower extracts were purifi ed with D101, AB-8 and polyamide resins and dried by atmospheric drying, vacuum drying, freeze drying and spray drying, respectively. The effectiveness of these methods was tested based on the content and yield of total fl avonoids and triterpenoids. The results showed that AB-8 was the best macroporous resin for the separation and purifi cation of fl avonoids and triterpenoids, and vacuum drying was the best drying method. The optimal conditions for purifi cation were determined as follows: sample volume, 2.1 mL;elution fl ow rate, 2 BV/h; adsorption time, 4 h; and eluent volume, 3 BV. Under these conditions, the content and yield of fl avonoids were 74.82% and 76.56% and the content and yield of triterpenoids were 15.57% and 46.48%, respectively. The optimal conditions for vacuum drying were obtained by 10 h drying at 45 ℃ with a vacuum degree of 0.07 MPa. Under the optimized drying conditions, fl avonoids content was 76.07% with a yield of 77.87%, triterpenoids content was 15.89% with a yield of 47.09% and moisture content was 4.07%.
loquat fl owers; fl avonoids; triterpenoids; separation and purifi cation; drying
R284.2
A
1002-6630(2015)18-0058-06
10.7506/spkx1002-6630-201518010
2015-01-29
四川省科技厅第三批应用技术研究与开发项目(2009SZ005)
陈晶(1990—),女,硕士研究生,研究方向为食品分析检测。E-mail:jingchen2015@sina.cn
张宏(1965—),女,教授,博士,研究方向为天然产物开发与应用。E-mail:zhanghong651@aliyun.com

