CT在儿童外周性原始神经外胚层肿瘤诊断中的应用
曲 媛,梁星池,周 新,张可仞,王维林,贾慧敏
(中国医科大学附属盛京医院小儿外科,辽宁 沈阳 110004)
CT在儿童外周性原始神经外胚层肿瘤诊断中的应用
曲媛,梁星池,周新,张可仞,王维林,贾慧敏
(中国医科大学附属盛京医院小儿外科,辽宁 沈阳110004)
目的:分析儿童外周性原始神经外胚层肿瘤(Peripheral primitive neuroectodermal tumor,pPNET)的CT表现,结合临床病理特征,以提高对该病的认识及临床诊断方法。方法:回顾性分析经病理证实的6例儿童(男∶女=2:4)pPNET的CT表现,6例均行CT平扫,其中4例又行增强检查。结果:6例pPNET均为软组织肿物,2例位于胸壁,2例位于腹膜后,1例位于手掌背侧,1例位于骨盆。软组织pPNET多表现为较大的、边界不清的软组织肿物,伴或不伴邻近的骨质破坏。肿物内密度不均匀,伴有囊变、坏死及分隔,增强后多呈不均匀强化。6例患儿均行手术治疗,术中完整切除肿物,术后病理回报均考虑pPNET。结论:pPNET目前仍为少见病例,影像学表现缺乏特异性,确诊需要依靠病理组织检查及免疫组化,但CT检查在显示肿瘤的位置、大小、来源、血供情况以及邻近组织有否受累等具有较明确的提示。在儿童中,当CT检查提示巨大的、界限不清的软组织肿物包含囊变、坏死及分隔时,应高度怀疑pPNET。HE染色镜下可见Homer-Wright菊形团结构,免疫组化染色肿瘤均表达CD99,更能进一步提示pPNET。
神经外胚瘤,原始,外周;体层摄影术,螺旋计算机
原始神经外胚层肿瘤 (Primitive neuroectodermal tumor,PNET)是一类向原始神经方向分化的小圆细胞恶性肿瘤,由Jaffe于1984年首次报道,1993年WHO正式将其命名[1]。根据发生部位不同分为中枢性原始神经外胚层肿瘤和外周性原始神经外胚层肿瘤(Peripheral primitive neuroectodemal tumor,pPNET)。
pPNET是指发生于颅外骨骼系统及软组织的一组具有类似细胞学形态和细胞基因学特征的肿瘤,好发于儿童和青少年,易复发,预后较差[2]。近年来对于pPNET的病例报告数量逐渐增加,但有关此类疾病的CT表现与临床诊断的关系报道较少。我们回顾性分析有完整影像学资料以及经术后组织病理和免疫组化证实的pPNET的儿童患者6例,通过CT表现以及临床病理特征,结合文献学习,以期提高对该病的认识及临床诊断方法。
1 资料与方法
1.1临床资料
2009—2014年中国医科大学附属盛京医院收治的经术后组织病理和免疫组化证实为pPNET的儿童患者6例,男2例,女4例,年龄8~12岁,平均9.5岁。主要临床表现为迅速生长的肿物引起的压迫症状:如胸壁肿物压迫肺组织引起咳嗽咳痰;腹部肿物压迫腹腔脏器引起腹痛、恶心呕吐;手部及骨盆肿物侵蚀周围骨质引起疼痛以及运动障碍等。其中1例骨盆肿物患儿伴有发热,余患儿不伴有发热。实验室检查无明显特异性。
1.2影像学检查
6例患者术前均行CT检查,其中4例又行增强检查。CT检查采用Siemens Somatom Sensations 64排螺旋CT扫描仪。扫描层厚5 mm,层间隔5 mm,电流250 mAs,电压120 kV。增强扫描前经肘前静脉团推注对比剂欧乃派克,注射剂量为1.5 mL/kg,注射速率为3mL/s。
1.3病理组织学检查
6例患者均行手术切除肿物,切除的肿物制备病理切片后分别行HE染色和CD99、波形蛋白(Vimentin)、突触素(Synaptophysin,Syn)、神经特异性烯醇(Neuron-specificenolase,NSE)、SMA、Desmin、LCA、MyoD1等免疫组织化学染色。
2 结果
2.1发病部位
肿物2例位于胸壁(图1);2例位于腹膜后(图2,3);1例位于手掌背侧以及1例位于骨盆(图4)。
2.2CT表现
本组病例病变均表现为软组织肿物,肿物直径为30~144 mm。同时显示骨质破坏和软组织肿物的4例,仅表现为软组织肿物的2例。
CT特点为:较大、边界不清的软组织肿物,CT平扫示等或低密度,肿物内密度不均匀,伴有囊变、坏死及分隔,CT平均值为40 HU(图5a)。其中4例伴有邻近的骨质破坏,CT平均值为31 HU(图5b),增强后多呈不均匀强化。仅1例胸壁肿物边缘可见钙化小结节影,CT平均值为34 HU(图5c),余病变不伴有钙化。

图1 胸壁pPNET。胸部CT平扫加增强:左肺上叶胸膜下可见不规则分叶状混杂密度团块影,广基底,与胸膜粘连,病灶最大截面约56 mm×36 mm。病灶边缘见钙化小结节影。增强扫描可见病灶明显不均匀强化。左侧第二肋靠近病变处骨皮质增厚、硬化,局部骨质膨胀改变。Figure 1. pPNET in the chest wall.CT image shows a 56 mm×36 mm irregular lobulated space-occupying lesion of mixed-density in the superior lobe of left lung,which has a broad base and adhesion with pleura.Calcification can be seen on the edge of the lesion.The mass is irregularly enhanced on enhanced CT scan.Bony invasion can be seen on the left side of the second rib.
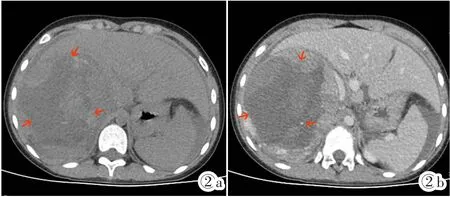
图2a,2b 女,9岁,右上腹腹膜后pPNET。肝脏CT平扫加增强:右上腹见一巨大肿块,大小约107 mm×122 mm×144 mm,以囊实混杂成分为主,其内夹杂不规则条片状高密度影,增强扫描实性成分明显强化,囊性成分未见强化。Figure 2a,2b.Female,9 years old.pPNET in the retroperitoneum (liver).CT image shows a 107 mm×122 mm×144 mm huge heterogeneous cystic-solid mass in the right upper abdomen,with irregular high-density patches in it.The solid part inside the mass is obviously enhanced.
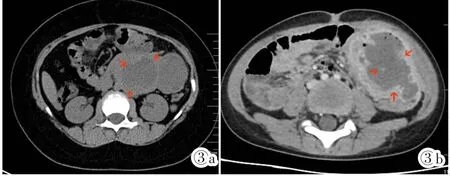
图3a,3b 女,8岁。左中腹腹膜后pPNET。腹部CT平扫加增强:左中腹部见一巨大囊实混合密度影,大小约113 mm×61 mm,边缘较清楚,其内可见点状高密度影。增强扫描见病灶明显不均匀强化。Figure 3a,3b. pPNET in the retroperitoneum(abdomen).CT image shows a 113 mm×61 mm huge heterogeneous cystic-solid mass in the left abdomen,with dot-like high-density lesions in it.The mass is irregularly enhanced.
2.3大体病理及免疫组化
肿瘤组织大体切面呈黄白或粉白色,质软(坐骨及掌背侧肿物质韧),呈鱼肉状,部分区域有出血坏死,部分病例可见包膜。HE染色后,镜下可见瘤细胞呈小圆形,弥漫分布或呈巢片状,细胞核圆,胞浆稀少,核分裂易见。细胞界限不清,部分瘤组织内形成Homer-Wright菊形团结构(图6),其中心为伊红染色的浆液或纤细的纤维丝。免疫组化染色显示,肿瘤均表达CD99,3例检测Syn结果呈阳性,3例检测NSE结果呈阳性,1例检测Vimentin结果呈阳性,6例LCA结果均为阴性(表1)。

图4 骨盆pPNET。骨盆CT平扫:右侧髋臼、耻骨、坐骨多发骨质破坏,周围可见巨大软组织肿块影,病灶大小约79 mm×75 mm,周围边界模糊。病灶压迫右侧肛提肌。Figure 4. pPNET in the pelvis.CT image shows a 79 mm×75 mm ill-defined soft tissue mass with bone destruction in the right acetabulum,pubis and ischia.The left levator ani muscle is compressed by the mass.
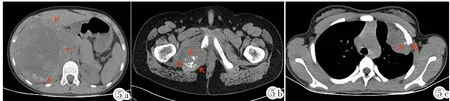
图5 CT特点。图5a:右上腹较大、边界不清的软组织肿物,CT平扫示等或低密度,肿物内密度不均匀,伴有囊变、坏死及分隔。图5b:骨质破坏,周围可见巨大软组织肿块影。图5c:胸壁肿物边缘可见钙化小结节影,肋骨可见骨质破坏。Figure 5. CT imaging characteristics.Figure 5a:CT image shows a huge soft tissue mass with ill-defined border in the right upper abdomen,which has inhomogeneous density with cystic degeneration,necrosis and internal separations.Figure 5b:CT image shows a huge soft tissue mass with bony invasion.Figure 5c:Calcification can be seen on the edge of the mass.Bony invasion can be seen on the left side of the second rib.
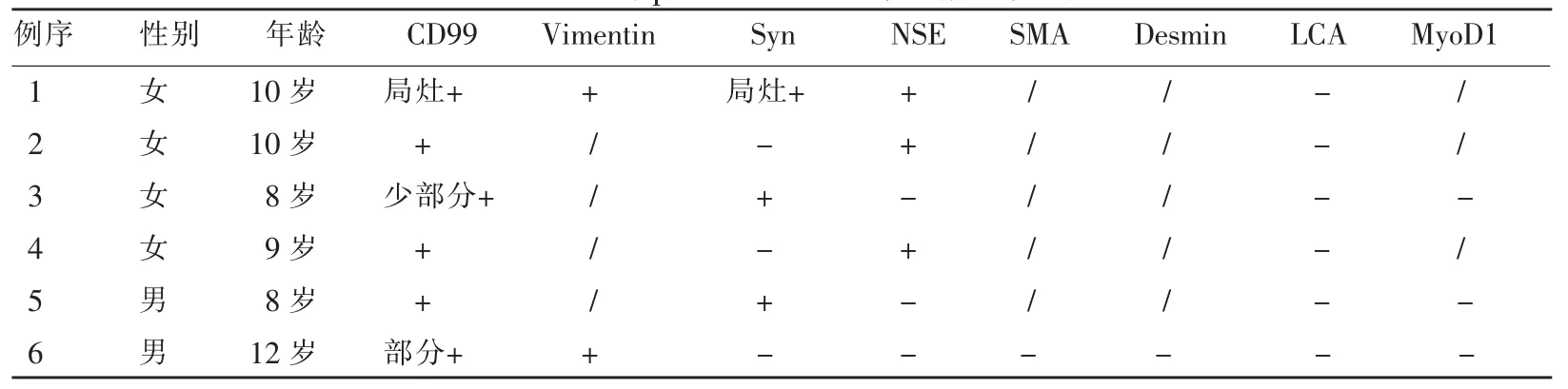
表1 6例pPNET患儿临床及病理资料
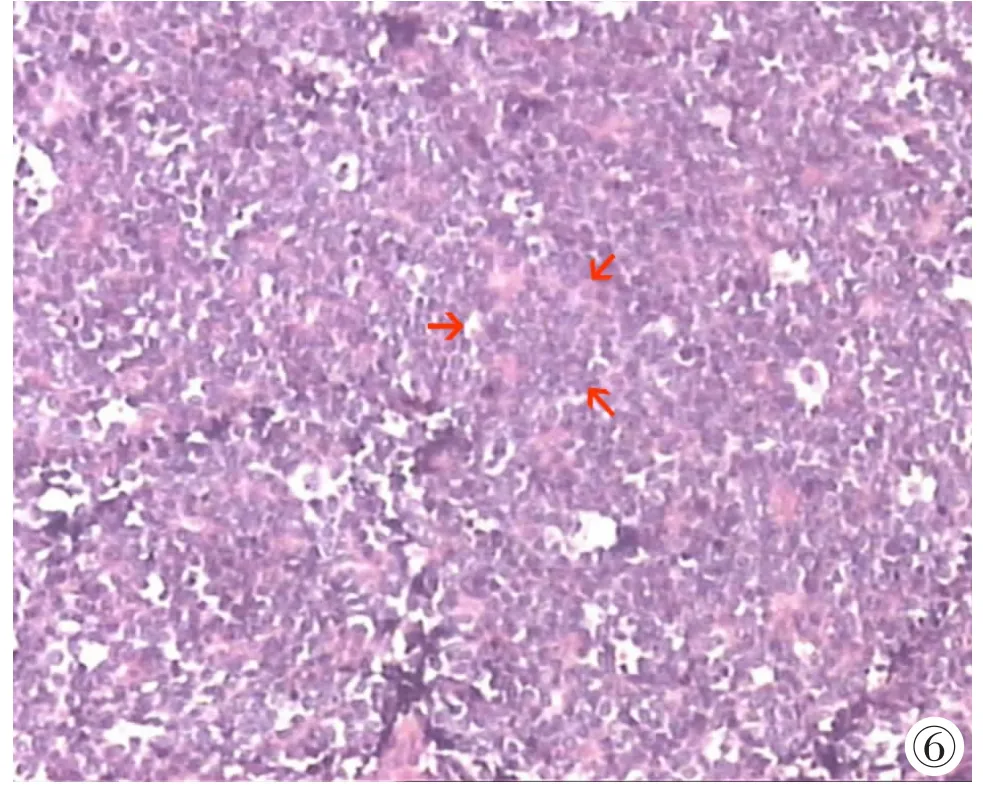
图6 HE染色镜下可见Homer-Wright菊形团结构。Figure 6. Tumor cells exhibit numerous Homer-Wright type rosettes(HE staining).
3 讨论
pPNET亦称外周神经上皮瘤,是发生于外周神经系统的小圆细胞恶性肿瘤,具有多向分化能力。它包括了骨内和骨外的PNET、Askin瘤以及伴多向分化的色素性神经外胚层瘤等[3]。
pPNET可发生于各个年龄阶段,但75%的pPNET发生在30岁之前,男性比女性发病率更高[4]。本组患儿年龄集中于8~12岁,平均年龄为9.5岁。患者以男性多见,本组病例男女比例为2:4,可能为病例数少且年龄较轻所致。pPNET可发生于全身,常见部位为胸壁、头颈部、脊柱旁、四肢,偶见于肾上腺、子宫、卵巢及肠系膜等脏器[5]。以骨和软组织最多见,尤其是脊柱旁、胸壁和下肢。我们研究的6例pPNET分别位于胸壁、腹膜后、手掌背侧以及骨盆。主要的临床表现为迅速生长的肿物引起的压迫症状。
CT具有很高的密度分辨率和组织分辨率,能清楚地显示PNET病变骨质和(或)软组织肿块,如CT薄层扫描能显示细小的骨质破坏,并通过多平面成像可以从不同角度或方位清晰地显示病变大小、侵犯范围以及与周围组织的相互关系,有助于检出远处转移和术前术后评估。CT还可以通过增强技术,更好的显示病变内部结构、区分病变与周围组织。
在本文中,6例pPNET均源自软组织肿物,在CT上表现为巨大的、密度不均的肿物,以囊实性混杂成分为主,与周围组织界限不清楚,增强扫描后病灶明显不均匀强化,与骨质接近时,可引起周围骨质的破坏。以上反映了肿瘤的侵略性。最常见的影像学表现是肿瘤的坏死。据报道,软组织肿物发生坏死、出血和囊变时,呈不均匀强化,且能在增强CT上显示强化的分隔[6-7]。不规则的分隔包含坏死物质,在显微镜下相当于纤维化组织嵌入肿瘤细胞。肿瘤有不同程度的坏死或囊性变可能形成于不同分化阶段的神经上皮组织。
病灶内通常不可见钙化,即使有也通常为细小的、针尖样钙化[8]。Dick等[9]报道的29例pPNET中仅有5例发生轻度钙化。本组病例中仅1例胸壁肿物边缘可见钙化小结节影。丁晓毅等[10]认为这可能与PNET的高侵袭性从而缺乏足够的时间进行钙化或骨化有关。
尽管pPNET有常见的影像学特征,但不同位置的肿瘤有自己的影像学特性。胸壁pPNET最常见,被称为Askin肿瘤[11]。在本文中,2例是Askin肿瘤,它们表现为巨大的软组织肿物伴有同侧的胸腔积液,肿物密度不均并对邻近的肋骨有破坏。
据文献报道,pPNET发生于腹膜后者较罕见。莫蕾等[12]报道一组13例腹部pPNET病例中,仅有3例位于腹膜后。腹部pPNET大多表现为大血管周围不规则形态软组织肿块,其内无明显钙化。肿块常呈浸润性生长,侵犯或推压邻近脏器,且早期转移多见[13]。我们报道的2例腹膜后肿物(占33.3%)CT表现符合文献报道,并有其自身的特点:肿瘤体积相对更大,异质性更强,且伴有多区域的坏死和出血。但随访至今未出现转移。
近年来的研究表明,pPNET与尤文肉瘤(Ewing's sarcoma,ES)在组织形态、免疫组织化学和分子生物学改变方面有许多相似之处,即均有因t(11;22)染色体易位而形成的独特的嵌合基因EWS/FLI-1,以及由MIC2基因编码的糖蛋白P30/ 32(CD99)的表达,故将其称为ES/pPNET家族。现通常认为ES为未分化型,而pPNET则为伴有神经分化的另一种类型。光镜下二者难以鉴别,鉴别诊断主要依靠免疫组织化学及电镜显示的不同神经分化特征[14]。PNET的免疫组织化学显示神经上皮的分化的标志,如CD99,NSE,Syn,S-100蛋白及波形蛋白(Vimentin)[15-17]。在绝大多数PNET病例的细胞表面可以检测到CD99(90%)。电镜下,PNET因起源于原始未分化的神经上皮细胞,部分可分化为胶质细胞或神经细胞,组织形态上均呈小圆细胞形,细胞排列致密,常在纤维蛋白的基质周围环绕形成Homer-Wright菊形团结构,核内有丝分裂活跃,胞浆成分少,核浓染,核浆比例高[18]。因此,PNET可以依赖于免疫组织化学表达的至少两种不同的神经分化标记的存在以及Homer-Wright菊形团的存在而进行诊
断[19]。
ES除与PNET具有以上的相似点及鉴别诊断外,还具有自身的特点:80%的ES在发生20岁以前[20],主要发生于下肢、躯干软组织(脊柱旁和肋间)、头颈部、骨盆及胸腔纵膈膜。CT特点为:骨的ES:肿瘤破坏骨皮质后,可侵入软组织,在骨膜及其周围形成“洋葱皮”样成层的骨膜增生或“骨膜反应”[21]。骨外的ES主要位于胸部或腹部,肿物巨大,呈不规则结节状或分叶状,增强扫描可见肿物密度不均伴有中心性坏死[22-23]。
pPNET还应与横纹肌肉瘤(Rhabdomysarcoma,RMS)相鉴别。70%的RMS发生于10岁以前[24]。主要发生于头颈部、泌尿生殖系统、四肢及胸腹部。CT特点为:头面部RMS:肿物单发;体积较大且累及单侧;具有同质性或异质性;增强后无钙化现象。非头面部RMS:软组织肿物伴有邻近骨破坏,增强扫描后很少显示囊性外观[21,24]。
对于儿童pPNET的诊断应根据其临床特点:对于发生于儿童或青少年软组织内迅速生长的肿块,体积较大,伴有周围组织浸润、肿物内部伴有囊性坏死及分隔,钙化不明显时,pPNET应该被认为是一个重要的鉴别诊断。
pPNET目前仍为少见病例,影像学表现缺乏特异性,确诊需要依靠病理组织检查及免疫组化,但CT检查在显示肿瘤的位置、大小、来源、血供情况以及邻近组织有否受累等具有较明确的提示,通过CT检查结合患者病史,进行肿瘤鉴别诊断的分析,进一步提出术前及术后诊疗计划,判断手术方式,术中尽量切除全部肿物,术后行组织病理学以及免疫组化检查,病理学HE染色镜下可见Homer-Wright菊形团结构,免疫组化染色肿瘤均表达CD99,则更能进一步提示pPNET以确定诊断[25]。
[1]KimMS,KimB,ParkCS,etal.Radiologicfindingsof peripheralprimitiveneuroectodermaltumorarisinginthe retroperitoneum[J].Am J Roentgenol,2006,186(4):1125-1132.
[2]Khong PL,Chan GCH,Shek TWL,et al.Imaging of peripheral PNET:common and uncommon locations[J].Clin Radiol,2002,57(4):272-277.
[3]罗伟,肖恩华.8例外周性原始神经外胚层肿瘤的病理,CT,MRI表现并文献复习[J].癌症,2008,27(6):627-632.
[4]Kransdorf MJ.Malignant soft-tissue tumors in a large referral population:distribution of diagnoses by age,sex,and location[J]. Am J Roentgenol,1995,164(1):129-134.
[5]Winer-MuramHT,KauffmanWM,GronemeyerSA,etal. Primitive neuroectodermal tumors of the chest wall(Askin tumors):CT and MR findings[J].Am J Roentgenol,1993,161(2):265-268.
[6]Thete N,Rastogi D,Arya S,et al.Primitive neuroectodermal tumour of the prostate gland:ultrasound and MRI findings[J].Br J Radiol,2007,80(956):e180-e183.
[7]Chu WC,Reznikov B,Lee EY,et al.Primitive neuroectodermal tumour(PNET)of the kidney:a rare renal tumour in adolescents withseeminglycharacteristicradiologicalfeatures[J].Pediatr Radiol,2008,38(10):1089-1094.
[8]陈杰,胡春洪,陈剑华,等.外周性原始神经外胚层肿瘤的影像表现[J].实用放射学杂志,2006,22(1):67-68.
[9]Dick EA,Hugh KM,Kimber C,et al.Imaging of non-central nervoussystemprimitiveneuroectodermaltumours:diagnostic features and correlation with outcome[J].Clin Radiol,2001,56(3):206-215.
[10]丁晓毅,杜联军,陆勇,等.骨尤文氏瘤与骨外周性原始神经外胚层瘤的影像学对照 [J].中国临床医学影像杂志,2006,17(11):633-637.
[11]AskinFB,RosaiJ,SibleyRK,etal.Maligantsmallcell tumorof the thoracopulmonary region in childhood.A distinctive clinico-pathologicentityofuncertainhistogenesis[J].Cancer,1979,43(6):2438-2445.
[12]莫蕾,江新青,古杰洪,等.腹部外周性原始神经外胚层肿瘤的临床及CT,MR诊断 [J].中国医学影像技术,2010,26(10):1915-1918.
[13]陈自谦,张碧云,肖慧,等.外周性原始神经外胚层肿瘤的CT,MRI表现与病理对照分析 [J].中华放射学杂志,2006,40(12):1299-1302.
[14]Kushner BH,Hajdu SI,Gulati SC,et al.Extracranial primitive neuroectodermal tumors,the Memorial Sloan-Kettering cancer center experience[J].Cancer,1991,67(7):1825-1829.
[15]CarvajalR, MeyersP.Ewing'ssarcomaandprimitive neuroectodermal family of tumors[J].Hematol Oncol Clin North Am,2005,19(3):501-525.
[16]Zhang WD,Chen YF,Li CX,et al.Computed tomography and magneticresonanceimagingfindingsofperipheralprimitive neuroectodermal tumors of the head and neck[J].Eur J Radiol,2011,80(2):607-611.
[17]Kumar R,Reddy SJ,Wani AA,et al.Primary spinal primitive neuroecto-dermal tumor:case series and review of the literature[J].Pediatr Neurosurg,2007,43(1):1-6.
[18]Nikitakis NG,Salama AR,O'Malley BW.Malignant peripheral primitive neuroectodermal tumor-peripheral neuroepithelioma of the head and neck:a clinicopathologic study of five cases and review of the literature[J].Head Neck,2003,25(6):488-498.
[19]McManusAP,GustersonBA,PinkertonCR,etal.The molecular pathology of small round-cell tumours-relevance to diagnosis,prognosis,and classification[J].J Pathol,1996,178(2):116-121.
[20]Yock TI,Krailo M,Fryer CJ,et al.Local control in pelvic Ewing sarcoma:analysis from INT-0091—a reportfromthe Children's Oncology Group[J].J Clin Oncol,2006,24(24):3838-3843.
[21]Van Rijn RR,Wilde JC,Bras J,et al.Imaging findings in noncraniofacial childhood rhabdomyosarcoma[J].Pediatr Radiol,2008,38(6):617-634.
[22]Tsunezuka Y,Furusawa T,Yachi T,et al.Rapidly growing intrathoracicextraskeletalEwing'ssarcoma.[J].Interact Cardiovasc Thorac Surg,2012,14(1):117-119.
[23]Askri A,Farhat LB,Ghariani B,et al.Extraskeletal Ewing sarcoma of the abdominal wall[J].Cancer Imaging,2008,10(8):156-158.
[24]Freling NJ,Merks JH,Saeed P,et al.Imaging findings in craniofacialchildhoodrhabdomyosarcoma[J].PediatrRadiol,2010,40(11):1723-1738.
[25]QianX,KaiX,ShaodongL,etal.Radiologicaland clinicopathological features of pPNET[J].Eur J Radiol,2013,82(12):e888-e893.
Application of CT in pediatric peripheral primitive neuroectodermal tumors
QU Yuan,LIANG Xing-chi,ZHOU Xin,ZHANG Ke-ren,WANG Wei-lin,JIA Hui-min
(Department of Pediatric Surgery,Shengjing Hospital,China Medical University,Shenyang 110004,China)
Objective:To analyze the CT imaging and clinicopathologic features of the pediatric peripheral primitive neuroectodemal tumor(pPNET).Methods:CT imaging of 6 cases with pathologically proven pPNET was retrospectively reviewed,among which 4 cases performed enhanced CT scan.Results:Of all cases,6 lesions were located in the chest wall(n=2),retroperitoneum(n=2),palm dorsal(n=1),and pelvis(n=1).The pPNET in soft tissue appeared as a large,ill-defined mass,with(n=4)or without(n=2)bony invasion,and inhomogeneous density with cystic degeneration,necrosis and internal separations. Most tumors showed heterogeneous enhancement.All patients underwent surgical resection.Histopathological examinations were performed in all cases.Conclusion:Pediatric pPNET are rare with no typical imaging findings.CT is helpful in the displaying location,size,source,blood supply and the involvement of neighbour tissues of tumors.The diagnosis of pPNET should be considered in young patients with a large,ill-defined,soft-tissue mass containing areas of cystic degeneration,necrosis and internal separations.The presence of Homer-Wright rosettes or immunohistochemical expression of CD99 supports the diagnosis of pPNET.
Neuroectodermal tumors,primitive,peripheral;Tomography,spiral computed
R730.264;R814.42
A
1008-1062(2015)10-0740-05
2015-03-16;
2015-06-30
曲媛(1989-),女,辽宁人,硕士研究生。
贾慧敏,中国医科大学附属盛京医院小儿外科,110004。

