RECIST1.0和mRECIST在肝癌射频消融术后疗效评价中的对比研究
孟宪运,戴 旭,苏红英,丁 婕,王 冠
(1.中国医科大学附属第一医院放射科,辽宁 沈阳 110001;2.宁夏人民医院放射科,宁夏 银川 750002)
RECIST1.0和mRECIST在肝癌射频消融术后疗效评价中的对比研究
孟宪运1,戴旭1,苏红英1,丁婕2,王冠1
(1.中国医科大学附属第一医院放射科,辽宁 沈阳110001;2.宁夏人民医院放射科,宁夏 银川750002)
目的:对肝癌患者经皮射频消融(RFA)术前、术后采用RECIST1.0和mRECIST测量比较,为肝癌患者RFA术后提供更准确的疗效评价方法。方法:23例(29个病灶)确诊为原发性肝癌患者至少做过1次RFA,分别于RFA术前1月内、术后3~6月内行CT或MR四期扫描,至少两名放射科医生参与阅片,根据RECIST1.0和mRECIST评价标准评估治疗的缓解、控制程度。两种方法评价疾病控制率的比较采用χ2检验。结果:采用RECIST1.0标准评价的完全缓解(CR)和部分缓解(PR)均为0例、疾病稳定(SD)为6例、疾病进展(PD)为23例,缓解率为00.00%,疾病控制率为20.69%;采用mRECIST标准评价肝癌RFA术后CR为25例、PR为2例、SD为1例、PD为1例,缓解率为93.11%,疾病控制率为96.56%,经χ2检验,P<0.05,疾病控制率有显著性统计学差异。结论:RECIST1.0标准低估了肝癌RFA局部治疗效果,mRECIST标准强调治疗后动脉期强化存活肿瘤的测量,疗效评价更客观、可靠,对肿瘤术后的后续治疗有一定的指导意义。
肝肿瘤;导管消融术;体层摄影术,螺旋计算机
原发性肝细胞癌是最常见的肝脏恶性肿瘤之一,在全球癌症致死原因中居第三位[1]。由于受肿瘤本身性质及其他身体状况影响,约3/4的患者在发现病变时已失去外科手术指征[2]。近代介入放射的化疗栓塞术成为有效治疗方法之一,而新近发展的经皮射频消融(RFA)治疗术又为患者提供了一种很好的选择,尤其在小肝癌的治疗方面可以跟手术治疗相媲美[3]。但RFA术后如何客观有效的疗效评价一直是困扰临床工作者的问题,RFA的主要作用机制是引起肿瘤凝固性坏死,减轻肿瘤负荷。虽然肿瘤体积变化不大,甚至有增大,但肿瘤内部已无存活肿瘤,或很少存活肿瘤,且患者得到更大的生存获益,实现了长期带瘤生存的目标。因此临床中迫切需要制定简便可行的疗效评价标准对肝癌RFA术后的疗效做出客观准确的判断。本研究分别采用实体瘤疗效评价标准(Response evaluation criteria in solid tumors,RECIST)1.0[4],与修订的实体瘤疗效评价标准(Modified response evaluation criteria in solidtumors,mRECIST)标准[5],对肝癌RFA术病灶进行测量对比,拟找到一种更准确、更适用于肝癌RFA术后病灶的疗效评价方法。
1 资料与方法
1.1病例选择
2012年9月—2014年8月本院收治的53例在我院接受RFA治疗的原发性肝癌患者,并剔除30例图像不完全患者,剩余23例(29个病灶)符合本研究要求,其中男21例,女2例,年龄36~79岁,中位年龄56.5岁。全组肝功能Child分级:A级21例,B级2例,C级0例。原发性肝癌的诊断及分期采用2001年9月广州第八届全国肝癌会议所制定标准[6]。病例纳入标准:①原发性肝癌有明确的临床和(或)影像学诊断;②临床分期为Ⅰb期和Ⅱ期(包括Ⅱa、Ⅱb期)患者,不适合或不愿接受外科手术者,对于Ⅱb期患者,没有门静脉分支、肝静脉或胆管癌栓存在;③肝内病灶数不超过5个,均为富血供、非弥漫性肝癌患者;④病灶边界较清楚,CT或MR增强动脉期可见强化,以便于靶病灶的测量;⑤肝功能Child-Pugh分级为A级;⑥DSA造影未发现有肝动-门静脉瘘或肝动脉-肝静脉瘘者。
1.2RFA治疗方法
23例患者至少接受过1次RFA术,常规消毒,铺无菌巾,以穿刺点局部浸润麻醉或全麻,超声扫查或CT扫描定位后,根据病灶大小选定消融针型号,消融5~12 min不等,超声扫查或CT扫描提示各消融病灶范围满意后,术毕拔针,加压包扎。
1.3检查方法
23例肝癌患者均在术前1月内,术后1月内、3~6月内于我院进行CT(18例)或MRI(5例)平扫及动态增强扫描。CT扫描方案:患者增强扫描前4 h禁食水,扫描方法分别采用0.6 mm采集、5 mm层厚重建,1.5 mm和7 mm层厚扫描,螺距为0.6。增强采用非离子型碘对比剂 (300~370 mg/mL),按2.0~3.0 mL/kg注射量,高压注射器流速为2~3 mL/s。平扫结束后,20~25 s采集动脉期图像,50~60 s采集门静脉期图像,120~125 s做延迟期扫描。扫描范围从膈顶至肝脏下缘。MR扫描方案:采用8通道胸腹联合体表线圈,扫描范围自膈顶至肝脏下缘,所有患者均行T1WI,T2WI,同反相位,TR 175.0 ms,TE同相位4.5 ms、反相位2.1 ms,一次采集;T2WI采用快速自旋回波序列(FSE)序列加脂肪抑制,TR 6 000.0 ms,TE 80.0~100.0 ms,层厚8 mm,层距2 mm;增强扫描采用肝脏三维容积快速采集(Liver acquisition with volume acceleration,LAVA)技术,TR 3.7ms,TE 1.7ms,层厚6 mm,层间重叠3 mm。平扫后行增强扫描,对比剂为Gd-DTPA,剂量为0.2 mmol/kg,采用高压注射泵经肘静脉快速团注,流率为3~4 mL/s,注射完毕后用10~15 mL生理盐水冲管。分别于注射对比剂后30~40 s、50~60 s及90~120 s屏气采集动脉相、门静脉相及平衡相。
1.4测量方法和疗效评价内容对比
两种疗效评价均采用精确的一维测量法,测量病灶或者病灶部分的最长径,并由至少两名放射科医生参与阅片。单发肿瘤以肿瘤病灶的最长径作为评价对象,其中mRECIST标准以肿瘤病灶动脉期强化最长径作为评价对象。
RECIST1.0标准:完全缓解(CR):全部肿瘤病灶消失。部分缓解 (PR):靶病灶最长径总和减少30%。疾病稳定(SD):病灶变化介于PR和PD之间。疾病进展(PD):靶病灶最长径总和增加20%和(或)有新病灶出现和(或)非靶病灶明确进展。
mRECIST标准:CR:所有靶病灶动脉期强化消失。PR:所有目标病灶的长径总和减少≥30%。SD:变化介于PR和PD之间。PD:所有目标病灶的长径总和增加至少在20%,并且长径总和增加的绝对值在5 mm以上;或者是出现新的病灶。
所有统计学采用SPSS 19.0完成。
2 结果
疾病控制率(Disease control rate,DCR)即CR、PR及SD之和占病例总数百分比,29个病灶经RFA后,分别经RECIST1.0和mRECIST方法测量和评价,DCR结果经χ2检验,P<0.05为差异有统计学意义。χ2=20.05,P<0.05,二者有显著性差异,见表1,2。

表1 23例肝癌(29个病灶)RFA后行RECIST1.0和mRECIST标准对肿瘤疾病控制率的疗效评价
3 讨论
肿瘤治疗后的精确疗效评价至关重要,需要及时判断治疗是否成功并指导后续治疗,且采用的疗效评价标准必须可靠、可重复,以便不同研究者间的研究报道结果的相互比较。对于肿瘤治疗效果的评价,从重视近期疗效,逐渐过渡到更加重视远期疗效,不断更新和完善并也经历了不同的阶段。从20世纪60年代评价标准雏形、(1981年)WHO标准、(2000年)RECIST1.0和(2009年)RECIST1.1,以及在RECIST基础之上改进的EASL、mRECIST标准,实体肿瘤疗效评价标准历经了近60年的变迁。传统的WHO标准和RECIST标准强调靶病灶整体大小变化,追求“无瘤生存”,忽略了肿瘤内部成分变化,近年来新的靶向分子药物及新的介入治疗手段作用机制均为导致肿瘤坏死,但病灶的总体积有可能不变,甚至增大,肿瘤治疗效果不可能总是与肿瘤大小平行相关,“无瘤生存”的观念显然已经跟不上时代的发展,肿瘤大小的变化往往不能真实反映临床获益,出现低估疗效或假阳性进展结果,从而导致疗效评价不准确,甚至不必要的医源性伤害。2000年欧洲肝病研究协会(EASL)推荐靶病灶的测量应忽视液化坏死部分,以肿瘤强化区面积的大小变化作为评价标准,即测量“存活肿瘤”大小[7],但EASL标准仍需测量强化区域的面积而显繁琐,可重复性差,2008年美国肝病研究协会(AASLD)借鉴“存活肿瘤”的概念,提出了mRECIST标准[5],该标准强调在CT或MR动态增强扫描基础上,避开液化坏死区,测量存活肿瘤,即动脉期强化肿瘤的最大径[7],操作简便易行,可重复性强。近年来也有诸多研究者采用该标准来评价肝癌局部治疗的疗效[8-9]。
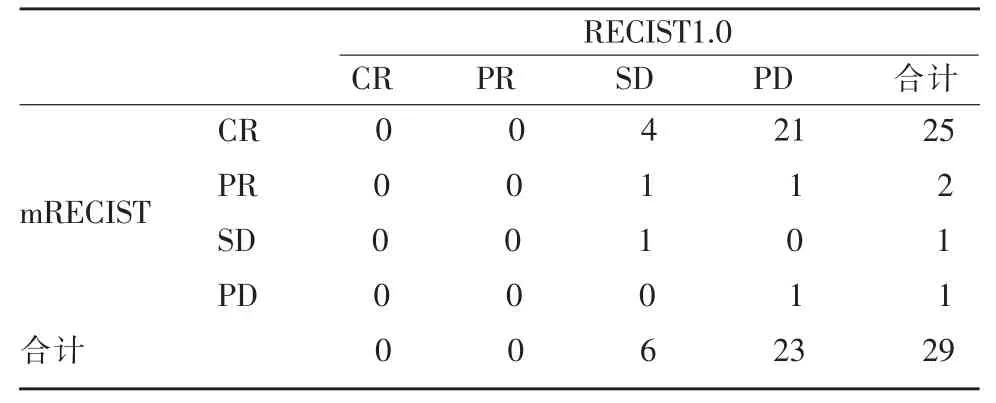
表2 RECIST1.0和mRECIST病例分布差异统计
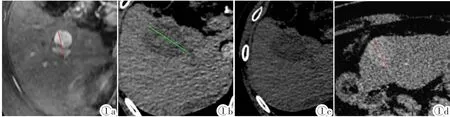
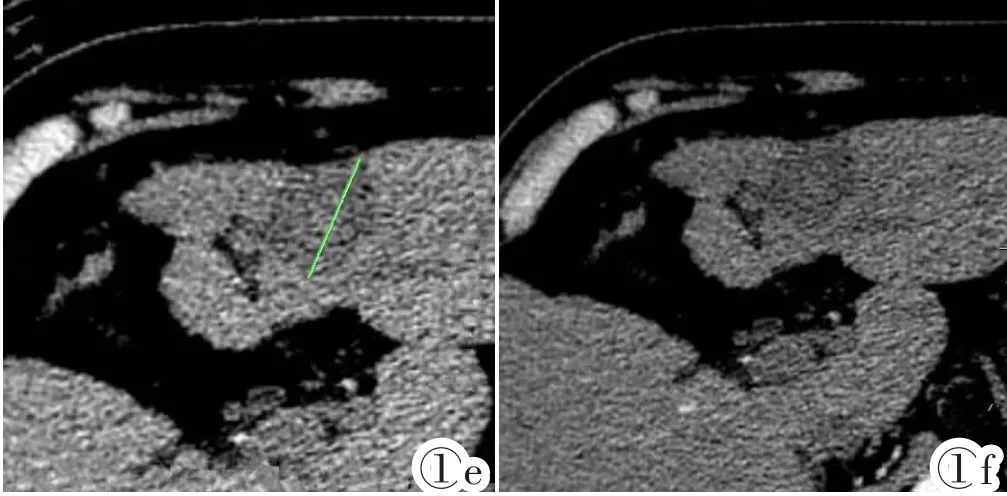
图1a~1f 图1a~1c为同一患者。图1a为术前基线图,MRI增强扫描动脉期病灶明显强化,最大径为28.7 mm。图1b示RFA术后1月复查增强CT,动脉期显示无强化低密度坏死灶,未见异常强化存活病灶,根据RECIST1.0标准测量病灶最大径为45.1 mm,疗效评价为PD,而根据mRECIST标准病灶被完全消融,无强化灶,疗效评价为CR。图1c示RFA术后6月复查增强CT,消融区无强化存活灶,证实疗效为CR。图1d~1f为同一患者,图1d示RFA术前CT增强扫描动脉期病灶均匀强化,最大径为29.6 mm,图1e示RFA术后1月,CT增强扫描动脉期显示无强化坏死低密度灶,根据RECIST1.0标准测量病灶最大径为33.2 mm,疗效评价为SD,由于病灶被完全消融,无强化存活病灶,根据mRECIST标准疗效评价为CR。图1f示RFA术后6月,消融区依然为无强化低密度区,证实疗效为CR。Figure 1a~1f. Figure 1a:Enhanced MR one month before treatment.The lesion diameter is 28.7 mm.Figure 1b:Enhanced CT 1 month after RFA procedure.In arterial phase,it shows a low-density focus of no enhancement.According to the criterion RECIST1.0,the maximum diameter of the tumor is 45.1 mm,which is PD.But according to mRECIST criterion,the lesion is completely necrotic without enhancement,which is CR.Figure 1c:Six months after RFA procedure,the ablation zone still shows no enhancement,which confirms CR.Figure 1d:Enhanced CT of another patient.The diameter of the lesion is 29.6 mm before RFA.Figure 1e:The lesion shows no enhancement in arterial phase after RFA.According to RECIST1.0,it is SD.But no enhancement is shown due to complete necrosis in the lesion.According to mRECIST,it is CR.Figure 1f:The lesion is still not enhanced in arterial phase 6 months after RFA.It is confirmed that the response evaluation is CR.
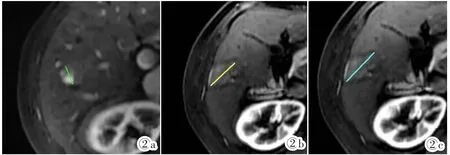
图2a~2c 图2a:病灶术前基线图,病灶最大径为13.1 mm。图2b:患者RFA术后病灶复发,mRECIST标准测量的病灶动脉期强化病灶最大径为29.8mm,疗效评价为PD。图2c:同样的病灶层面RECIST1.0标准测得病灶最大径为34.5mm,疗效同样评价为PD。Figure 2a~2c. Figure 2a:Tumor before treatment.The maximum diameter is 13.1 mm.Figure 2b:Enhanced MR after RFA.The maximum diameter of the lesion is 29.8 mm in arterial phase.According to mRECIST,it is PD.Figure 2c:According to RECIST1.0,the maximum diameter of the lesion is 34.5 mm.It is also PD.
在评估肿瘤治疗反应方面,DCR是评价药物或手术治疗是否有效的常用客观指标之一,也是生存期改善的替代标志之一。本研究采用RECIST1.0和mRECIST标准评价的DCR,差异有统计学意义,P<0.05,RECIST1.0标准评效 DCR 6个病灶,占20.69%,其中无一例缓解(CR+PR),PD达23个病灶;mRECIST标准评效DCR 28个病灶,占96.56%,DCR明显增加。本研究结果与Forner等[10]的研究结果近似。研究分析,RECIST1.0标准不考虑肿瘤内部组织变化,单纯测量病灶长径(包括完全消融凝固坏死病灶),结果DCR仅有7例,且其中无一例缓解;mRECIST标准考虑到对动脉期强化瘤灶的测量,避开液化、凝固坏死区域,DCR 28个病灶,且其中CR病例达25例,占86.21%,这些CR病例大部分来源于RECIST1.0里的SD和PD患者。笔者认为若根据RECIST标准评效结果RFA治疗肝癌大部分是无效的,这有可能误导临床做出错误决策,导致不必要的医源性伤害。RFA术后肿瘤热变性凝固性坏死,微灌注血管床破坏,增强扫描消融灶无强化,肿瘤负荷完全或大部减少,mRECIST标准考虑到肿瘤的灭活,测量时避开瘤灶液化、凝固坏死区域,强调强化存活肿瘤的测量,其结果更能反映肝癌RFA术后疗效评价。另外,RFA治疗需要一定的安全消融边缘(一般为0.5~1 cm)[11],靶病灶区范围扩大,单纯径线测量不能真实反映治疗效果。
综上所述,RECIST标准不适用于肝癌RFA术后疗效评价,RFA治疗目标是将靶病灶彻底消融,肿瘤完全坏死,RFA术后疗效评价应该考虑肿瘤灭活,mRECIST标准在继承传统RECIST标准解剖径线测量基础上,考虑肿瘤灭活,强调存活肿瘤最大径测量,其疗效评价更客观、准确。虽然mRECIST标准考虑了靶病灶内部成分的变化,但其仍然是以解剖形态学为基础的疗效评价标准,随着功能成像、分子影像技术等影像新技术的开发应用,影像诊断及疗效评价已开始由形态学变化的观察向功能、微观形态改变甚至分子影像水平方向发展,为疾病的诊断、治疗及疗效评价提供更准确、更早期的信息,相信不久将来功能性因素一定会被考虑在新的疗效评价标准之内,肿瘤的疗效评价也一定会更加科学准确,更加适合临床研究与实践。
[1]Parkin DM,Bray F,Ferlay J,et al.Global cancer statistics,2002[J].Cancer J Clin,2005,55(2):74-108.
[2]Bruix J,Sherman M.Management of hepatocellular carcinoma[J]. Hepatology,2005,42(5):1208-1236.
[3]Cho YK,Kim JK,Kim WT,et al.Hepatic resection versus radiofrequency ablation for very early stage hepatocellular carcinoma:a Markov model analysis[J].Hepatology,2010,51(4):1284-1290.
[4]Therasse P,Arbuck SG,Eisenhauer EA,et al.European Organization for Research and Treatment of Cancer,National Cancer Institute of United States,National Cancer Institute of Canada[J]. J Natl Cancer Inst,2000,92(3):205-216.
[5]Lencioni R,Llovet JM.Modified RECIST(mRECIST)assessment for hepatocellular carcinoma[J].Semin Liver Dis,2010,30(1):52-60.
[6]中国抗癌协会肝癌专业委员会.原发性肝癌临床诊断与分期标准[J].中华肝脏病杂志,2001,9(6):324.
[7]Bruix J,Sherman M,Llovet JM,et al.Clinical managemengt of hepatocellular carcinoma.Conclusions of Barcelona-2000 EASL conference.European Association for the Study of the Liver[J].J Hepatol,2001,35(3):421-430.
[8]Bargellini I,Vignali C,Cioni R,et al.Hepatocellular Carcinoma:CT for Tumor Response after Transarterial Chemoembolization in Patients Exceeding Milan Criteria-Selection Parameter for Liver Transplantation[J].Radiology,2010,255(1):289-300.
[9]Gu YK,Luo RG,Huang JH,et al.Transarterial embolization ablation of hepatocellular carcinoma with a lipiodol-ethanol mixture[J].World J Gastroenterology,2010,16(45):5766-5772.
[10]Forner A,Ayuso C,Varela M,et al.Evaluation of tumor response after locoregional therapies in hepatocellular carcinoma:are response evaluation criteria in solid tumors reliable?[J].Cancer,2009,115(3):616-623.
[11]Gazelle GS,Goldberg SN,Solbiati L,et al.Tumor ablation with radio-frequency energy[J].Radiology,2000,217(3):633-646.
A comparative study of tumor response by RECIST1.0 and mRECIST in patients treated with RFA for hepatic carcinoma
MENG Xian-yun1,DAI Xu1,SU Hong-ying1,DING Jie2,WANG Guan1
(1.Department of Radiology,the First Affiliated Hospital of China Medical University,Shenyang 110001,China;2.Department of Radiology,Ningxia People's Hospital,Yinchuan 750002,China)
Objective:To compare RECIST1.0 and mRECIST criteria with CT or MRI in evaluation of patients treated with RFA for hepatic carcinoma for a more appropriate application criterion.Methods:Twenty-three patients(29 lesions)diagnosed with hepatic carcinoma took at least one RFA treatment.CT or MR scan was performed witnin 1 month before treatment and 3~6 months after treatment.According to RECIST1.0 and mRECIST evaluation criteria,at least two radiologists assessed the degree of remission and therapy control.The disease control rate was evaluated with χ2test by both methods.Results:The evaluation of RECIST1.0 in hepatic carcinoma after RFA for CR was 0,PR was 0,SD was 6,PD was 23,response rate was 00.00%,and the disease control rate was 20.69%.The evaluation of mRECIST in hepatic carcinoma after RFA for CR was 25,PR was 2,SD was 1,PD was 1,response rate was 93.11%,and the disease control rate was 96.56%(χ2test,P<0.05).The disease control rate for both methods had significant differences.Conclusion:RECIST1.0 criterion underestimates the extent of tumor response after RFA in hepatic carcinoma.The evaluation of mRECIST for hepatic carcinoma after RFA is more objective and reliable.It emphasizes the measurement of enhanced viable tumor in arterial phase by CT or MRI scan,which can play a decisive role for subsequent treatment.
Liver neoplasms;Catheter ablation;Tomography,spiral computed
R735.7;R814.42
A
1008-1062(2015)10-0712-04
2015-03-30;
2015-04-23
孟宪运(1987-),男,山东济宁人,硕士研究生。
戴旭,中国医科大学附属第一医院放射科,110001。

