检验常量铵根离子方法的改进
周昌勇
摘要:以中学教材中常见的9种铵盐为例,采用不添加浓碱的方法进行铵根离子检验研究。通过实验发现,选取的大部分铵盐在不同溶剂中仅采用部分加热的方法就能使湿润的pH试纸变蓝。该方法相比传统方法不仅更加简洁和实用,也会引发读者对教材中某些经典的基础性实验的关注和思考。
关键词:铵根离子;检验;定性分析;方法改进;实验探究
文章编号:1005–6629(2015)8–0063–05 中图分类号:G633.8 文献标识码:B
1 实验探究
1.1 实验试剂
选取的铵盐:硫酸铵(AR,天津致远化学制剂公司)、氯化铵(AR,瞿州花园化学制剂公司)、醋酸铵(AR,天津巴斯夫化工制剂公司)、草酸铵(AR,衢州花园化学制剂公司)、硝酸铵(AR,宁波雅特化工有限公司)、重铬酸铵(AR,无锡市晶科化学制剂公司)、摩尔盐(AR,天津巴斯夫化工制剂公司)、氟化铵(AR,无锡佳妮化工制剂公司)、碳酸氢铵(AR,无锡晶科化工制剂公司)
各种溶剂:蒸馏水、乙醇、丙酮、乙醚、1,2-二氯乙烷、苯、四氯化碳(以上溶剂均为分析纯)
1.2 实验仪器
常规的玻璃仪器和用品。
1.3 实验内容和结果
实验时室内温度为15℃。
准备好干净的大小试管数支、pH试纸、酒精灯、试管夹等仪器。先在大试管中分别放入1~2克9种铵盐,在各试管口粘贴一张湿润的pH试纸并放在试管架上观察;采用同样方法把上述铵盐再分别加入适量不同溶剂中检验。对没有明显变蓝或变蓝较浅的,再进行加热后观察,实验结果记录见表1。检验结果分为较快变蓝、较慢变蓝和较长时间不变蓝3个层次,为了便于表征,分别用“√√”、“√”和“×”表示。
2 分析讨论
2.1 影响铵根离子检验效果的因素
2.1.1 溶剂对铵根离子检验效果的影响
通过上述系列实验可知,在不添加浓碱条件下上述铵盐均可以检验出。为了便于比较分析,笔者把上述铵盐在不同溶剂的检验结果整理为表2。

2.1.2 试纸放置的位置对检验效果的影响
笔者发现试纸的放置位置对检验的效果影响较大。通过实验发现不用添加浓碱采取湿润的试纸放在试管口检验效果不是很好,需要较长时间才能使试纸变蓝,如图1中的1、2;但如果把试纸插入试管口1~2cm或者把试纸横放在试管口则很快就能变色,如图1中的3、4。
上述实验也可以采用气室法,具体操作为取一滴待测液于表面皿上,用另一粘有一小块湿润试纸的表面皿盖上作为气室,然后直接观察或放在石棉网上加热观察。该方法在操作上比前者麻烦,但检验效果比前者要好。
2.1.3 试剂的用量对检验效果的影响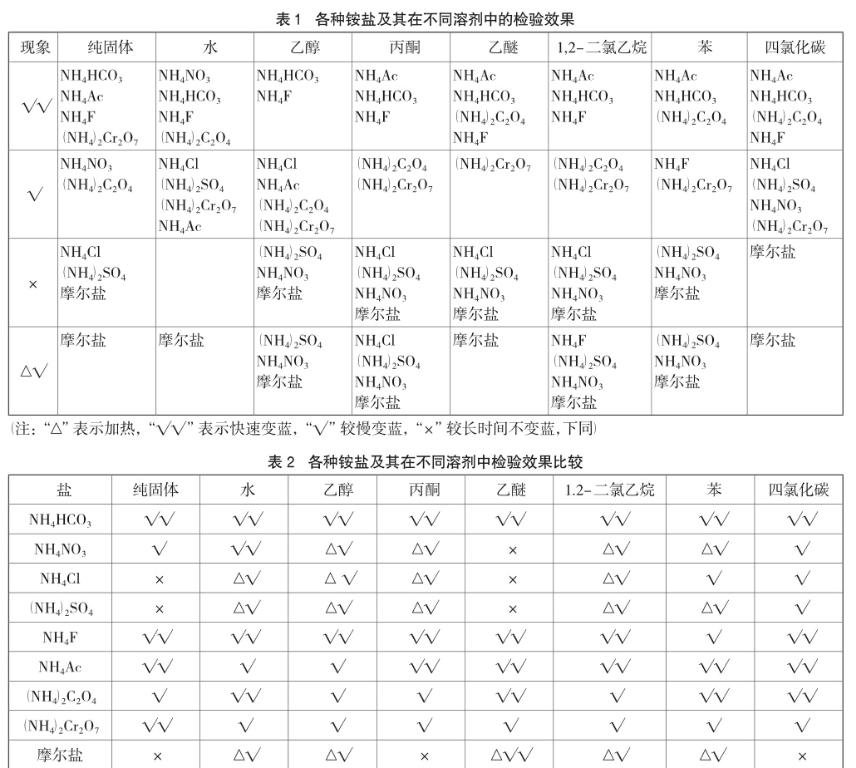

中学教材中对各离子检验并没有标出离子浓度,常规离子浓度一般为0.1~0.5 mol/L左右。为了探究离子浓度对检验效果的影响,笔者对中学教材中常见的几种铵盐分别选取3组浓度进行研究,用小试管各取待测液1~2mL,在试管口粘贴一块湿润的pH试纸,用酒精灯加热到液体微沸,观察试纸的颜色变化,具体见表3。
2.1.4 不同厂家生产的试剂对检验效果的影响
不同厂家生产的同种铵盐对检验效果是否有影响呢?笔者选取实验室中不同厂家生产的同一等级纯度的同种试剂进行检验。在相同的实验条件下进行重复实验,绝大多数铵盐都没有区别,但对天津市巴斯夫化工有限公司和浙江湖州化学试剂厂两家生产的摩尔盐进行检验时,发现当试管的长度加长时检验的效果却略有不同,具体见表4。
实验发现天津巴斯夫化工有限公司制备的摩尔盐当试管长度增加时检验效果没有湖州化学试剂厂制备的摩尔盐明显,说明其在相同条件下释放出的氨气较少。为了研究其中的原因,笔者又各取少量试剂滴加KSCN,发现前者迅速变红,而后者无变化,说明前者有部分被氧化成了硫酸铁铵,后者几乎没有被氧化。查阅相关文献可知硫酸铁铵在480℃才明显分解,其稳定性比摩尔盐要好,这可能是导致其释放出氨气比后者少的原因。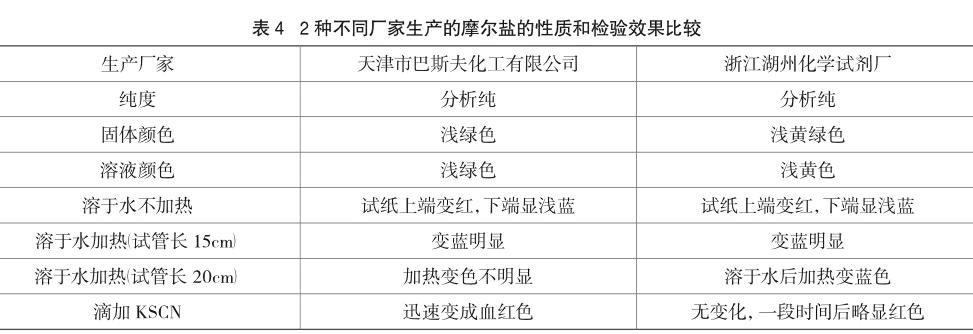
上述实验说明,不同厂家生产的同种试剂,由于在生产工艺、制备包装以及存放时间上的不同,可能会造成试剂的纯度的不同,从而影响实验效果。
2.2探究试纸变蓝的机理
为了能给上述现象比较合理的解释,笔者请教了姜山中学史定海老师,在史老师的启发下并结合自己的思考得到如下几种见解。
其一,在合成上述铵盐中直接使用氨气而导致试剂中吸附着少量氨气,其在常温和加热下氨气挥发出来而导致试纸变蓝。查询相关资料各试剂厂制备铵盐的部分方法的原料如下: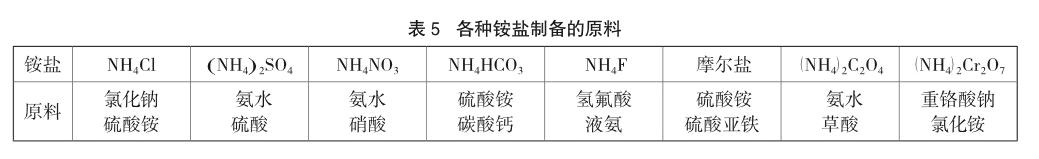
从以上合成方法看,大部分铵盐的制备都以氨气为直接原料,铵盐产品中残留少量氨气的可能性也是有的,但从目前各种试剂的标注的各类杂质中并没有说明有氨气。
其二,各种铵盐在常温下具有一定的挥发性,挥发出的氨使湿润的试纸变蓝。但从铵盐水解的酸碱性分析,NH4Ac为中性,摩尔盐、NH4Cl、 NH4NO3、NH4F、(NH4)2Cr2O7、(NH4)2C2O4为酸性,只有NH4HCO3为弱碱性。上述的实验的结果表明,酸性铵盐中只有摩尔盐试纸上出现少数红色斑点,其他铵盐的实验结果都使试纸变蓝。摩尔盐的上述现象表明其常温下比较稳定,但具有一定的挥发性,该点与相关资料描述的“刺激性”性质相吻合,试纸变红是挥发出的摩尔盐遇到试纸上的水发生水解反应的结果。
其三,有人认为铵根离子水解,生成了一水合氨,加热进一步促使其水解生成了较多的一水合氨,然后其又分解出氨气挥发出来而导致试纸变蓝。这种观点笔者认为可能性较小,因铵根离子水解程度很小,即使加热也不可能释放出氨气。如果是这种原因导致也很难解释其他铵盐在常温下就能使试纸变蓝的事实。下面可通过简单计算进行估算铵盐中氨气(一水合氨)的浓度。
简单估算0.01 mol/L的氯化铵溶液中存在的氨的浓度:

其四,铵盐的部分分解产生NH3所致。为了便于说明问题,笔者把上述铵盐的分解温度列于表6,NH4Ac的分解温度没有查询到。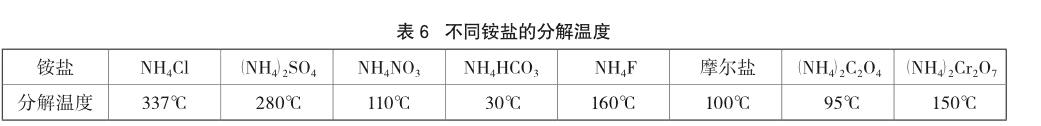
从查询的数据看,除了NH4HCO3分解温度较低外,其他铵盐在常温下都很难分解。如NH4F的分解温度为160℃,(NH4)2Cr2O7的分解温度为150℃。
笔者认为检验出的NH3应来自铵盐的分解,因NH4Cl、(NH4)2SO4等在常温下很难检验出NH3的存在,在水溶液中加热才检验出NH3,说明其在加热条件下部分分解;而其他铵盐分解温度相对较低,在常温下有少量分解。虽然摩尔盐分解温度低,但其常温下比较稳定,这也从实验方面得到验证。这里要注意资料中所提供的分解温度与开始分解温度并不是同一个概念,分解温度一般是指分解产生的气体压强等于外界大气压时的温度,很多物质在常温下都存在少量的分解,不一定达到理论上的分解温度才开始分解。
2.3 该方法与常规方法检验效果的比较
为了比较上述检验方法与常规方法在检验效果上的区别,笔者选取中学中常见的几种铵盐进行了对比实验,研究的待测液浓度均为0.1 mol/L,选取的碱为2 mol/L的氢氧化钠溶液,具体实验结果见表7。
上述实验表明,对于常见的几种铵盐用常规方法检验尽管效果比较明显,但采取只加热或只添加碱的方法从检验效果看也可达到检验的目的。
3 结论

参考文献:
[1]王祖浩等.普通高中课程标准教科书:必修1[M].南京:江苏教育出版社,2014:21.
[2]武汉大学主编.分析化学实验[M].高等教育出版社,2005:77.
[3]李龙泉.定量分析化学[M].安徽:中国科技大学出版社,2002:89.
[4]熊言林.对重铬酸铵热分解产物的质疑[J].化学教育,2005,(2):61.

