金针菇膳食纤维提取工艺研究*
谭属琼,谢勇武
(福建师范大学闽南科技学院,福建 泉州,362332)
金针菇膳食纤维提取工艺研究*
谭属琼,谢勇武
(福建师范大学闽南科技学院,福建 泉州,362332)
试验以金针菇为原料,采用碱浸提法结合酶解法提取金针菇膳食纤维,通过单因素试验研究了酶解时间、碱用量、浸提温度及浸提时间、蛋白酶用量等因素对金针菇膳食纤维提取率的影响, 并且通过正交试验确定最佳提取工艺。结果表明:金针菇中膳食纤维最佳提取工艺条件为金针菇粉为5g,碱用量为2.5mL,提取温度为60℃,浸提时间为90min,蛋白酶用量为3000μg;在此条件下金针菇膳食纤维的最大提取率可达36.66%;经检测:金针菇膳食纤维溶胀性为3.959mL . g-1,持水力为3.756g .g-1。
金针菇;膳食纤维;提取
金针菇又名冬菇、朴菇、构菌、青杠菌、毛柄金钱菌等。金针菇形美,味鲜,营养丰富,具有较高的观赏价值及食用和药用价值,是世界上著名的食药两用菌和观赏菌[1]。金针菇含有8种人体必需氨基酸,其含量占总氨基酸含量的42.29%~51.17%,其中精氨酸和赖氨酸含量高于一般食用菌,对儿童智力增长有重要作用,因此以“增智菇”著称。金针菇含有大量的膳食纤维,可以预防和缓解便秘,热量低,是负卡路里的食物。
膳食纤维(Dietary Fiber,DF)是指能抗人体小肠消化吸收的植物存储或植物细胞壁结构多糖。根据其溶解性的不同,可分为水溶性膳食纤维(SDF)和水不溶性膳食纤维(IDF),主要化学成分是抗人体内酶水解的非淀粉多糖、木质素以及其他植物细胞壁成分[2]。过去几十年对膳食纤维的研究证明,人体摄入足够的膳食纤维对于保持健康、防疾病有积极作用[3]。膳食纤维可以调节血中胆固醇、预防胆结石、减少中性脂质、防止肥胖、降低血压等功能[4~6]。因此膳食纤维被称为继淀粉、蛋白质、脂肪、维生素、矿物质和水之后的“第七营养素”,营养调查资料表明,膳食纤维能有效减少和预防冠心病、糖尿病、高血压、肥胖症、心肌梗塞、结肠炎、便秘等疾病的发生[7]。膳食纤维因其具有较强的持油、持水力等功能引起国内外营养学家的关注。它虽不具营养价值,但在人体内对糖尿病、心血管病、肥胖、肠癌、便秘等多种疾病均有明显的预防和治疗作用[8~9]。试验提取的膳食纤维是水不溶性膳食纤维,下面都以膳食纤维说明。
1 材料与方法
1.1 材料、试剂及设备
1.1.1 原料
金针菇(带菇脚):新鲜,市售;
1.1.2 主要试剂
浓硫酸、氢氧化钠、乙酸乙酯均为分析纯,木瓜蛋白酶:食品级。
1.1.3 仪器设备
78-1型——磁力加热搅拌器,江苏省金坛市荣华仪器制造有限公司;
PHS-3C——pH计,上海博科;
PL203——电子精密天平,梅特勒-托利多仪器(上海)有限公司制造;
DHG-9140A型——电热恒温鼓风干燥箱,上海精宏实验设备有限公司 ;
Anke TDL-40B——离心机,上海安亭科学仪器厂制造;
HH-8——数显恒温水浴锅,江苏省金坛市荣华仪器制造有限公司制造;
JSP-100型——高速多功能粉碎机,浙江省永康市金德机械制造厂;
SHB-B95型——循环水多用真空泵,郑州长城科工贸有限公司;
以及实验室常用的玻璃仪器等。
1.2 试验方法
1.2.1 主要工艺流程
金针菇→干燥(60℃)→粉碎过筛(80目)→乙酸乙酯浸泡→蒸馏水水洗→酸液水解→过滤→水洗至中性→碱浸→固液分离→水洗至中性→室温下加入一定量木瓜蛋白酶水解→洗涤过滤→干燥(60℃)→粉碎得到成品。
1.2.2 金针菇膳食纤维提取率的测定
称取粉碎过筛的金针菇样品,记为m,单位为g。试验后再称所得金针菇膳食纤维的质量,记为m1,单位为g,m1/m即为金针菇膳食纤维的提取率。
提取率(%)=提取物质量/样品质量×100%
1.2.3 金针菇膳食纤维性能的测定[3]
膳食纤维持水力与溶胀性的大小是衡量膳食纤维品质好坏的两个重要特性,持水力、膨胀力越大则表示膳食纤维的吸水、吸油能力越强,表面积及吸附性也越大,因而膳食纤维的生理活性也就越好。膳食纤维的高持水力对调节肠道功能具有很重要的影响,有利于增加粪便的含水量及体积,促进粪便的排泄。膳食纤维吸水膨胀后体积变大,填充胃肠道中的容积,易引起饱腹感。并且膳食纤维也会影响碳水化合物等在肠道中的消化吸收,不容易产生饥饿感,对预防肥胖症非常有利。
1.2.3.1 溶胀性测定
准确称取金针菇膳食纤维1.0g,置于10 mL量筒中,准确吸取25℃5mL蒸馏水,振荡均匀后室温放置24h,读取液体中膳食纤维的体积。溶胀性(mL.g-1)按下式计算:
溶胀性(SW)={溶胀后纤维体积(mL)-溶胀前体积(mL)}/样品干重(g)
1.2.3.2 持水力的测定
准确称取金针菇膳食纤维1.0g,置于20mL烧杯中,加入20mL蒸馏水,水浸泡1h,倒出上清液,沥干后将其转移至表面皿上称重,计算持水力(g .g-1)。持水性按下式计算:
持水性(WHC)={ 样品吸水后湿重(g)-样品干重(g)}/样品干重(g)
2 结果与分析
2.1 单因素试验结果
2.1.1 酶解时间对金针菇膳食纤维提取率的影响
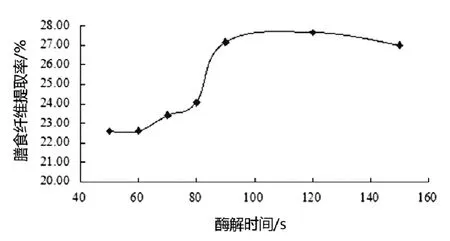
图1 不同的酶解时间对金针菇膳食纤维提取率的影响

图2 碱用量对金针菇膳食纤维提取率的影响
称取金针菇5.0 g,加入浓度1 mol . L-1的NaOH溶液10 mL,在40℃搅拌处理90min,水洗至中性,在室温下加入蛋白酶2000μg分别处理50、60、70、80、90、120、150min,然后用蒸馏水冲洗,后进行抽滤,将滤渣放到50℃恒温干燥箱烘制5h,测定膳食纤维的含量,其结果见图1。
由图1可知,随着酶解时间的延长,金针菇膳食纤维的提取率先增加,后降低,但降幅不大,在酶解时间为50min到90min时,提取率逐渐升高且达到最高,酶解时间为90min时提取率为27.16%,这是因为时间较短时酶解不充分,有些膳食纤维成分未被水解出来,而经过一定的时间,膳食纤维逐渐被水解出来;当继续延长酶解时间,由于半纤维素将被水解成非膳食纤维成分,降低了膳食纤维提取率,提取率出现一个平稳下降的趋势,因此综合考虑得出,酶解时间以固定在90min为宜。
2.1.2 碱用量对金针菇膳食纤维提取率的影响
称取金针菇5.0g,分别加入浓度1mol . L-1的NaOH溶液0.5、1.0、2.5、5.0、10.0、15.0mL,40℃搅拌处理60 min,水洗至中性,在室温下加入蛋白酶4000μg处理90min,然后用蒸馏水冲洗,后进行抽滤,将滤渣放到50℃恒温干燥箱烘制5h,测定膳食纤维的提取率,其结果见图2。
由图2可知,随着氢氧化钠用量的增加,金针菇膳食纤维产率呈现出先上升后下降的趋势,并且当加入的氢氧化钠用量为2.5mL时,为33.26%,其提取率最高。出现这样情况的可能原因是氢氧化钠本身会和部分膳食纤维发生反应,且金针菇本身含有一定的多酚物质,部分的氢氧化钠会被多酚物质中和掉,加入氢氧化钠溶液后,金针菇中膳食纤维产率也随之增加,这主要是因为金针菇中一些蛋白质被溶解。继续添加碱用量时,碱液可能会降解金针菇膳食纤维提取率,因而金针菇膳食纤维提取率又随着碱用量的增加而减少。因此,碱用量控制在2.5mL左右为宜。
2.1.3 浸提温度对金针菇膳食纤维提取率的影响
称取金针菇5.0g,加入浓度1mol . L-1的NaOH溶液2.5mL,分别在40、50、60、70、80、90℃搅拌处理60 min,水洗至中性,在室温下加入蛋白酶4000μg处理90min,然后用蒸馏水冲洗,后进行抽滤,将滤渣放到50℃恒温干燥箱烘制5h,测定膳食纤维的提取率,其结果见图3。

图3 浸提温度对金针菇膳食纤维提取率的影响

图4 浸提时间对金针菇膳食纤维提取率的影响

图5 蛋白酶用量对金针菇膳食纤维提取率的影响
由图3可知,随浸提温度的增加,金针菇中膳食纤维提取率增加,在60℃时达到最大,但温度继续增加时,提取率有所下降。这是因为随着温度的逐渐升高,蛋白质等杂质的溶解性增加,膳食纤维组分水解加快,膳食纤维含量迅速增加。当温度超过60℃后,金针菇中的蛋白质大部分已经溶解,而膳食纤维水解的程度加剧,导致提取率下降。因此,浸提温度控制在60℃左右为宜。
2.1.4 浸提时间对金针菇膳食纤维提取率的影响
称取金针菇5.0g,加入浓度1mol . L-1的NaOH溶液2.5mL,在70℃下分别搅拌处理30、40、50、70、90 、110 min,水洗至中性,在室温下加入蛋白酶4000μg处理90min,然后用蒸馏水冲洗,后进行抽滤,将滤渣放到50℃恒温干燥箱烘制5h,测定膳食纤维的提取率,其结果见图4。
由图4可知,70min内,金针菇膳食纤维的提取率随着时间的延长增加得比较显著,当浸提时间为90min 时,金针菇膳食纤维产率为30.08%。在70min后,金针菇膳食纤维的提取率的增长趋势减慢。主要是因为随着水解时间的推移,底物浓度显著降低,而水解产物浓度不断增大,过高的产物浓度和过低的底物浓度均会对水解反应产生抑制作用。因此,浸提时间应控制在90min左右为宜。
2.1.5 蛋白酶用量对金针菇膳食纤维提取率的影响
称取金针菇5.0g,加入浓度1mol . L-1的NaOH溶液2.5mL,在70℃搅拌处理90 min,水洗至中性,分别在室温下加入蛋白酶500、1000、2000、3000、4000、5000μg,处理90min,然后用蒸馏水冲洗,后进行抽滤,将滤渣放到50℃恒温干燥箱烘制5h,测定膳食纤维的提取率,其结果见图5。
由图5可知,随着加酶量的逐渐增加,蛋白质水解也在相应的增加,当添加量达到3000μg后,水解率趋势下降。这是因为在底物浓度不能被酶完全饱和时,水解率随着加酶量的增长而增长;当加入的酶量逐渐增长到能使底物浓度饱和后,水解率下降。因此,酶添加量应控制在2000μg左右为宜。
2.2 正交试验结果
研究通过单因素试验,确定了碱用量(A),浸提温度(B),浸提温度(C),蛋白酶用量(D) 4个因素的试验结果进行分析,最终确定了正交试验的各因素水平,见表1。采用L9(34)正交试验表安排了各试验的因素水平,进行试验且得出金针菇膳食纤维提取率,试验方案及结果见表1,2。
在单因素试验的基础上,通过L9(34)正交试验,由表2极差R分析可知,对提取金针菇膳食纤维的影响大小主次顺序为:A的极差最大,其次分别是B、D、C,影响提取率的主次因素的顺序为A>B>D>C,即碱用量度>浸提温度>浸提时间>蛋白酶用量。说明碱用量是影响金针菇膳食纤维提取率的主要因素,蛋白质的含量在金针菇膳食纤维提取过程中具有一定的影响,降低膳食纤维提取率,因此氢氧化钠的添加量在2.5mL最为适宜。浸提温度是提取金针菇膳食纤维的第二因素,氢氧化钠添加量在2.5mL,浸提温度低于60℃时,金针菇膳食纤维提取率趋于平缓,波动不大,然而高于60℃时,金针菇膳食纤维的提取率又缓慢下降,因此,氢氧化钠添加量在2.5mL,最适宜的浸提温度为60℃。蛋白酶用量是提取金针菇膳食纤维的第三因素,酶解可基本上把淀粉和蛋白质去除掉,得到金针菇膳食纤维。当氢氧化钠添加量在2.5mL,最适宜的浸提温度为60℃,蛋白酶的添加量逐渐增加,蛋白质水解也在相应的增加,当添加量达到3000μg后,水解率趋势下降,这是因为在底物浓度不能被酶完全饱和时,水解率随着加酶量的增长而增长;当加入的酶量逐渐增长到能使底物浓度饱和后,水解率下降。金针菇膳食纤维提取率下降,相反,蛋白酶的添加量低于3000μg,高于1000μg,金针菇膳食纤维提取率上升,所以蛋白酶最适宜的添加量为3000μg。当浸提时间低于70 min时,金针菇膳食纤维提取率变化不大,高于110 min时,提取率逐渐平缓,并有下降的趋势,水解时间的延长,底物浓度逐渐降低,而水解产物浓度不断增大,过高的产物浓度和过低的底物浓度都会对水解反应产生抑制作用。因此得出最佳工艺条件为A2B2C2D3,即碱用量2.5mL,浸提温度60 ℃,浸提时间90 min,蛋白酶用量3000μg,说明氢氧化钠添加量是影响提取率的主要因素,浸提温度对金针菇膳食纤维的提取率有着较大的影响,而浸提时间与蛋白酶用量两者的影响相差不是很大。
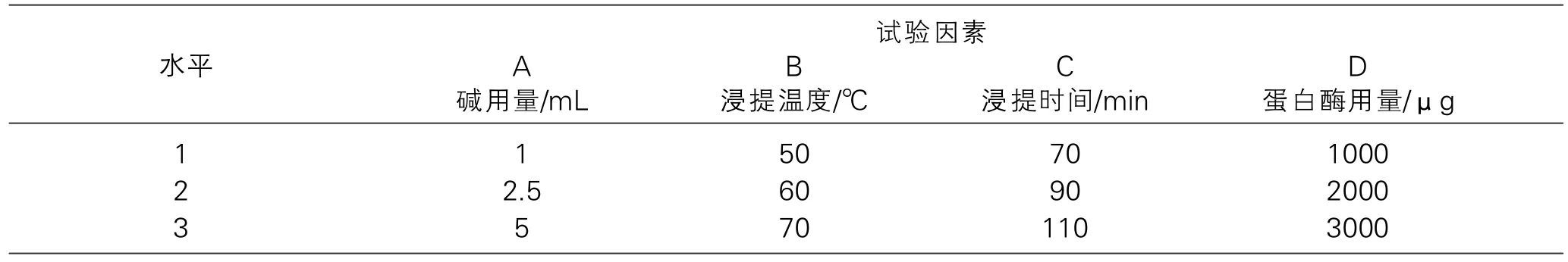
表1 正交试验因素水平表

表2 正交试验设计与结果
2.3 膳食纤维性能的测定结果
膳食纤维膨胀力和溶胀度的大小是衡量膳食纤维品质好坏的2个重要指标,膨胀力、溶胀度越大膳食纤维的吸水、吸油能力越强,表面积及吸附性也越大,膳食纤维的生理活性也越好[10~12]。经测定,该研究得到的金针菇膳食纤维的持水力为3.756g . g-1,溶胀性为3.959 mL . g-1。
3 结论
利用酸-碱浸提法结合酶解法提取金针菇膳食纤维,最佳提取工艺条件为:碱用量为2.5mL,碱提取温度为60℃,碱浸提时间为90min,蛋白酶用量为3000μg,酶解时间为90min;在此条件下金针菇膳食纤维的最大产率可达36.66%;膳食纤维溶胀性为3.959mL . g-1,持水力为3.756g . g-1。该试验表明,金针菇中膳食纤维含量丰富,而且纤维品质也较好,是提取膳食纤维的良好原料。科学家建议每人每日食入40 g食用纤维最为合适,我国人口众多,因此可以看到的是我国食用纤维的市场需求量是巨大的。食用菌中含有许多有益于人体健康的成分,因而从食用菌中提取膳食纤维潜在着较大的市场开发意义。
[1]卯晓岚.中国大型真菌[M].郑州:河南科学技术出版社,2000,241-243.
[2]吴茂玉,葛邦国,和法涛,等.高活性苦瓜膳食纤维粉的研究[J].食品研究与开发,2007,28(2):4-7.
[3]Grigelmo Migue IN,GorinsteinS.Characterisation of peach dietary fibreconcentrateasa food ingredients [J].Food Chemistry,1999,65(2):175-181.
[4]张丽云,王晓光,鲁春起,等.麦麸膳食纤维的研究[J].食品科学,1999,(2):56-58.
[5]Bartolome Bjimenez Rameseg,Butler L G.Nature of the condensedtannins present in the dietary fibre fractions in foods[J].Food Chem,1995,53(4):357-362.
[6]籍保平,尤希凤,张博润.苹果渣发酵生产饲料蛋白的工艺条件[J].生物工程进展,1999,19(5):30-33.
[7]黄桂英.膳食纤维与人体健康[J].中国食物与营养,2003,(2)2:47-48.
[8]艾仄宜,张洁,杨晓萍,等.平菇水不溶性膳食纤维的提取工艺研究[J].北方园艺,2008,(10):181-182.
[9]PEREZ-JIMENTZ J,SERRANO J,TABERNERO M,et a1.Efects ofgrapeantioxidant dietary fiber in cardiovascular disease risk factors[J].Nutrition,2008,24:646-653.
[10]吕群金,衣杰荣,丁勇.Folin-Ciocalteu比色法测定杨桃的多酚含量[J]. 湖南农业科学,2009,(7):99-101.
[11]谢碧霞,李平安.膳食纤维[M]. 北京:科学出版社,2006.
[12]竹文坤,贺新生.红平菇膳食纤维分离提取研究[J].食品研究与开发,2008,29(7):137-140.
10.3969/j.issn.1007-550X.2015.06.001
TS202.3
A
1007-550X(2016)06-0035-06
*福建师范大学闽南科技学院科技项目(MK13003)。
2015-04-17
谭属琼,女,硕士研究生,研究方向:农产品加工与储藏。

