丹参酮ⅡA对UVA诱导的HaCaT细胞凋亡的影响
史维刚,廖鲜艳,翁新楚
(上海大学生命科学学院,上海 200444)
丹参酮ⅡA对UVA诱导的HaCaT细胞凋亡的影响
史维刚,廖鲜艳,翁新楚
(上海大学生命科学学院,上海 200444)
以人自发性永生化角质形成细胞系(HaCaT)细胞为材料,通过CCK8和蛋白印迹法分别测定不同剂量长波紫外线(ultraviolet A,UVA)、不同浓度丹参酮ⅡA(tanshinoneⅡA,TSⅡA),以及UVA和TSⅡA共同作用下的细胞活力和促分裂素原活化蛋白激酶(mitogenactivated protein kinase,MAPK)信号通路蛋白(p38,JNK和Erk)磷酸化水平.结果表明:在10 J/cm2的UVA照射下,细胞活力为对照组的70%左右,在20 J/cm2的UVA照射下,细胞活力仅为对照组的55%左右;低浓度的TSⅡA在正常情况下对细胞活力无影响,高浓度(85µmol/L)TSⅡA处理组的细胞活力约为对照组的70%左右.与TSⅡA或UVA单独处理相比,二者共同作用下细胞活力大大降低且差异极其显著.UVA照射提高了MAPK信号通路中的p38和JNK磷酸化水平,但是对Erk磷酸化水平没有影响;而TSⅡA可以显著提高低辐射剂量(2 J/cm2)UVA诱导下的p38和JNK的磷酸化水平.这说明UVA促进HaCaT细胞凋亡是通过提高p38和JNK磷酸化水平来实现的;而TSⅡA可以提高p38和JNK磷酸化水平,进一步加速UVA诱导的HaCaT细胞凋亡.
丹参酮ⅡA(tanshinoneⅡA,TSⅡA);长波紫外线(ultraviolet A,UVA);HaCaT;促分裂素原活化蛋白激酶(mitogen-activated protein kinase,MAPK);凋亡
皮肤癌是目前世界范围内十分普遍的疾病,严重威胁人类的健康.据报道,6个美国人中就有1个在一生中可能患皮肤癌[1].非黑素性皮肤癌患者在皮肤癌患者中的比例超过了1/3,并且以每年大约6 000 000的人数增长[2].中国的皮肤癌发病率,男性为0.3%~0.4%,女性约为0.3%,其中较大的人口基数意味着绝对新发病例数目同样不容忽视[3].
皮肤癌的主要诱因是紫外线[4].紫外线按波长可分为短波紫外线(ultraviolet C,UVC),波长为200~290 nm;中波紫外线(ultraviolet B,UVB),波长为290~320 nm;长波紫外线(ultraviolet A,UVA),波长为320~400 nm.地球上空的臭氧层可以吸收的紫外线波长最大到310 nm,所以照射到皮肤上的紫外线以UVA居多[5].角质形成细胞是皮肤表层最主要的细胞,其健康程度直接影响着其他皮肤细胞的功能和状态.UVA对角质形成细胞的影响在国外研究较多.一般认为UVA的致癌作用,一方面是因为其在细胞中产生的单线氧(1O2)和氧自由基(reactive oxygen species,ROS)引起的核酸氧化损伤、蛋白质的氧化和脂质过氧化;另一方面,UVA可以激活多种膜受体,并引发癌变或凋亡相关信号通路的转导.郭坤等[6]报道了UVA对HaCaT细胞的氧化损伤作用,发现经过UVA照射后细胞中的ROS含量明显上升,导致超氧化物歧化酶(superoxide dismutase,SOD)和谷胱甘肽过氧化物酶(glutathione peroxidase,GSH-PX)活性下降.陈斌等[7]研究了UVA和UVB对细胞骨架的影响,发现经UVA/UVB照射后5种角蛋白(keratin)中的K7,K8,K13,K18和K19发生变化,这些骨架蛋白的变化不仅与皮肤细胞形态有关,还可能进一步参与细胞凋亡及癌变.
TSⅡA是从传统中药丹参根中提取的菲醌类衍生物,分子式为C19O3H20[8],经常用于心绞痛的治疗,能改善胸闷和缺氧后引起的心肌代谢紊乱[9].国内的有关研究表明,TSⅡA可以抑制肝癌细胞的增殖[10],诱导乳腺癌细胞的凋亡[11].韩国的Jang等[12]发现TSⅡA在小鼠巨噬细胞RAW264.7中通过NF-κB诱导激酶—IκB激酶途径和MAPK信号通路降低NF-κB的活性,具有一定的抗炎作用.日本的Dai等[13]研究发现,TSⅡA可以提高肝癌细胞BEL-7402胞内的钙离子水平,并通过钙离子依赖的信号通路诱导癌细胞凋亡.然而,TSⅡA在皮肤癌治疗方面的应用鲜有报道.本研究拟通过比较在UVA和TSⅡA单独作用,以及二者共同作用下HaCaT细胞的凋亡水平和凋亡信号通路相关蛋白磷酸化水平,探究TSⅡA促进UVA诱导的细胞凋亡机制.
1 材料和方法
1.1材料
1.1.1试剂
TSⅡA(中国药品生物制品检定所);DMEM(dulbecco's modified eagle medium)培养基、胎牛血清(Gibco公司);细胞增殖-毒性检测试剂盒(CCK8,同仁化学);细胞裂解液(Sigma公司);BCA蛋白浓度测定试剂盒(Pierce);预制胶(Bio-Rad公司);PVDF预制膜(Bio-Rad公司);显色剂(Bio-Rad公司);蛋白印迹膜再生液(Thermo Meter);磷酸化p38、磷酸化JNK、磷酸化Erk(P-p38,P-JNK,P-Erk)及总p38、总JNK、总Erk抗体及其对应的二抗(辣根过氧化酶标记羊抗兔IgG抗体,Cell Signaling公司);β-actin抗体及其对应的二抗(辣根过氧化酶标记羊抗鼠IgG抗体,Cell Signaling公司).
1.1.2仪器
紫外辐照仪CL-1000(灯管波长为365 nm)及辐照强度计(美国UVP公司);酶标仪(Tecan Safire 2);生物分子成像仪(GE ImageQuant LAS 500);垂直电泳仪(Mini-Protean Tetra)、蛋白转印系统(Trans-Blot Turbo)均购于美国Bio-Rad公司.
1.1.3细胞
HaCaT细胞购于武汉原生原代(PriCells)生物医药科技有限公司.
1.2方法
1.2.1细胞培养及分组
HaCaT细胞培养在DMEM完全培养基(DMEM加10%灭活胎牛血清、100 U/mL青霉素和100µg/mL链霉素)于37◦C,5%CO2条件下常规培养,细胞以0.25%胰酶消化并按1∶3传代.HaCaT细胞接种于12孔板,待细胞完全融合时进行实验并随机分组,每组做3个重复.在测定UVA对细胞活力和MAPK信号通路蛋白影响的实验中按UVA剂量分组;在评价TSⅡA对细胞活力影响的实验中按浓度分组;在TSⅡA和UVA共同对细胞活力影响的实验中,分为对照组、仅TSⅡA处理组、仅UVA照射组、TSⅡA和UVA共同处理组来研究细胞活力水平及p38和JNK的磷酸化水平.
1.2.2UVA照射
照射时弃去培养基,用DPBS(dulbecco phosphate-buffered saline)冲洗2次并弃去DPBS;重新向所有孔中加入0.5 mL DPBS.细胞培养板距紫外灯管15 cm,并置于紫外辐照仪内部中央.紫外强度(J/cm2)=单位面积瓦特值(W/cm2)×时间(s).照射时,对照组和仅TSⅡA处理组用锡箔纸盖住,照射后DPBS由常规完全培养基或者加有TSⅡA的完全培养基替换并继续培养.
1.2.3TSⅡA处理
将TSⅡA溶于二甲基亚砜,用DMEM完全培养基稀释到所需浓度.HaCaT细胞常规完全培养基更换为含有不同浓度TSⅡA的完全培养基,继续在37◦C,5%CO2的条件下培养24 h.在测定细胞活力的实验中,TSⅡA在UVA照射后加入对应细胞组;在测定MAPK信号通路蛋白水平的实验中,TSⅡA在UVA照射前24 h加入对应细胞组.
1.2.4细胞活力的测定
细胞活力由CCK8(cell counting kit-8)测定.处理后的细胞经过常规培养24 h后,用DPBS冲洗2次并弃去DPBS,每个孔加入0.5 mL混有CCK8的完全培养基(m(CCK8)∶m(DMEM)=1∶10)于37◦C,5%CO2条件下常规培养.2 h后每个孔吸取100µL上清至96孔板,在450 nm的波长下读取吸光值,以对照组为100%细胞活力计算相对细胞活力.
1.2.5蛋白质印迹法检测磷酸化水平及总MAPK信号通路蛋白
检测UVA对MAPK信号通路蛋白磷酸化影响:①不同剂量UVA照射后30 min,用预冷的DPBS冲洗3次并弃去DPBS,然后每个孔加入300µL的细胞裂解液摇晃15 min,并用细胞刮刀刮下置于1.5 mL的离心管内,以12 000r/min的速度离心15 min,收集上清;②用蛋白浓度测定试剂盒测样品蛋白质浓度,在预制胶上每孔上样20µg蛋白质,10% SDS-PAGE(sodium dodecyl sulfate polyarcylamide gel electropheresis)电泳,蛋白质转移至PVDF(polyvinylidene fluoride)膜;③PVDF膜用封闭液TBST(tris buffered saline with tween)(1×TBS,0.1%Tween 20)+5%牛血清室温封闭1 h,加入P-p38,P-JNK和P-Erk抗体(1∶1 000)4◦C孵育过夜,TBST洗3次,每次5 min,加入对应的羊抗兔二抗(1∶2 000)室温孵育1 h;④PVDF膜用TBST洗3次,每次5 min,加显色剂反应3 min后置于生物分子成像仪上显色;⑤PVDF膜用TBST洗3次,并用蛋白印迹膜再生液浸泡15 min.重复③和④,其中步骤③加入总p38、总JNK和总Erk抗体及其对应的羊抗兔二抗或β-actin抗体及其对应的羊抗鼠二抗.显色图像采用Image J软件分析灰度值,并用P-p38/β-actin,P-JNK/β-actin和P-Erk/β-actin衡量其磷酸化水平.
检测TSⅡA和UVA共同对MAPK通路蛋白中P-p38和P-JNK表达水平的影响:仅在TSⅡA处理组、TSⅡA和UVA共同处理组中分别加入含有不同浓度TSⅡA的完全培养基培养24 h后,用2 J/cm2UVA照射细胞;照射后30 min,分别提取总蛋白并检测目标蛋白的表达水平.除不加入P-Erk和总Erk抗体及其对应二抗外,其余步骤同上.
1.2.6数据处理
采用统计软件JMP 11.0(美国SAS研究所)进行统计学分析.所有数据均用mean±SE表示,两组间均数比较通过方差分析(anlysis of variance,ANOVA)进行,两两间均数比较通过Dunnett和Tukey校正进行,分别与对照组和任意处理组进行对比,其中P<0.05表示差异具有显著性,P<0.01表示差异性极显著.
2 结果
2.1UVA对HaCaT细胞活力的影响
HaCaT细胞经受不同剂量UVA照射后继续培养24 h,用CCK8测定细胞活力.UVA对HaCaT细胞活力的影响如图1所示.可以发现,细胞活力表现出较大的差异且与UVA剂量相关,其中较低剂量(1~5 J/cm2)的UVA使细胞活力下降不明显,较高剂量的UVA使细胞活力下降较大.当UVA的剂量为10 J/cm2和20 J/cm2时,细胞活力分别是对照组的70%左右和55%左右.这说明UVA对HaCaT细胞具有一定的杀伤力,且随着剂量的加大,杀伤力逐渐增强.

图1 UVA对HaCaT细胞活力的影响Fig.1 Effects of UVA on cell viability in HaCaT
2.2TSⅡA对HaCaT细胞活力的影响
将HaCaT细胞用含有不同浓度TSⅡA的培养基培养24 h,用CCK8测定细胞活力. TSⅡA对HaCaT细胞活力的影响如图2所示.由图2可知,低浓度(8.5~34µmol/L)的TSⅡA对细胞活力几乎无影响,随着TSⅡA浓度的提高,细胞活力逐渐降低;42.5µmol/L的TSⅡA可使细胞活力轻微下降;高浓度(85.0µmol/L)的TSⅡA对细胞活力影响较大,细胞活力约为对照组的70%.
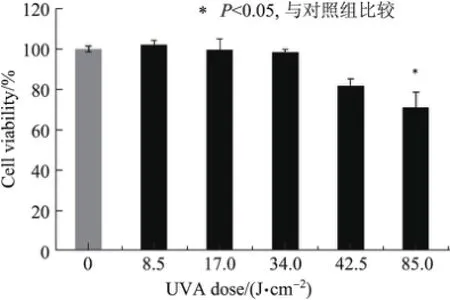
图2 TSⅡA对HaCaT细胞活力的影响Fig.2 Effects of TSⅡA on cell viability in HaCaT
2.3TSⅡA和UVA共同对HaCaT细胞活力的影响
HaCaT细胞分别经过20 J/cm2和2 J/cm2的UVA照射后,用含有不同浓度TSⅡA的完全培养基继续培养24 h,用CCK8测定细胞活力.TSⅡA对UVA诱导的HaCaT细胞活力的影响如图3所示.
由图3(a)可知,在20 J/cm2的UVA作用后添加TSⅡA的细胞,与仅UVA照射的细胞相比,细胞活力显著降低且随着TSⅡA浓度的升高而下降.添加了8.5,17.0,34.0µmol/L TSⅡA的细胞,其活力分别约为仅UVA照射细胞的66%,56%和40%.而由图2可知,低浓度的TSⅡA对细胞活力无明显影响,这说明高浓度TSⅡA加剧了UVA照射后细胞活力的下降.
由图3(b)可知,2 J/cm2UVA对HaCaT细胞活力的影响情况与20 J/cm2UVA类似:TSⅡA均可以加剧UVA诱导的细胞活力的下降,且其程度与TSⅡA浓度相关.与仅UVA照射的细胞相比,经8.5µmol/L TSⅡA处理过的细胞,其活力没有显著变化;经17.0µmol/L TSⅡA处理过的细胞,其活力下降了20%;经34.0µmol/L TSⅡA处理过的细胞,其活力更是下降了33%.
综上所述,无论是经高剂量还是低剂量UVA照射,TSⅡA都可以进一步使细胞活力下降,二者具有叠加效应.
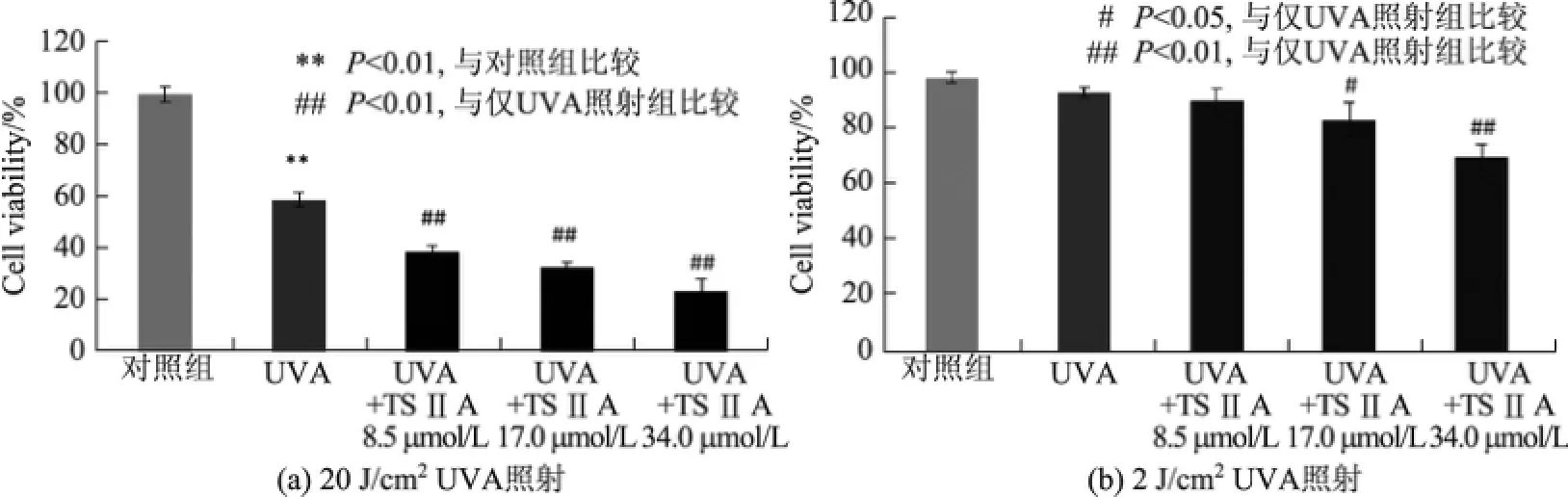
图3 TSⅡA对UVA诱导的HaCaT细胞活力的影响Fig.3 Effects of TSⅡA on cell viability in UVA-induced HaCaT
2.4UVA对MAPK通路蛋白表达水平的影响
HaCaT细胞经不同剂量的UVA照射后30 min提取总蛋白,并用蛋白印迹法测定目标蛋白表达水平,结果如图4所示.可以看出,细胞经UVA照射后P-p38和P-JNK的表达水平显著上升,且二者的表达水平与照射剂量呈正相关.在2 J/cm2的UVA作用下,P-p38/βactin约为2.3,P-JNK/β-actin约为3.0;在20 J/cm2的UVA作用下,P-p38/β-actin约为3.3,P-JNK/β-actin约为3.8.不同剂量的UVA照射对HaCaT细胞的P-Erk表达没有显著影响,这与文献[14]中的报道一致,即总p38、总JNK和总Erk在细胞经不同剂量的UVA照射后均无明显变化.

图4 UVA对HaCaT细胞MAPK通路蛋白磷酸化水平的影响Fig.4 Effects of UVA on phosphorylation of proteins in MAPK of HaCaT
2.5TSⅡA和UVA共同对MAPK通路蛋白中P-p38和P-JNK表达水平的影响
HaCaT细胞经不同浓度TSⅡA处理24 h后,部分组细胞用2 J/cm2的UVA照射,30min后对所有组细胞提取总蛋白,并用蛋白印迹法测定目标蛋白表达水平.TSⅡA和UVA共同作用对P-p38和P-JNK表达水平的影响如表1所示.

表1 TSⅡA和UVA对P-p38和P-JNK表达水平的影响Table 1 Effects of TSⅡA and UVA on P-p38 and P-JNK
由表1可以看出,HaCaT细胞在用不同浓度TSⅡA培养24 h而未经UVA照射的情况下,其P-p38和P-JNK的表达水平无明显变化,总p38和总JNK基本不变.这说明TSⅡA在正常情况下不会引起p38和JNK的激活,不会介导HaCaT细胞的凋亡.
TSⅡA的预处理使照射UVA的细胞中P-p38和P-JNK的表达水平均有不同程度的提高,其中P-p38表达水平随着TSⅡA浓度的提高而上升,而P-JNK表达水平则在较高的TSⅡA浓度下急剧上升.当TSⅡA和UVA共同处理组中TSⅡA的浓度达到34.0µmol/L时,通路蛋白中P-p38和P-JNK的表达水平均较高,其中P-p38/β-actin和P-JNK/β-actin分别为4.4和38.8,与仅UVA照射组(P-p38/β-actin和P-JNK/β-actin分别为2.0和8.8)相比,二者的表达水平分别提高约2.2和4.4倍.
3 讨论
UVA使HaCaT细胞活力下降是因为其诱导了细胞凋亡,原因有以下几点:①UVA的辐射引起DNA的损伤,导致Fas上调和FasL(fas ligand)表达增加,其机制可能与JNK相关.Fas是一种死亡受体,通过结合配体FasL而激发细胞凋亡[15].②UVA刺激产生的ROS(reactive oxygon species)可以直接激活MAPK信号通路[16].③UVA可以直接激活细胞膜上的生长因子受体和死亡受体,激活的受体可以进一步介导下游的癌变或凋亡通路,最主要的是MAPK信号通路[17].低浓度的TSⅡA在正常情况下对细胞活力无影响,只有达到一定浓度(85µmol/L)时才会对细胞活力产生影响,这表明在一定浓度范围内,TSⅡA添加到皮肤保护用品中对皮肤是比较安全的.TSⅡA加剧了UVA诱导的HaCaT细胞活力下降可能是因为其促进了UVA诱导的细胞凋亡.
MAPK信号通路是真核生物信号传导网络中的重要途径之一,其主要有3个亚族:p38,JNK和Erk,它们分别或共同对细胞的增殖和凋亡产生作用.Erk包括p42和p44两个亚基(见图4(c)),主要被生长和分化因子刺激而激活;JNK包括p46和p54两个亚基(见图4(b)),除了生长因子外,外界的刺激也会使其激活,比如紫外线和炎症因子;p38主要被外界的刺激所激活[18].一些学者在P-12细胞株中发现凋亡过程与MAPK信号通路密切相关,p38和JNK被磷酸化而激活会导致细胞的凋亡,而Erk的激活则不会导致细胞凋亡,反而会使细胞存活下来[19].激活后的P-p38和P-JNK由胞质转位到核内分别介导转录因子Max,CREB(cAMP-response element binding protein)和c-jun的活化,共同介导转录因子ATF2(activating transoription factor 2),Elk1的活化,最终引起细胞的凋亡[20].被UVA损伤但没有凋亡的细胞会有很大可能转变为恶性细胞,促进UVA损伤的细胞凋亡可能是治疗皮肤癌的有效手段之一.本研究结果表明,UVA作为外界刺激,可以有效地提高p38和JNK磷酸化水平,但不会导致MAPK通路蛋白总量的增加或减少.因此可以推断,在MAPK通路蛋白总量不变的情况下,UVA的照射导致细胞活力下降是由于UVA诱导细胞凋亡导致的直接结果[21].
TSⅡA使照射UVA的HaCaT细胞进一步凋亡,并致使细胞中的p38和JNK磷酸化水平大大提高,这说明TSⅡA促进UVA诱导的HaCaT细胞凋亡是通过p38和JNK及其下游信号通路介导实现的.已有研究表明,TSⅡA诱导胃癌细胞MKN-45凋亡可能是通过抑制bcl-2的表达和促进p53的表达来实现的[22].何金涛等[23]也发现TSⅡA可以通过上调p53,p21的表达及下调CDKN2(cyclin dependent kinase inhivitor)的表达来抑制人肺腺癌细胞株SPCA-1增殖.这些抑癌基因和促进凋亡基因的表达也严格受p38和JNK的调控.此机制的发现对TSⅡA关于肿瘤的治疗作用具有重要意义,但是TSⅡA作用于损伤或者癌变细胞的初始靶点需要在MAPK信号通路上游继续寻找.
4 结束语
本研究为TSⅡA用于皮肤癌的治疗提供了新方法和一定的理论依据.虽然TSⅡA可以进一步提高UVA诱导的p38和JNK的磷酸化水平,但是尚不能完全确认MAPK通路是TSⅡA促进UVA诱导角质形成细胞凋亡的介导信号,还需要用通路抑制/敲除实验来进一步验证.
[1]Diepgen T L,Mahler V.The epidemiology of skin cancer[J].British Journal of Dermatology,2002,146(S61):1-6.
[2]Silverberg E,Boring C C,SQuires T S.Cancer statistics,1990[J].CA:A Cancer Journal for Clinicians,1990,40(1):9-26.
[3]Armstrong B K,Kricker A.The epidemiology of UV induced skin cancer[J].Journal of Photochemistry and Photobiology B:Biology,2001,63(1/2/3):8-18.
[4]Kwa R E,Campana K,Moy R L.Biology of cutaneous squamous cell carcinoma[J].Journal of the American Academy of Dermatology,1992,26(1):1-26.
[5]Maverakis E,Miyamura Y,Bowen M P,et al.Light,including ultraviolet[J].Journal of Autoimmunity,2010,34(3):J247-J257.
[6]郭坤,赵刚,武志峰,等.UVA对人角质形成细胞的氧化损伤作用[J].齐鲁医学杂志,2003,18(3):239-240.
[7]陈斌,毕志刚.紫外线辐射对皮肤细胞骨架影响的蛋白质组学研究[J].临床皮肤科杂志,2009,38(4):141-144.
[8]Cao E H,Liu X Q,Wang J J,et al.Effect of natural antioxidant tanshinoneⅡ-A on DNA damage by lipid peroxidation in liver cells[J].Free Radical Biology and Medicine,1996,20(6):801-806.
[9]Jiang W,Zhao Y,Zhao B,et al.Studies on the scavenging effect of tanshinone on lipid free radical of cardiac sarcoplasmic reticulum during peroxidation[J].Acta Biophysica Sinica,1994,10(4):685-689.
[10]Yuan S L,Wei Y Q,Wang X J,et al.Growth inhibition and apoptosis induction of tanshinoneⅡ-A on human hepatocellular carcinoma cells[J].World Journal of Gastroenterology,2004,10(14):2024-2028.
[11]Wang X,Wei Y,Yuan S,et al.Potential anticancer activity of tanshinoneⅡA against human breast cancer[J].International Journal of Cancer,2005,116(5):799-807.
[12]Jang S I,Kim H J,Kim Y J,et al.TanshinoneⅡA inhibits LPS-induced NF-kB activation in RAW 264.7 cells:possible involvement of the NIK—IKK,ERK1/2,p38 and JNK pathways[J]. European Journal of Pharmacology,2006,542(1/2/3):1-7.
[13]Dai Z K,Qin J K,Huang J E,et al.TanshinoneⅡA activates calcium-dependent apoptosis signaling pathway in human hepatoma cells[J].Journal of Natural Medicines,2012,66(1):192-201.
[14]Bachelor M A,Silvers A L,Bowden G T.The role of p38 in UVA-induced cyclooxygenase-2 expression in the human keratinocyte cell line,HaCaT[J].Oncogene,2002,21(46):7092-7099.[15]Verbrugge I,Maas C,Heijkoop M,et al.Radiation and anticancer drugs can facilitate mitochondrial bypass by CD95/Fas via c-FLIP downregulation[J].Cell Death and Differentiation,2010,17(3):551-561.
[16]Klotz L O,Pellieux C,Briviba K,et al.Mitogen-activated protein kinase(p38-,JNK-,ERK-)activation pattern induced by extracellular and intracellular singlet oxygen and UVA[J]. European Journal of Biochemistry,1999,260(3):917-922.
[17]周美娟,郑莉,郭玲,等.紫外辐射的细胞生物学效应及其机制[J].生物物理学报,2010,26(11):209-215.
[18]Kyriakis J M,Avruch J.Mammalian mitogen-activated protein kinase signal transduction pathways activated by stress and inflammation[J].Physiological Reviews,2001,81(2):807-869.
[19]Xia Z G,Dickens M,Raingeaud J,et al.Opposing effects of ERK and JNK-p38 MAP kinases on apoptosis[J].Science,1995,270(5240):1326-1331.
[20]Lewis T S,Shapiro P S,Ahn N G.Signal transduction through MAP kinase cascades[J]. Advances in Cancer Research,1998,74:49-139.
[21]Assefa Z,Van Laethem A,Garmyn M,et al.Ultraviolet radiation-induced apoptosis in keratinocytes:on the role of cytosolic factors[J].Biochimica et Biophysica Acta(BBA)-Reviews On Cancer,2005,1755(2):90-106.
[22]Dong X,Dong J,Peng G,et al.Growth-inhibiting and apoptosis-inducing effects of tanshinoneⅡA on human gastric carcinoma cells[J].Journal of Huazhong University of Science and Technology:Medical Sciences,2007,27(6):706-709.
[23]何金涛,周清华.丹参酮对人肺癌细胞株的增殖抑制作用及其分子机理[J].中国肺癌杂志,2002,5(2):123-125.
Effect of tanshinoneⅡA on UVA-induced apoptosis of HaCaT
SHI Wei-gang,LIAO Xian-yan,WENG Xin-chu
(School of Life Sciences,Shanghai University,Shanghai 200444,China)
Human immortalized keratinocytes(HaCaT)were used as materials and effects of ultraviolet A(UVA),tanshinoneⅡA(TSⅡA),and combination of UVA and TSⅡA on cell viability and mitogen-activated protein kinase(MAPK)signaling protein phosphorylation were studied using CCK8 and Western blot respectively.The results showed that UVA at 10 J/cm2lowered cell viability to about 70%of that of control,while 20 J/cm2dose led to further reduction to about 55%.Low concentration TSⅡA had no impact on cell viability,and high concentration TSⅡA(85µmol/L)could decrease cell viability to 75%. When combined together,UVA and TSⅡA significantly exhibited together inhibitory effect on cell viability compared to their individual effects.UVA irradiation elevated the phosphorylation level of p38 and JNK in MAPK cascade,but had no effect on phosphorylation of Erk.TSⅡA could promote phosphorylation of p38 and JNK induced by lowdose UVA(2 J/cm2).The above results indicate that UVA induces HaCaT apoptosis by promoting phosphorylation of p38 and JNK,and in turn,TSⅡA further promotes its phosphorylation and accelerated HaCaT apoptosis.
tanshinoneⅡA(TSⅡA);ultraviolet A(UVA);HaCaT;mitogen-activated protein kinase(MAPK);apoptosis
R 285
A
1007-2861(2015)06-0757-09
10.3969/j.issn.1007-2861.2014.05.004
2014-05-15
翁新楚(1962—),男,教授,博士生导师,研究方向为天然产物的开发与利用等. E-mail:wxch@staff.shu.edu.cn

