二水硫酸钙溶解动力学
王子宁,周加贝,朱家骅,武珲,陈昌国,刘仕忠
二水硫酸钙溶解动力学
王子宁,周加贝,朱家骅,武珲,陈昌国,刘仕忠
(四川大学化学工程学院,四川成都610065)
采用电导率法测量匀速旋转的石膏块试样(CaSO4·2H2O,质量分数为98%)在纯水中的溶解速率,数据采集时间间隔1 s,测试期间试样表观形状(7 cm×4 cm×2 cm)和面积(100 cm2)基本不变。在溶解过程为表面反应控制条件下,依据溶解反应动力学模型,拟合得到25、45、65、85℃下二水硫酸钙溶解反应速率常数分别为1.91×10-8、3.46×10-8、4.92×10-8、7.07×10-8mol·cm-2·s-1,反应级数为1.27。经Arrhenius公式回归得到溶解反应表观活化能为19.07 kJ·mol-1。本实验方法排除了溶解过程试样面积不确定因素,拟合得到的模型参数使动力学方程计算值与实验值更为吻合,更接近溶解速率理论预测文献值。
二水硫酸钙;溶解;动力学;速率常数;活化能
引 言
二水硫酸钙(CaSO4·2H2O)是工业固废磷石膏的主要成分。我国磷化工新增磷石膏堆存量约5000万吨/年,其利用价值随资源环境现状日益严峻而越来越受重视[1-2]。特别是利用其钙离子碳酸化反应,使之有可能大规模用于烟气CO2减排,如氨介质辅助磷石膏-烟气CO2矿化反应生成硫酸铵(化肥)与碳酸钙(建材原料),实现以废治废、循环利用[3]。已经初步探明该矿化反应的控制步骤是磷石膏溶解,如式(1)所示
CaSO4·2H2O(s)Ca2+(aq)2H2O (1)
通常将固体溶解控速步骤分为表面反应控制与扩散控制两种[4]。Raines等[4-5]的研究显示,在流动条件下扩散控制是次要的,通过增加搅拌强度即可消除扩散的影响,使二水硫酸钙溶解过程仅由表面反应控制。对这种情况,Kuechler等[6]的研究表明对溶解速率影响较大的是溶质饱和度(实际浓度与饱和浓度之比)。Jeschke等[7]和Christoffersen等[8]的研究进一步发现,不但溶解速率随饱和度上升而下降,控速步骤也随上升而从表面反应控制逐渐变为扩散控制。Lasaga[9]在表面反应控制条件下建立了溶解动力学方程。
式中,s为溶解速率常数,mol·cm-2·s-1;为溶解反应级数。对式(2)进行数学变换可得到实验数据回归常用的lgs与的线性函数关系
式中,为溶液体积;为参与溶解反应的固体表面积,cm2。用一定温度的溶解速率实验数据通过式(3)拟合,可求得反应级数及溶解速率常数s。进一步通过Arrhenius方程
对s和1/进行线性回归,可以获得表观活化能a和指前因子。
影响溶解速率实验数据准确性的因素较多,包括杂质的影响[10-12],同一晶体不同晶面溶解速率的差异等[13-14]。但与这些影响因素相比,由式(4)可知,溶解试样表面积更为直接地影响溶解速率实验数据s的正确性[15],从而影响溶解速率常数s以及表观活化能a的拟合结果。尽管溶液体积和溶解温度也具有同等程度的影响[16],但其测量准确度容易保证。而试样表面积在溶解过程中若呈不规则变化,则会直接影响溶解速率实验数据的表达,这是二水硫酸钙溶解动力学研究文献数据分散的一大原因。如Liu等[17]的实验使用二水硫酸钙晶体初始大小为80~120 μm,溶解过程中颗粒体积减小约80%,以溶解前的晶体尺寸为基准并视为球形进行表面积修正以处理溶解速率实验数据,回归得到10~30℃温区内溶解活化能为42 kJ·mol-1,与理论预测值18.8 kJ·mol-1存在较大差异。Petrou 等[18-19]也指出颗粒群试样的外形不规则、粒径宽分布等因素均使试样表面积难于准确估算,且颗粒粒径不等其溶解扩散性质受搅拌影响的程度也不同,诸多因素给实验数据处理带来不确定性。
上述研究文献主要集中于地学领域,用以解释二水硫酸钙溶解动力学对地貌特征变迁及预测钙离子随水体迁移的影响,其时间与空间尺度大,上述实验数据分散度在容许范围内。本研究的应用对象是工业反应系统,磷石膏溶解是转化率的控制性步骤,溶解动力学方程是反应器设计的理论依据,因此溶解动力学实验必须排除不确定性因素影响,并把溶解速率测试限制在表面反应控制的单因素条件下进行。为此,本研究选用块状天然二水石膏(CaSO4·2H2O,质量分数大于98%),将其加工为统一大小(7 cm×4 cm×2 cm)的块状试样,表面积为100 cm2,且溶解实验前后其表面积改变Δ低于1.4%,可以认为所测溶解动力学数据排除了面积不确定性因素。通过条件实验对块状试样在纯水中的旋转速度进行筛选,确定转数≥150 r·min-1即可排除扩散对溶解过程的影响,使溶解速率实验在表面反应控制的条件下进行。测试温区范围与工业应用相对应,为25~85℃。
1 实验部分
1.1 实验试剂
主要试剂:钙指示剂(AR),EDTA-2Na(AR),HCl(AR)。天然纯石膏由湖北荆门石膏粉厂提供,CaSO4·2H2O含量大于98%,块状。
1.2 标准石膏块试样制备
将天然石膏(CaSO4·2H2O,质量分数为98%)通过切割得到一批接近标准尺寸的毛胚,再打磨至标准尺寸,最后用超声波水浴清洗5 min除去表面残留物。其标准形状:尺寸7 cm×4 cm×2 cm,表面积约为100 cm2,质量为(128±1)g,在溶解反应中质量损失小于2%,表面积变化小于1.4%。试样尺寸和表面形貌如图1 (a)、(b)所示。

图1 实验系统
1.3 实验装置
如图1 (c)所示,将加工好的块状试样固定在搅拌器桨叶上,置于1000 ml去离子水溶液中,由精密定时电动搅拌器(JJ-1,金坛市荣华仪器制造有限公司)控制其转数。通过恒温水浴锅(HH-501,江苏金坛市新瑞仪器厂)控制溶解温度分别为25、45、65、85℃。实验过程滴加去离子水以补偿蒸发水分散失。用电导率仪(ESC810-F96-B,成都博克斯科技有限公司)测量溶液电导率,由无纸记录仪(DM202-MR,成都博克斯科技有限公司)记录电导率随时间变化曲线,数据采样时间间隔为1 s。
1.4 溶液中钙离子浓度的测定
在25、45、65、85℃下,配制二水硫酸钙的饱和溶液,并用EDTA法(MT/T 202—1995)检测其饱和钙离子浓度分别为15.28、15.99、15.50、13.81 mmol·L-1,温度影响甚微,与手册所载二水硫酸钙溶解度数据一致。将上述每一温度下的饱和溶液等温稀释一定比例,得到若干份不同浓度的标定溶液,测定其电导率,得到一系列与的对应值,如图2所示,其斜率即为该温度下溶液电导率与钙离子浓度的比例系数,与文献[21-22]表达相一致。不同温度下的标定线斜率不一样,但相关系数均在0.988~0.997,线性度很好,表明电导率法测定溶液中钙离子浓度具有可靠的基础。

图2 不同温度下钙离子浓度与二水硫酸钙溶液电导率关系
溶解速率测试实验中电导率仪检测时间间隔为1 s,浓度响应精度为50 μmol·L-1。根据上述各温度下标定的溶液电导率与的比例系数,可以实时检测记录溶液中随时间变化的浓度数据。在此基础上按式(4)将浓度数据对时间微分,并除以试样表面积100 cm2即可得到对应时刻二水硫酸钙的溶解速率s。
在45℃与85℃条件下,控制样品旋转的转数r分别为130、150、200 r·min-1,检测不同搅拌强度下钙离子溶出浓度随时间的变化曲线,如图3所示。观察图3 (a)、(b)所示45℃与85℃下溶出浓度曲线的走势,溶解达饱和之前,r150 r·min-1和r200 r·min-1两条曲线基本重合,且明显高于r130 r·min-1的曲线,表明当r130 r·min-1时溶解过程仍存在扩散阻力,r≥150 r·min-1后扩散阻力基本消除即溶解过程只受表面反应控制。因此后续实验中,将搅拌强度一律设置为r150 r·min-1。

图3 搅拌转数对钙离子溶出浓度的影响
2 结果与讨论
2.1 溶解速率测试结果
控制样品旋转转数r150 r·min-1,测量25、45、65、85℃下二水硫酸钙溶解过程中浓度随时间变化曲线,并按式(4)计算对应时刻的溶解速率s曲线。观察图4,25、45、65和85℃下溶液浓度随时间增加曲线分别在10.8、5.2、5.3、3.2 h达到饱和;与之对应的溶解速率随时间下降曲线分别在上述时刻趋于零。左侧纵坐标显示试样在纯水中的初始溶解速率随温度升高而增大的趋势很显著,溶解温度越高,则溶液中浓度增加越快、s随时间下降曲线越陡、达到饱和所需时间也越短。还可观察到,25、45、65和85℃下s曲线单调平滑下降的时段分别为5.2、2.4、2.1、1.8 h,转折点对应的饱和度分别为0.84、0.81、0.81和0.89,显示了该浓度区间溶解速率s随溶液浓度而变的规律符合动力学方程式(2)。

图4 不同温度下钙离子浓度与溶解速率随溶解时间的变化
2.2 溶解速率常数
利用上述实验数据,根据式(2)以s对作图,各温度下饱和度0~0.8区间内s随变化的曲线如图5所示。根据数学变换式(3)以为横坐标,lgs为纵坐标作图,将图5的曲线转化为图6对数坐标中的直线,通过线性拟合求得直线的斜率即为动力学方程的反应级数,截距为lgs,如图6所示,各条拟合线的线性相关系数均大于0.988。由此得到25、45、65、85℃下二水硫酸钙溶解反应速率常数s分别为1.91×10-8、3.46×10-8、4.92×10-8、7.07×10-8mol·cm-2·s-1,反应级数的变化不大,其均值为1.27。

图5 不同温度下溶出速率与饱和度对应关系
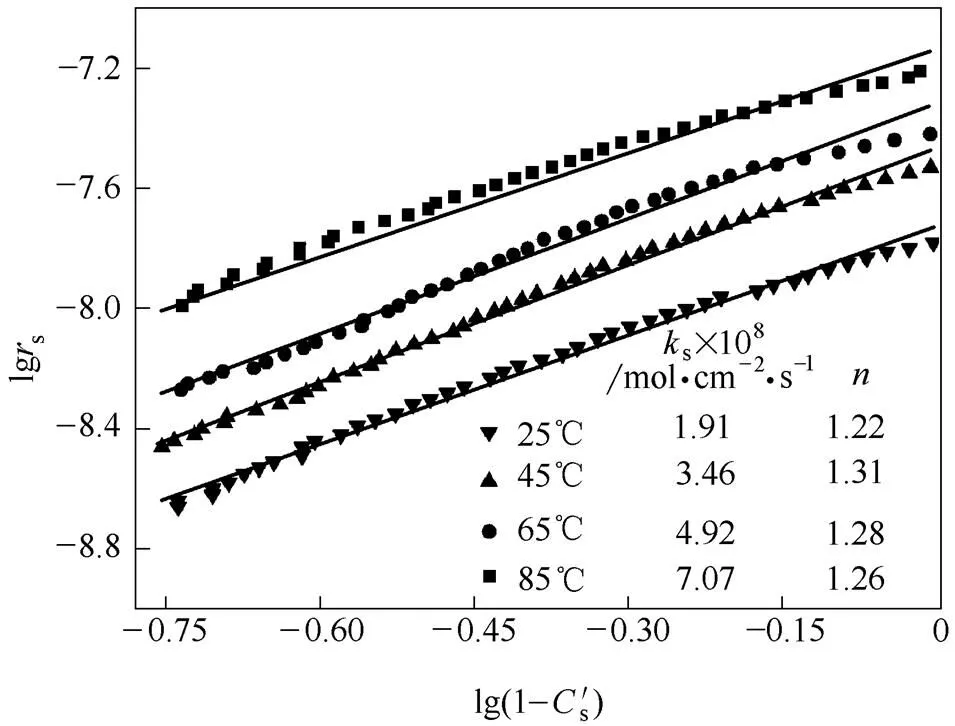
图6 不同温度下lgrs与对应关系及拟合直线
2.3 溶解活化能
二水硫酸钙溶解反应活化能可由不同温度下的溶解反应速率常数s通过Arrhenius方程拟合得到。
根据作业指导书确定的格子大小布灰(12.41m×15.82m,即将路基横向分成2格,每格宽15.82m),每格1车(每车4m3),松铺平均厚2.6cm;装载机配合自卸汽车运灰到路基上,用平地机将石灰摊铺,人工补撒均匀。
根据式(5)的数学变换,以-1为横坐标,lns为纵坐标作图,得到如图7所示的直线,相关系数为0.989。该直线方程的斜率为-a/,截距为ln。由此求得25~85℃温区二水硫酸钙溶解活化能为19.07 kJ·mol-1,指前因子4.38×10-5mol·cm-2·s-1。该活化能的值与文献[17]的拟合值42 kJ·mol-1相比,更接近二水硫酸钙溶解活化能的理论预测值18.8 kJ·mol-1。
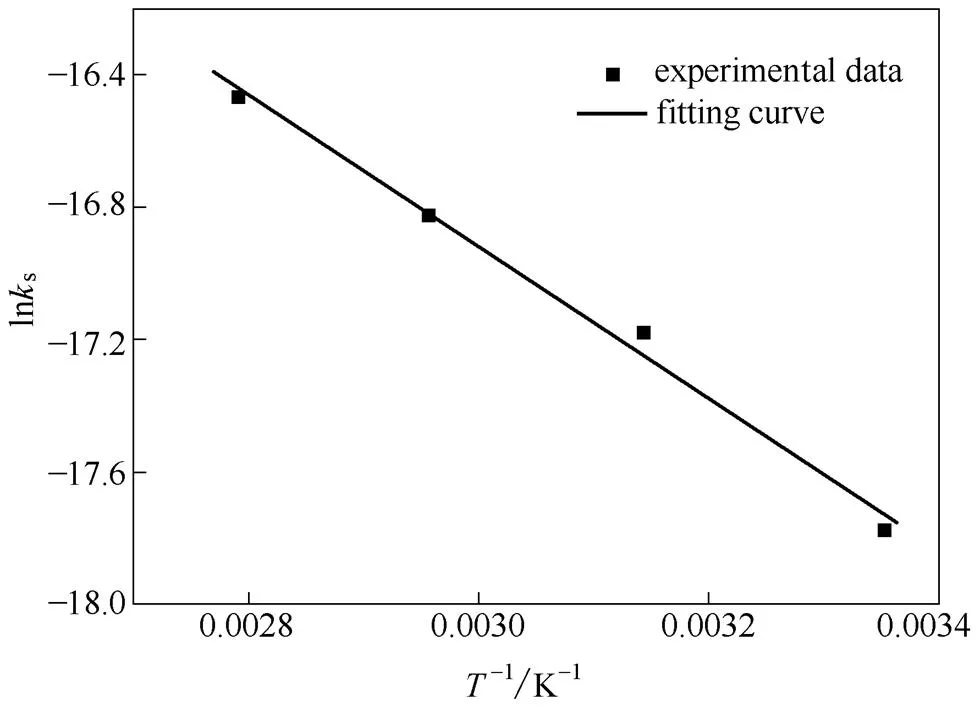
图7 不同温度下lnks与T-1的对应关系及拟合直线
将a和值代入式(5)可得25~85℃温区、饱和度0~0.8区间内二水硫酸钙溶解反应速率常数s与温度的关系式
为验证拟合结果的表达精度,将式(6)代入式(2)计算25~85℃下与s对应的关系曲线,并与实验值对比如图8所示,可见其吻合度较好,平均相对偏差<8.72%。
图8s实验值与拟合方程计算值的对比Fig.8 Comparisons of between experimental values and calculating results at 25—85℃
3 结 论
符 号 说 明

A——指前因子,mol·cm-2·s-1 ——溶液饱和度,实际钙离子浓度与平衡浓度之比 ——溶液中的钙离子浓度,mol·L-1 ——溶液平衡时的钙离子浓度,mol·L-1 ——溶液中的硫酸根离子浓度,mol·L-1 Ea——活化能,kJ·mol-1 n——反应级数 ——搅拌桨转数,r·min-1 rs——溶解速率,mol·cm-2·s-1 ——t0时,二水硫酸钙在溶液中的初始溶解速率,mol·cm-2·s-1 T——温度,K V——二水硫酸钙溶液总体积,本实验中V1 L ——电导率,μS·cm-1
References
[1] Tayibi H, Choura M, López F A, Alguacil F J, López-Delgado A. Environmental impact and management of phosphogypsum [J]., 2009, 90 (8): 2377-2386
[2] Battistoni P, Carniani E, Fratesi V, Balboni P, Tornabuoni P. Chemical-physical pretreatment of phosphogypsum leachate [J]., 2006, 45 (9): 3237-3242
[3] Zhu Jiahua (朱家骅), Xie Heping (谢和平), Xia Sulan (夏素兰), Liang Bin (梁斌), Huang Weixing (黄卫星). One step conversion technology of carbon dioxide and phosphogypsum [P]: CN, 201210223218.4. 2012-10-22
[4] Raines M A, Dewers T A. Mixed transport reaction control of gypsum dissolution kinetics in aqueous solutions and initiation of gypsum karst [J]., 1997, 140 (1/2): 29-48
[5] Raines M, Dewers T. Reply to comment on: mixed transport/reaction control of gypsum dissolution kinetics [J]., 2000, 168 (3/4): 275-278
[6] Kuechler R, Noack K, Zorn T. Investigation of gypsum dissolution under saturated and unsaturated water conditions [J]., 2004, 176 (1/2):1-14
[7] Jeschke A A, Vosbeck K, Dreybrodt W. Surface controlled dissolution rates of gypsum in aqueous solutions exhibit nonlinear dissolution kinetics [J]., 2001, 65 (1): 27-34
[8] Christoffersen J, Christoffersen M R. The kinetics of dissolution of calcium sulphate dihydrate in water [J]., 1976, 35 (1): 79-88
[9] Lasaga A C. Kinetic Theory in the Earth Sciences [M]. Princeton: Princeton University Press, 1998: 2-15
[10] Bosbach D, Junta-Rosso J L, Becker U, Hochella-Jr M F. Gypsum growth in the presence of background electrolytes studied by scanning force microscopy [J]., 1996, 60 (17): 3295-3304
[11] Fisher R D, Mbogoro M M, Snowden M E, Joseph M B, Covington J A, Unwin P R, Walton R I. Dissolution kinetics of polycrystalline calcium sulfate-based materials: influence of chemical modification [J]., 2011, 3 (9): 3528-3537
[12] Ni Liping (倪丽萍), Li Huping (李沪萍), Luo Kangbi (罗康碧), Xie Weiping (谢卫苹), Su Yi (苏毅). Research of the dissolution and phase behavior change on the phosphogypsum in the low concentration of sulfuric acid [J].(化工进展), 2014, 33 (3): 769-772
[13] Bosbach D, Jordan G, Rammensee W. Crystal-growth and dissolution kinetics of gypsum and fluorite—an-scanning force microscope study [J]., 1995, 7 (2): 267-276
[14] Mbogoro M M, Snowden M E, Edwards M A, Peruffo M, Unwin P R. Intrinsic kinetics of gypsum and calcium sulfate anhydrite dissolution: surface selective studies under hydrodynamic control and the effect of additives [J]., 2011, 115 (20): 10147-10154
[15] Zhou Lu (周鲁). A Textbook of Physical Chemistry (物理化学教程) [M]. Beijing: Science Press, 2012:87-89
[16] He Yu’e (何玉萼), Yuan Yongming (袁永明), Dong Dongmei (董冬梅). Physicalchemistry (物理化学) [M]. Beijing: Chemical Industry Press, 2006:34-37
[17] Liu S T, Nancollas G H. The kinetics of dissolution of calcium sulfate dihydrate [J]., 1971, 33 (8): 2311-2316
[18] Petrou A L, Terzidaki A. Calcium carbonate and calcium sulfate precipitation, crystallization and dissolution: evidence for the activated steps and the mechanisms from the enthalpy and entropy of activation values [J]., 2014, 381: 144-153
[19] Truesdale V W. Generic issues of batch dissolution exemplified by gypsum rock [J]., 2011, 17 (1): 21-50
[20] Hamann C H, Wolf Vielstich A H. Electrochemistry (电化学) [M]. Beijing: Chemical Industry Press, 2009:16
[21] Truesdale V W. Unifying batch-dissolution kinetics for salts: probing the back reaction for gypsum and calcite by means of the common-ion effect [J]., 2012, 18 (3): 217-241
[22] Frenkel H, Gerstl Z, Alperovitch N. Exchange-induced dissolution of gypsum and the reclamation of sodic soils [J]., 1989, 40 (3): 599-611
Dissolution kinetics of calcium sulfate dihydrate
WANG Zining, ZHOU Jiabei, ZHU Jiahua, WU Hui, CHEN Changguo, LIU Shizhong
School of Chemical EngineeringSichuan UniversityChengduSichuanChina
Dissolution rate of a gypsum (CaSO4·2H2O) sample rotating in pure water was measured by automatically detecting electric conductivity of the solution, in one-second time interval of data acquisition. Superficial shape (7 cm×4 cm×2 cm) and surface area (100 cm2) of the sample were maintained constant basically during measurement. Under surface reaction-controlled dissolution experiment condition, the kinetics model was used for regression of dissolution rate constant (s) and reaction order (). The values ofswere 1.91×10-8, 3.46×10-8, 4.92×10-8, 7.07×10-8mol·cm-2·s-1respectively for temperatures 25, 45, 65, 85℃, accommodated by a value of 1.27 for reaction order. Consequently activation energy of dissolution reaction was correlated 19.07 kJ·mol-1through the Arrhenius equation. Because of eliminating uncertainty of sample’s surface area in dissolution experiment, the results calculated from the kinetics equation with the model parameters regressed in this paper were more consistent with experimental value and closer to theoretical expectation of dissolution rates in literature.
calcium sulfate dihydrate; dissolution; kinetics; rate constants; activation energy
2014-07-16.
Prof. ZHU Jiahua, jhzhu@scu.edu.cn
10.11949/j.issn.0438-1157.20141069
TQ 09;X 7
A
0438—1157(2015)03—1001—06
国家科技支撑计划项目(2013BAC12B01)。
2014-07-16收到初稿,2014-12-09收到修改稿。
联系人:朱家骅。第一作者:王子宁(1985—),男,博士研究生。
supported by the National Key Technology R&D Program of China (2013BAC12B01).

