水蒸气对煅烧石灰石碳酸化反应影响的实验与模型分析
刘洋,杨勇平
水蒸气对煅烧石灰石碳酸化反应影响的实验与模型分析
刘洋,杨勇平
(华北电力大学能源动力与机械工程学院,北京102206)
利用热重分析仪,对比了不同反应温度、不同水蒸气浓度对煅烧石灰石碳酸化反应的影响。碳酸化反应温度在500℃时,反应初期水蒸气对碳酸化反应的影响并不明显,反应10 min之后,在含有1.5%、10%和20%(体积分数)水蒸气条件下碳酸化转化率比无水蒸气条件下转化率分别提高了19.8%、27.2%和30.5%。水蒸气的存在有助于提高碳酸化反应转化率,但随着水蒸气浓度的增加转化率增加幅度减小。利用随机孔隙模型,对产物层扩散阶段扩散系数及反应活化能进行了计算。高温条件下,气氛中含有1.5%的水蒸气使反应活化能从237.7 kJ·mol-1降低到179.9 kJ·mol-1,提高水蒸气浓度到10%和20%后,反应活化能从156.6 kJ·mol-1降低到148.6 kJ·mol-1。不同水蒸气浓度条件下,碳酸化反应存在两个明显特征:一是大约在550℃处存在一个明显扩散系数的斜率变化,这一温度与气氛中是否存在水蒸气无关;另一特征是随着反应温度的提高,水蒸气的促进作用减弱。依据实验和模型计算结果,推测了当反应处于产物层扩散阶段时水蒸气对碳酸化反应影响的作用机理。
二氧化碳捕集;化学反应;催化;产物层扩散系数;活化能
引 言
煅烧后的石灰石与CO2的碳酸化反应是煤气化制氢、吸收增强式甲烷重整、吸收增强式水气变换过程中的重要反应步骤,也可以应用于烟气中CO2捕集等方面,因此受到了国内外研究人员的广泛关注。反应式为
CaO(s)+CO2(g)CaCO3(s) (1)
近年来国内外学者分别利用固定床或者流化床反应器,对比了碳酸化反应过程中水蒸气对碳酸化反应的影响,发现添加水蒸气后可明显提高吸收剂吸收CO2的能力[1-3]。这些实验结果表明,水蒸气可以显著提高钙基吸收剂循环吸收CO2的能力。因此可以采用添加水蒸气的方式提高吸收剂的吸收能力,无须对吸收剂本身进行预处理或改性,降低了吸收CO2的成本。在吸收增强式甲烷重整、吸收增强式水气变换中,由于存在一定含量的水蒸气,而水蒸气对碳酸化反应的促进作用增强,有利于在更宽的范围内选择反应温度。
对于水蒸气对碳酸化反应的促进作用存在不同的机理认识:最早在20世纪70年代Dobner等[4]研究了在水蒸气存在条件下煅烧白云石的碳酸化反应,发现水蒸气具有催化CaO与CO2反应的能力,尤其在低温条件下(~550℃)更为明显。Wang等[5]认为瞬间形成的Ca(OH)2是水蒸气促进碳酸化反应的原因,而Yang等[6]通过比较Ca(OH)2与CO2和CaO与CO2的反应速率认为Ca(OH)2不是加快碳酸化反应的原因。Manovic等[7-8]根据实验结果否认水蒸气的催化作用,而是认为其作用在于提高扩散阶段反应速率。从目前发表的相关文献中可以看出,研究人员对水蒸气对碳酸化反应机理的认识存在明显的分歧。
为确定水蒸气对碳酸化反应的作用规律,还需要选择合适的反应模型。目前水蒸气对碳酸化反应影响的研究大都为定性分析,缺乏动力学参数对比,为准确反映水蒸气的作用规律,必须选择合适的反应模型以获取动力学参数。与未反应缩核模型[9]和微粒模型[10]相比,孔隙模型可以准确反映碳酸化反应界面相互交叉,孔隙结构同时发生变化这一过程。而由Bhatia等[11-12]和Gavalas[13]同时提出的随机孔隙模型认为吸收剂颗粒内部由一系列分配特征的孔隙随机交叉所组成,可以利用结构参数计算化学反应速率及产物层扩散速率。本文采用随机孔隙模型分析水蒸气对碳酸化反应的作用规律,重点计算产物层扩散速率。在采用随机孔隙模型时,反应体系中不应包含除碳酸化以外的其他反应。根据热力学分析,当水蒸气浓度低于平衡浓度时,并不会与CaO反应[14]。此时虽然存在水蒸气,然而在宏观层面上只有CaO与CO2的碳酸化反应发生。在此条件下,利用随机孔隙模型研究CaO与包含CO2和水蒸气的混合气体反应,建立水蒸气浓度与碳酸化产物层扩散速率的定量关系才有其合理性。
本文采用天然石灰石,利用热重分析仪研究在不同温度条件下,不同水蒸气浓度对碳酸化反应的影响规律。利用压汞实验,通过计算确定样品碳酸化反应初始条件下单位体积孔长度、比表面积和孔隙率。利用随机孔隙模型,分析碳酸化反应实验数据。通过比较不同水蒸气浓度条件下产物层厚度、产物层扩散系数以及活化能大小,确定水蒸气对碳酸化反应作用阶段及作用规律,本文重点分析扩散阶段反应速率。
1 计算模型
考虑球形煅烧后石灰石与气体反应物CO2发生气固反应,假定固体反应物内部由一致的孔隙组成。反应初始发生在孔边界上,导致颗粒内部径向表面积的增长。反应产物CaCO3聚集在反应表面和孔边界之间,阻碍了气体反应物进一步向固体反应物的扩散。在反应进行中,临近的表面积相互交叉,伴随着反应表面积逐渐减少。
假定反应表面是由一系列具有孔径分配()的圆柱形孔的随机交叉组成,()d是单位体积空间半径在和d之间圆柱表面积的总长度。在任何半径位置增长的圆柱形孔的孔径分配存在如下关系
由于碳酸化反应是可逆反应,反应速率是反应气体A浓度与平衡浓度之差的一阶函数并正比于反应表面积,则有
并且
式中,是气体反应物CO2的浓度,e是CO2平衡浓度,假定在颗粒内部任意半径位置的反应表面上浓度都相同。-e代表了气体A在整个反应表面的有效浓度。
基于上面的关系,圆柱形孔的总长度0、表面积0和体积0适用于确定反应速率,可以得到
结构参数由式(6)定义
其中
定义反应过程形成的产物体积与反应物体积之比是,则有
-=(-0) (9)
结合式(4)和式(9)得到形成反应物的速率为
定义为扩散产物层平均厚度,并且认为远小于反应表面尺寸
结合式(10)和式(11)可以得到
由式(5)和式(12)可以得到
考虑到当初始=0时,=0,积分得到
式(14)表达了在任意转化率时,有效产物层厚度。考虑到反应气体A的质量平衡,有
结合式(5)、式(14)和式(15),可以得到反应速率表达式
在产物层扩散阶段,由于→∞,因此式(16)可以积分为
其中
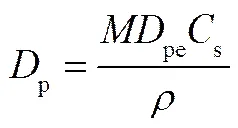
2 实 验
2.1 热重实验
实验采用妙峰山石灰石(MFS),煅烧温度为900℃,碳酸化温度为400~700℃。每次实验时,质量约为10 mg的石灰石样品平铺在样品盘内。CO2气体体积分数为20%,其余气体为氮气。采用将CO2气体通过洗气瓶的方式添加水蒸气,将洗气瓶放入恒温油浴锅中,通过控制油浴温度控制携带水蒸气含量。设定油浴温度分别为20、45、60℃,对应的气体中水蒸气体积分数为1.5%、10%和20%。为防止水蒸气在管路中冷凝,从洗气瓶出口到TGA进口缠上伴热带,温度控制在100℃。在进行碳酸化反应之前,提前30 min将CO2和水蒸气混合,通过旁路排空以保证水蒸气浓度准确。碳酸化反应结束后,将CO2气体切入旁路,TGA通入氮气排空反应炉中残存的水蒸气以确保安全。
TGA实验同时得到时间、质量和温度3组数据。在碳酸化反应过程中,样品与通入的气体反应导致质量增加,从增重点开始进行转化率的计算
式中,0表示样品煅烧后的原始质量,g;p为样品纯度,样品中的杂质不参与碳酸化反应;m为时刻样品的质量,g。
2.2 钙基吸收剂
MFS石灰石在破碎机中破碎,然后用标准筛筛分成粒径为100~200mm的颗粒,采用X射线荧光光谱仪(型号为Rigaku ZSX Primus Π)测量样品成分。样品经过煅烧后,利用压汞仪(型号为AutoPore IV9510)测量孔隙结构。表1列出了样品成分质量分数组成及孔隙结构参数。

表1 石灰石成分组成及煅烧石灰石孔结构参数Table 1 Compositional characteristics of limestone and pore structure parameters of calcined limestone
3 实验结果与讨论
当气氛中存在CO2和水蒸气时,煅烧的石灰石会与高于平衡分压的CO2和水蒸气分别反应生成CaCO3和Ca(OH)2。图1显示了利用HSC软件计算的碳酸化反应和活化反应气体平衡分压结果。利用软件计算发现,在温度650℃时,使CaO反应产生氢氧化钙的水蒸气压力高于一个大气压。因此在碳酸化反应通常所选取的这一温度,无论水蒸气浓度高低,在常压下不会有氢氧化钙的形成。而在400℃和450℃时,利用软件计算得到的水蒸气平衡浓度约为8.2%和19.3%。从热力学平衡分压角度看,水蒸气压力高于平衡分压时可以反应生成Ca(OH)2,低于平衡分压时不生成Ca(OH)2。在同时存在CO2和高于平衡分压的水蒸气的条件下,CaO可以与CO2反应生成CaCO3,也可以先与水蒸气反应生成Ca(OH)2,再与CO2反应生成CaCO3。由于碳酸化反应路径发生变化,在研究水蒸气对碳酸化反应时无法形成比较的基础。在利用模型进行计算时,无法有效地对比碳酸化反应速率,因此在研究水蒸气对碳酸化反应影响时需要剔除400℃时水蒸气浓度10%和20%两个实验点以及450℃时水蒸气浓度20%的实验点。而对于含有1.5%的水蒸气的反应气氛,在400~700℃范围内均不会形成Ca(OH)2。在选择的温度范围内,20%的CO2压力均高于碳酸化反应平衡分压。本研究的CO2及水蒸气压力范围在图1所示的两条平衡分压线之间,保证CaO在宏观上仅与CO2反应生成CaCO3。
3.1 水蒸气浓度对碳酸化反应速率的影响
图2显示了在500℃时水蒸气浓度对碳酸化反应影响。在反应的初始阶段,不同水蒸气浓度条件下转化率曲线相互重合,水蒸气对碳酸化反应的影响可以忽略。在反应10 s之后,可以看到水蒸气的存在明显减缓了碳酸化反应速率的下降。而且随着水蒸气浓度的增加转化率有所增加,但增加幅度减弱。在反应10 min之后,含有1.5%、10%和20%的水蒸气条件下碳酸化转化率比无水蒸气条件下转化率分别提高了19.8%、27.2%和30.5%。
对于水蒸气对碳酸化反应的作用,Wang等[15]和Symonds等[16]认为水蒸气在碳酸化过程中起到催化作用,即水蒸气会与CaO反应瞬间形成Ca(OH)2,而Ca(OH)2比CaO具有更高的活性。也就是说,在被化学反应动力学所控制的快速反应阶段,反应速率由于水蒸气的存在而提高。然而这一推测受到一些学者的质疑,Yang等[6]在研究低水蒸气浓度对碳酸化反应催化能力时观察到,CaO与水蒸气反应生成Ca(OH)2,再与CO2反应的速率明显低于CaO和CO2反应的速率。因此,由于Ca(OH)2的形成造成反应速率提高的推测并不准确。除此之外,在碳酸化反应的初始阶段,可能包含反应气体在样品颗粒之间的外扩散、化学反应以及内扩散等步骤。表观反应速率由最慢的步骤决定,而化学反应速率这一步骤比其他扩散步骤快得多[17],化学反应速率步骤反应速率的提高并不一定促进整体转化率的提高。本实验在初始反应阶段的实验结果显示,在快速反应阶段水蒸气并没有促进碳酸化反应发生。图2显示在反应10 s之后,实验结果明显体现出水蒸气对碳酸化反应的影响。在此反应阶段,可能存在反应气体在样品颗粒孔隙内部扩散以及产物层扩散。Bhatia等[18]在研究产物层对CaO与CO2的影响中发现,对于粒径为125~149mm的吸收剂颗粒具有与74~88mm几乎重合的转化率曲线,表明采用粒径100~200mm的样品孔隙内扩散的影响并不大,因此本文认为水蒸气对碳酸化反应促进作用主要发生在产物层扩散阶段。
3.2 不同水蒸气浓度产物层厚度的计算
CaCO3产物层的厚度对碳酸化反应是一个重要参数,产物层厚度计算公式[19]如下
图3显示了不同水蒸气浓度条件下,在d/d下降到0.02时碳酸化反应产物层厚度与反应温度关系。从图中可以看出,在一定的水蒸气浓度时,产物层厚度随温度的提高而增加。在没有水蒸气存在条件下,400℃时产物层厚度只有6.4 nm,当反应温度提高到700℃,产物层厚度增加到23.2 nm。在同一反应温度,提高水蒸气浓度,产物层厚度相应增加,在低温时尤为明显。400℃时,即便存在微量的水蒸气仍然使产物层厚度从6.4 nm增加到13.1 nm。但随着水蒸气浓度的不断提高,产物层厚度的增加变得不明显。随着温度的提高,不同水蒸气浓度下产物层随温度变化曲线会相交于一点,这表明即便没有水蒸气的存在,提高温度也能起到类似的作用。关于反应温度对碳酸化产物层的影响将在后面进行讨论。
3.3 不同水蒸气浓度扩散参数计算
假定反应速率较慢的第2个阶段被产物层扩散所控制,那么根据式(17),产物层扩散速率可以由与时间的平方根的斜率计算得到,这一推测被图4的数据关系所证实。图4对比了在1.5%水蒸气条件下,不同温度所对应的扩散速率的大小,遵循线性关系的转化率在45%~60%之间。表2显示了不同水蒸气浓度不同反应温度条件下,根据式(17)所计算的斜率。

表2 碳酸化反应有效扩散系数及活化能Table 2 Effective product layer diffusivities and activation energy for carbonation
对于某一反应温度,在反应的初期和末期均存在非线性部分。这是由于在碳酸化反应的初期存在碳酸化反应的诱导期以及可能由气体外扩散和化学反应速率步骤决定的初始反应较快的反应阶段。而在碳酸化反应的末期,由于吸收剂颗粒内部孔隙的闭合导致扩散面积的减小,因此最后阶段斜率也产生了偏差。这一推测也可以从Manovic等[7]的实验结果得到证实,他们比较了8种不同的石灰石样品,发现无论石灰石在N2还是在CO2气氛中煅烧,水蒸气的存在均会提高碳酸化转化率。然而石灰石在CO2中煅烧对碳酸化过程中水蒸气的影响更为明显,而在N2中煅烧虽然转化率更高,但影响并不明显。这是由于石灰石在CO2中煅烧时更容易发生烧结现象,产生更大的孔隙,使得在碳酸化过程中孔隙并不容易堵塞[20],在此条件下水蒸气的作用显得更为明显。
3.4 不同水蒸气浓度所对应反应活化能的计算
不同水蒸气浓度条件下有效扩散系数根据式(17)计算得到,产物层扩散阶段碳酸化反应活化能也由此得到。不同水蒸气浓度条件下,碳酸化反应活化能见表2。图5显示出两个关于扩散系数的特征,首先大约在550℃处存在一个明显的斜率变化,这一温度与气氛中是否存在水蒸气无关。当反应温度从400℃升高到700℃,在550℃处斜率增加,这表明在高于550℃后反应机理发生了变化。高温条件下,1.5%水蒸气的存在使得无水蒸气条件下碳酸化反应活化能从237.7 kJ·mol-1降低到179.9 kJ·mol-1,继续提高水蒸气浓度到10%和20%,反应活化能从156.6 kJ·mol-1降低到148.6 kJ·mol-1。
对比活化能可以发现,提高水蒸气浓度降低了碳酸化反应活化能,但继续增加水蒸气浓度,活化能的降低速度减弱。对比图5的高温区域扩散系数的斜率,碳酸化反应的另一个特征是随着反应温度的提高,水蒸气的促进作用减弱,可以预计的是当温度足够高,不同浓度水蒸气条件下扩散系数的直线必然相交一点。从图5中观察到的现象与临界产物层厚度趋势一致,不同水蒸气浓度下临界产物层随温度变化曲线会相交于一点,反应温度可以起到与水蒸气添加类似的作用。
有证据表明产物层扩散过程是一个固体状态反应过程:在产物层中较低的扩散系数和较高的活化能并不可能是由气体分子扩散导致;活化能的改变发生在550℃处,与CaCO3的Tamman温度(527℃)非常接近;实验结果与固体CaCO3中导电现象非常相似。Bhatia等[18]认为CO32-及O2-构成在CaCO3中相对运动的离子对,而在反应过程中保持产物层电中性。他们推测在CaO-CaCO3界面上发生如下反应
CO32-+CaOCaCO3+ O2-(20)
而在孔隙表面为
CO2(g)(CO2)ads(21)
(CO2)ads+ O2-CO32-(22)
在CO2分压远高于平衡分压条件下,根据这一机制,在反应表面上吸收气体的能力达到饱和,而在两个反应表面上达到了反应平衡。随着温度的提高,O2-及CO32-的扩散速率加快,导致了碳酸化反应速率的提高,同时也促进了产物层厚度的增加。
根据不同水蒸气浓度下活化能的计算,在产物层扩散阶段,水蒸气的添加导致碳酸化反应活化能下降。水蒸气的质量在反应过程中并不减少,因此水蒸气有可能起到催化作用。水蒸气浓度增加,活化能减少,但减少的幅度逐渐下降,表明水蒸气浓度的影响受到反应条件的限制。因此本文提出,在水蒸气存在条件下,除存在以上的离子扩散之外,在孔隙表面还可能存在
H2O+CO2=2H++ CO32-(23)
2H++ O2-=H2O (24)
在反应表面发生
CO32-+CaO= CaCO3+ O2-(25)
在孔隙表面,水蒸气和CO2发生弱电离,产生碳酸根离子。表面产物层的CaCO3吸附电离的碳酸根离子,原来形成CaCO3的碳酸根离子向内部扩散。在反应表面碳酸根离子与CaO反应产生氧离子,为保持电中性,氧离子向外扩散直到孔隙表面,并与氢离子反应重新生成水蒸气,这样在整个循环过程中,水蒸气从宏观角度并不发生变化,仅是促进了CO2与CaO的反应。在产物层扩散阶段碳酸化反应在存在及不存在水蒸气条件下的示意图如图6所示。
Sun等[21]使用标记实验证实了碳酸化反应过程中离子外扩散机理,即CaO中的O2-外扩散,而CO32-内扩散。当气相中含有水蒸气时,除了这一扩散之外,还有可能存在水蒸气和CO2的电离过程。在孔隙表面电离出的碳酸根离子增加了物质转移速率,在反应界面形成的O2-向外扩散与H+重新生成H2O,使得水蒸气本身数量并不发生变化,而是起到促进作用。随着水蒸气浓度的增加,碳酸根离子增加,导致碳酸化反应速率增加,然而继续增加水蒸气浓度则对反应速率的增加作用减弱。当反应温度提高后,水蒸气与CO2的电离作用增强,可以产生更多的CO32-参与反应,同样也提高了碳酸化速率。
对于在高于550℃后碳酸化反应机理发生了变化,Bhatia等[18]根据反应活化能接近CaCO3煅烧所需热量推测,在较高温度下,CO2在产物层中以连续CaCO3分解的方式向内部扩散。即已形成的CaCO3中的CO32-在高温条件下瞬间分解,形成CO2和O2-,CO2分子移动到相邻的空位上,而同样生成的CO2分子占据原来的位置,重新生成CaCO3,这一CO2分子这样通过不同位点在产物层内扩散,最后到达CaO-CaCO3反应表面。本文认为在较高温度时,即便CaCO3并不分解,可逆的CaCO3=CaO+CO2反应也存在动态平衡。碳酸化反应根本仍然是CO32-在产物层内的扩散过程,由于高温条件下部分CaCO3并不稳定,因此加剧了CO32-在径向产物层扩散的难度,导致碳酸化反应活化能提高。
4 结 论
天然石灰石经过煅烧后,通过比较不同水蒸气浓度对碳酸化反应的影响,结合随机孔隙模型的分析,得到如下结论。
(1)碳酸化反应温度为500℃时,10 min之后在水蒸气含量在1.5%、10%和20%的条件下碳酸化转化率比无水蒸气条件下转化率分别提高了19.8%、27.2%和30.5%。在初始的快速反应阶段,水蒸气并不能明显提高碳酸化反应速率,明显的促进作用主要发生在产物层扩散阶段。
(2)在相同的碳酸化反应温度条件下,提高水蒸气浓度,碳酸化反应产物层厚度相应增加,在低温时尤为明显。400℃时,即便存在微量的水蒸气便使产物层厚度从6.4 nm增加到13.1 nm。随着水蒸气浓度的不断提高,产物层厚度的增加速度变慢。不同水蒸气浓度下产物层厚度随温度变化曲线会相交于一点,表明随着水蒸气浓度的增加,对碳酸化反应的促进作用减弱。
(3)在产物层扩散阶段,水蒸气的存在导致碳酸化反应活化能下降。但随着水蒸气浓度增加,下降的幅度减缓。当反应温度从400℃升高到700℃过程中,活化能在550℃处发生突变,表明在高于550℃后反应机理发生了变化。
致谢:感谢中澳第二轮低排放煤炭技术研究基金的支持。
符 号 说 明

C——CO2浓度,kmol·m-3 Ce——CO2平衡浓度,kmol·m-3 Ci——在反应界面CO2浓度,kmol·m-3 Cs——孔表面扩散浓度,kmol·m-3 Dp——扩散系数,m2·s-1 Dpe——有效扩散系数,m2·s-1 kS——表面反应速率系数,m4·mol-1·s-1 L0——t=0时单位体积孔隙总长度,m M——CaO摩尔质量,kg·mol-1 MCaCO3——CaCO3摩尔质量,kg·mol-1 MCaO——CaO摩尔质量,kg·mol-1 r——圆孔表面半径,m S——单位体积反应表面积,m2·m-3 S0——t=0时单位体积表面积,m2·m-3 V——单位空间反应表面包括的孔体积,m3·m-3 V0——t=0时孔体积,m3·m-3 v0——孔体积分配函数 X——碳酸化转化率 Z——生成物与反应物体积比 b——毕沃模量 D——产物层有效厚度,m e——孔隙率 e 0——t=0时孔隙率 y——结构参数 r——单位体积CaO质量,kg·m-3 rb——固体堆密度,kg·m-3
References
[1] Donat F, Florin N H, Anthony E J, Fennell P S. Influence of high-temperature steam on the reactivity of CaO sorbent for CO2capture [J].,2012, 46(2): 1262-1269
[2] Chen Huichao (陈惠超), Zhao Changsui (赵长遂), Shen Peng (沈鹏). Effect of steam in flue gas on CO2capture for calcium based sorbent [J].(化工学报),2013, 64(4): 1364-1372
[3] Wang Chunbo (王春波), Zhou Xing (周兴), Zheng Zhimin (郑之民), Cui Caiyan (崔彩艳), Chen Liang (陈亮). Influence of steam on the limestone calcination/carbonation looping cycle for CO2capture [J].(中国电机工程学报),2014, 34(8): 1224-1230
[4] Dobner S, Sterns L, Graff R A, Squires A M. Cyclic calcination and re-carbonation of calcined dolomite [J].,1977, 16(4): 479-486
[5] Wang C B, Jia L F, Tan Y W, Anthony E J. Carbonation of fly ash in oxy-fuel CFB combustion [J].,2008, 87(7): 1108-1114
[6] Yang S J, Xiao Y H. Steam catalysis in CaO carbonation under low steam partial pressure [J].,2008, 47(12): 4043-4048
[7] Manovic V, Anthony E J. Carbonation of CaO-based sorbents enhanced by steam addition [J].,2010, 49(19): 9105-9110
[8] Manovic V, Fennell P S, Al-Jeboori M J, Anthony E J. Steam-enhanced calcium looping cycles with calcium aluminate pellets doped with bromides [J].,2013, 52(23): 7677-7683
[9] Homma S, Ogata S, Koga J, Matsumoto S. Gas-solid reaction model for a shrinking spherical particle with unreacted shrinking core [J].,2005, 60(18): 4971-4980
[10] Khoshandam B, Kumar R V, Allahgholi L. Mathematical modeling of CO2removal using carbonation with CaO: the grain model [J].,2010, 27(3): 766-776
[11] Bhatia S K, Perlmutter D D. A random pore model for fluid-solid reactions(Ⅰ): Isothermal, kinetic control [J].,1980, 26(3): 379-386
[12] Bhatia S K, Perlmutter D D. A random pore model for fluid-solid reactions(Ⅱ): Diffusion and transport effects [J].,1981, 27(2): 247-254
[13] Gavalas G R. A random capillary model with application to char gasification at chemically controlled rates [J].,1980, 26(4): 577-585
[14] Fennell P S, Davidson J F, Dennis J S, Hayhurst A N. Regeneration of sintered limestone sorbents for the sequestration of CO2from combustion and other systems [J].,2007, 80(2): 116-119
[15] Wang C B, Jia L F, Tan Y W, Anthony E J. The effect of water on the sulphation of limestone [J].,2010, 89(9): 2628-2632
[16] Symonds R T, Lu D Y, Hughes R W, Anthony E J, Macchi A. CO2capture from simulated syngascyclic carbonation/calcination for a naturally occurring limestone: pilot-plant testing [J].,2009, 48(18): 8431-8440
[17] Duo W, Sevill J P K, Kirkby N F, Clift R. Formation of product layers in solid-gas reactions for removal of acid gases [J].,1994, 49(24A): 4429-4442
[18] Bhatia S K, Perlmutter D D. Effect of the product layer on the kinetics of the CO2-lime reaction [J].,1983, 29(1): 79-86
[19] Barker R. Reversibility of reaction CaCO3reversible CaO+CO2[J].,1973, 23(10): 733-742
[20] Stewart M C, Manovic V, Anthony E J, Macchi A. Enhancement of indirect sulphation of limestone by steam addition [J].,2010, 44(22): 8781-8786
[21] Sun Z, Luo S, Qi P, Fan L S. Ionic diffusion through calcite (CaCO3) layer during the reaction of CaO and CO2[J].,2012, 81(22): 164-168
Experimental and model study of carbonation of calcined limestone in presence of steam
LIU Yang, YANG Yongping
School of EnergyPower and Mechanical EngineeringNorth China Electric Power UniversityBeijingChina
Steam is present in combustion flue gas, oxy-fuel combustor/calciner and fuel gas. Some previous works in this field have examined the reactivity of calcium oxide in the presence of steam. There is general agreement that the presence of steam increases the rate of carbonation even at low concentrations. However, there is no description about the effect of steam on the carbonation reaction of calcined limestone. The effects of temperature, concentration of steam on carbonation were investigated in a thermogravimetric analyzer. The understanding of the mechanisms participating in the carbonation reaction could be arrived at through the use of model interpretations of the rate controlling process. The experimental data were analyzed by means of the random pore model. During carbonation reaction, a very initial rapid reaction was followed by the second stage of the reaction occurring in the next slower regime. The experiment results showed that the effect of steam on carbonation could be neglected during the first stage of reaction. However, the conversion of carbonation in the presence of 1.5%(vol), 10%(vol) and 20%(vol) steam were 19.8%, 27.2% and 30.5% higher than the conversion without steam after 10 min during the second stage of reaction at 500℃. Steam was beneficial to enhancing the conversion of carbonation, but the extent of increase became not significant with increasing concentration of steam. The linearity of the second stage reaction data strongly suggested that this stage was controlled by a diffusion process occurring in a layer of calcium carbonate surrounding the calcium oxide in the pores of the solid. The parameters related to effective product layer diffusivities were plotted in Arrhenius form and the changes in activation energy at various steam concentrations were also shown. Comparison with the experimental effective diffusivities calculated for the carbonation reaction showed that the activation energies in the lower temperature range were in agreement with those obtained in the conductivity measurements. This suggested that the product layer diffusion process was proceeded by a mechanism similar to that of conduction in calcium carbonate. The activation energy of carbonation decreased from 179.9 kJ·mol-1to 237.7 kJ·mol-1when 1.5% steam was added according to the random pore model. The activation energy was 156.6 kJ·mol-1and 148.6 kJ·mol-1respectively for the atmospheres of 10% and 20% steam. There were two characteristics of product layer diffusion during carbonation. One was the slope of diffusional coefficient to increase from about 550℃, which was irrelevant to the presence of steam. The other was the effect of steam on carbonation to turn weak with increasing concentration of steam. At the higher temperature range, the possible mechanism for effective diffusion could be associated with sequential decompositions of carbonate ions in the calcium carbonate layer. A carbonate ion momentarily decomposed to generate carbon dioxide and an oxygen ion. The carbon dioxide molecule then moved to a neighboring similarly vacated site, while another carbon dioxide so generated elsewhere moved to take its place and reform the carbonate ion. In this way by a site to site random walk the carbon dioxide molecule diffused through the product layer, before reaction at the interface of calcium oxide and calcium carbonate. Such a mechanism appeared more prominent than the motion of carbonate ion at the higher temperature range. Both the above mechanisms for the diffusion stage were likely, and the true situation might involve one or a combination of both.
CO2capture;chemical reaction;catalysis;product layer diffusion coefficient; activation energy
2014- 09- 22.
Prof. YANG Yongping, yypncepu@163.com
10.11949/j.issn.0438-1157.20141419
TK 09
A
0438—1157(2015)03—1088—09
国家杰出青年科学基金项目(51025624);111 引智项目(B12034);中央高校基金项目(2014QN08)。
2014-09-22收到初稿,2014-11-24收到修改稿。
联系人:杨勇平。第一作者:刘洋(1977—),男,博士后。
supported by the National Natural Science Foundation of China(51025624), the 111 Project (B12034) and the Fundamental Research Funds for the Central Universities (2014QN08).

