肝素-泊洛沙姆超声微泡体外溶栓实验
王艳,赵应征,唐琴琴
(1.浙江省中医院 西药房,浙江 杭州 310006;2.温州医科大学 药学院,浙江 温州 325035)
肝素-泊洛沙姆超声微泡体外溶栓实验
王艳1,赵应征2,唐琴琴2
(1.浙江省中医院 西药房,浙江 杭州 310006;2.温州医科大学 药学院,浙江 温州 325035)
目的:探讨治疗性超声(US)介导结合肝素-泊洛沙姆(HP)的微泡(MB)对自制体外血栓的溶解作用及机制。方法:对兔耳缘静脉进行取血,制备体外血栓,通过考察不同栓龄、超声声强(净强度2~8 W/cm2)、作用时间和材料浓度下的栓溶率来确定各组的溶栓效应,并对其机制进行探讨。实验分组为:①US组;②US+MB组;③HP组;④US+HP组;⑤US+MB+HP组。结果:US+MB+HP组超声所需时间最短,溶栓效果最好,而其余各组对于体外血栓也有一定溶解作用。结论:新合成的材料HP与超声微泡联合应用后溶栓效果明显提高,其在临床治疗血栓性疾病中具有较好的应用潜力。
肝素-泊洛沙姆;超声;微泡;溶栓
自1976年Trubestein等[1]首次使用血管内高频超声溶解血栓获得成功以来,超声溶栓成为生物医学超声领域的重要研究课题。研究发现高能低频超声波能裂解体内外动脉粥样硬化斑块和血栓[2],栓溶率随着血栓凝龄增加而降低[3]。利用微泡作造影剂,超声可以监测病变局部的血流异常。利用超声波的照射作用,将微泡造影剂作为携带药物或治疗性基因的载体,可以实现药物的靶向导入,达到有效、快速、减少溶栓药剂量以及减轻或避免不良反应的作用。因此,超声微泡药物运载系统在溶栓治疗方面具有深远的前景。国内外许多实验研究已经证实超声微泡具有血栓助溶作用,这种助溶作用一方面表现在微泡能够有效增强超声的溶栓作用,另一方面则表现在微泡可以增加溶栓药物的作用,这就显示出了超声微泡联合溶栓药物治疗方法的强力优势[4-5]。
本研究采用新合成的材料肝素-泊洛沙姆(HP),在前期已探讨的该材料性质的基础上,通过进行体外自制血栓来进一步考察HP对血栓的作用,同时摸索HP结合超声增强溶栓效果的一些参数。
1 材料和方法
1.1实验动物 健康成年新西兰大白兔12只,雄雌不限,体质量1.8~2.5 kg,由温州医科大学实验动物中心提供。
1.2材料和仪器 肝素(批号:080311,效价:105.1 AxaIU/mg,河南常山生化药业有限公司);HP(由温州医科大学药学院提供);泊洛沙姆(批号:WPWA544C,德国BASF,进口分装);0.9%氯化钠溶液(浙江康乐药业);MB(批号:090806E,由温州医科大学药学院提供);医用超声耦合剂(KL-250型,由温州医科大学院附属第二医院超声科提供);氯化钙(AR,北京化工厂);超声仪(型号:K-628A);电热恒温振荡水槽(DKZ-450B型,上海森信实验仪器有限公司);电子天平(德国赛多利斯集团);超声探头;24孔板;20 mL针筒;试管;刀片;秒表;EP管;移液枪。
1.3实验方法
1.3.1体外血栓的制备:对兔耳缘静脉进行采血置于EP管中,放入37 ℃恒温水浴箱中,静置一段时间,形成血凝块后,用0.9%氯化钠溶液冲洗3~4次,基本洗去附着的未凝血细胞,滤纸吸干,即得。
①栓径的选择:采用2、5、8 mm规格的模具制备了3种大小的血栓,通过几次实验,综合考虑操作的便利性与栓径变化的确切性,我们最终选择栓径大小为5 mm规格的血栓。
②栓龄的考察:根据体外血栓的制备方法,采取静置时间分别为4、5、6、8、12、24、36、48、60 h,制备相应栓龄的血栓,考察超声对不同栓龄血栓的消溶作用,确定合适的栓龄范围。
1.3.2超声溶栓技术参数的优化:①超声强度对栓块的溶解:采用的超声仪探头面积为5 cm2,波输出方式为脉冲,考察时间为5 min,超声强度在2~8 W/cm2之间。超声方法:将装有0.9%氯化钠溶液及血凝块的24孔板置于37 ℃恒温水槽中距液面约0.5 cm左右,保证板底无气泡,使24孔板接受超声作用,探头表面置于各血栓处的孔板底部。设定超声声强为8、7、6、5、4、3、2 W/cm2,作用时间为5 min。然后取出孔板,将多余液体吸出,测栓径,继而计算栓径的改变量。每个超声强度重复实验3次,记录每个栓径值,取3次重复实验的平均值,用平均值对超声强度作图。②不同超声强度在不同时间里对血栓的溶解:先制备相同栓龄及体积的血栓,置于37 ℃ 0.9%氯化钠溶液中进行超声脉冲式照射,超声强度为2、3、4 W/cm2时,观察不同时间(1、2、3、5 min时)超声对栓径的影响,对应每个时间重复实验3次,记录栓径,并计算平均值,以该值与时间及超声强度作图,从而评价溶栓效果。③MB浓度对溶栓的影响:参考1.3.1制备相同栓龄及体积的血栓,并将其置于装有0.9%氯化钠溶液的24孔板中,然后设定超声时间为1 min,超声强度为3 W/cm2,超声脉冲式照射,比较不同MB体积对栓块的溶解效果。④药物加入量对溶栓的影响:参考1.3.1制备相同栓龄及体积的血栓,并将其置于装有0.9%氯化钠溶液的24孔板中,然后设定超声时间为1 min,超声强度为3 W/cm2,加入MB体积为0.2 mL,比较不同药物加入量对栓块的溶解效果。
1.3.3HP相关性质的考察:①HP的溶解性:泊洛沙姆是一类表面活性剂,由聚氧乙烯和聚氧丙烯聚合而成,其具有一定的溶解度,能溶于水,它能增加肝素的溶解度,增加与血栓的亲和力。取少量HP,用少量0.9%氯化钠溶液溶解,即成澄清溶液。②HP使用浓度的摸索:根据公式HP的浓度=(0.045× t-0.055)μmoL/mL计算即得。其中t为不加药物所得的复钙化时间。③肝素修饰化脂质微泡冻干粉的制备:将氢化磷脂、泊洛沙姆、HP等材料按照一定比例在有机相中均匀分散,冻干(充入SF6气体),得到肝素修饰化脂质微泡冻干粉(白色,疏松粉末状)。由于存在亲水基团,复溶性较好。镜检:粒径不太均匀、存在部分异形泡、少量聚集,平均粒径(2.58±0.26)μm,平均数量(1.7±0.26)×108/mL,无磷脂碎屑。MB粒径受体内外条件的影响较小,助溶效果比较好[6-7]。
1.3.4不同干扰因素对血栓栓溶率的影响:设置超声强度为3 W/cm2,超声时间为1 min,微泡加入体积为0.2 mL,在HP的体积为0.4 mL的条件下,考察不同干扰因素对栓溶率的影响。
1.3.5复钙化时间实验:用0.9%氯化钠溶液分别配置一定溶度的泊洛沙姆、HP、肝素溶液。各取3只试管溶液,分别加入血浆0.2 mL,CaCl2溶液(浓度为0.025 mol/L)0.2 mL,置于37 ℃水浴恒温,记录试管内出现第一条丝纤状物的时间,计算平均值。根据该数值,由公式HP的浓度=(0.045×t-0.055)μmoL/mL,计算所需HP浓度。
1.3.6HP的血液相容性:采用Lee-White实验(全血凝血实验),取洁净玻璃试管分为3组,分别为泊洛沙姆组、HP组、肝素组,每组3个平行实验。经37 ℃水浴恒温后,依次沿壁加入1 mL兔血于试管中,开始计时。3 min后每隔30 s倾斜试管,至试管中血液不流动计为凝血时间。
2 结果
2.1栓龄与血栓栓溶率的关系 如图1所示,超声栓溶率在4~60 h范围内的趋势是随着栓龄的增加而降低,且在6 h以内超声溶解血栓的效果最佳。结果表明临床治疗栓塞性疾病应该越早治疗,效果越好。

图1 栓龄和血栓溶栓率关系图
2.2不同超声强度对栓块溶解的效果 如图2所示,在超声强度2~8 W/cm2范围内,随着超声强度的增加,栓径大小呈现减小的现象。强度越大,栓溶作用越明显。

图2 超声强度和栓径关系图
2.3超声强度和超声时间对溶栓的影响 不同超声强度(2、3、4 W/cm2)和不同超声时间(1、2、3、5 min)对血栓溶解的效果如图3所示,血栓栓径与超声强度或超声时间成反比,超声强度越大或超声时间越长,越有利于血栓的溶解。

图3 超声时间和栓径相互关系图
2.4微泡的加入对溶栓效果的影响 设定超声时间为1 min,超声强度为3 W/cm2,比较不同微泡体积对栓块的溶解效果。如图4所示,在一定的体积范围内(0~0.2 mL),随着微泡体积增大,栓溶增加。但当达到一定体积后,栓溶变化不明显。
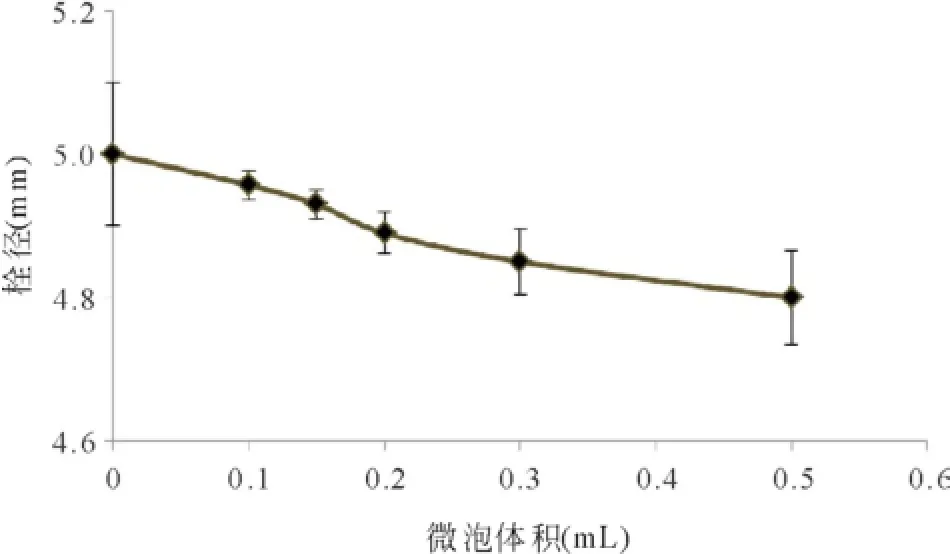
图4 不同微泡溶度与栓径相互关系图
2.5药物HP的加入对溶栓的影响 超声时间为1 min,超声强度为3 W/cm2,微泡体积为0.2 mL,比较不同量的HP加入对栓块的溶解效果。如图5所示,在一定HP加入量范围内(0~0.5 mL),随HP加入量增大,栓溶作用增加。

图5 不同HP加入量与栓径相互关系图
2.6不同干扰因素对栓溶率的影响 如表1和图6所示,超声微泡联合HP的栓溶作用最强,超声与HP均具有一定程度的栓溶作用,微泡能增加超声的栓溶作用。

图6 体外溶栓效果图
2.7 复钙化结果 不加药物的试管出现第一条丝状物的时间为t1=11′03′,代入公式计算:HP溶度= (0.0045×t1-0.055)μmoL/mL
由上式计算得到HP溶度为2.9 μmoL/mL。复钙化时间见表2,肝素组t2=16′04′,HP组平均时间t3= 19′42′,泊洛沙姆组平均时间t4=14′30′。HP对血栓形成有一定的抑制作用。

表1 不同干扰因素对栓溶率的影响(%)

表2 复钙化时间记录表
2.8全血凝血实验结果 如表3所示,HP组的血液相容性比较好,能延缓血栓的形成。

表3 全血凝血时间记录表(min)
3 讨论
本研究所选血栓模型制备过程与已有报道结果基本相似。我们根据实验结果及条件选用静置凝血时间为5 h,实验过程中证实该时间所形成的血凝块稳定,适合本实验。
超声波自身的生物物理特性使其不仅在诊断领域得到广泛应用,在治疗领域也展示出令人鼓舞的应用前景。本研究以不同超声强度、不同照射时间的超声波辐照体外血栓,有明确的溶栓效果,这与以往国内外大多数实验结果相符[8-9]。大多数研究者认为超声溶栓可能与超声波空化效应和机械效应有关,而与其热效应无明显关联[10]。超声波在组织和细胞内可产生空化现象,可引发高达1~3个大气压的“内爆炸”效应,足以使血栓在极短的时间内碎解成细小的颗粒。此外,Porter等[11]的实验证明,超声波能使纤维蛋白分解产物D-二聚体增加,推测其可以增强纤维蛋白溶解。
研究中还涉及在固定超声和照射时间的条件下,对不同栓龄的血栓进行实验,所得溶栓结果与栓龄成反比,即栓龄越高,栓溶率则呈下降趋势,这与以往实验结果相符。因此,在安全能量范围内,寻求超声的最佳溶栓效果已成为近年来研究的重点。在考察超声强度对栓溶影响的实验中,我们选择超声强度范围为2~8 W/cm2。这是基于通过排除最大值和最小值,在较平稳的范围内更好地考察变量,减少误差[12]。在考察超声时间对栓溶影响实验中,综合临床治疗栓塞性疾病中对时间要求的严格性,我们考察了0~6 min内超声的栓溶效果。在考察完超声参数后,我们研究了新材料HP对栓溶的影响,以及在超声系数的改变对栓溶促进作用影响不大的情况下,加入不同体积的微泡,栓溶作用发生改变,进而说明微泡能增加超声的栓溶作用。我们综合考察了超声微泡和HP的相互作用,并发现三者联用,溶栓效果最佳,其原因可能是空化作用后使血栓破裂的同时增加了HP与血栓的接触面积,进而使栓溶作用进一步增加。总之,超声具有一定的溶栓效应,超声微泡联合HP,在溶栓方面有协同作用,即强化HP溶栓效应,并可减少有效溶栓的HP剂量,从而减少大剂量溶栓药物导致致命性出血并发症的危险性。HP超声微泡溶栓较单一溶栓药物治疗效果好[13]。随着微泡制造技术的发展,HP超声溶栓有望成为急性血管栓塞性疾病高效、无创的治疗手段。
[1]Trubestein G, Engel C, Etzel F, et a1. Thrombolysis by ultrasound[J]. Clin Sci Mol Med Suppl, 1976, 3: 697-698.
[2]Siegel RJ, DonMichael TA, Fishbein MC, et al. In vivo ultrasound arterial recanalization of atherosclerotic total occlusions[J]. J Am Coll Cardiol, 1990, 15(2): 345-351.
[3]于富民, 卫亚利, 丁庆华, 等. 体外超声波溶解血栓实验及栓龄对溶栓效应影响的研究[J]. 中国超声医学杂志, 1998,14(6): 4-6.
[4]Culp WC, Erdem E, Roberson PK, et a1. Microbubble potentiated ultrasound as a method of stroke therapy in a pig model: preliminary findings[J]. J Vasc Interv Radiol, 2003,14(11): 1433-1436.
[5]Porter TR, Xie F. Ultrasound, microbubbles, and thrombolysis[J]. Prog Cardiovasc Dis, 2001, 44(2): 101-110.
[6]徐亚丽, 刘政, 高云华, 等. 低频超声介导微泡造影剂对体外血栓的助溶作用[J]. 中华超声影像学杂志, 2006, 15(2): 135-137.
[7]Unger EC, Porter T, Culp W, et a1. Therapeutic applications of lipid-coated microbubbles[J]. Adv Drug Deliv Rev, 2004,56(9): 1291-1314.
[8]严碧歌, 王荣. 超声波频率功率和血栓消溶率的关系[J].西北大学学报, 2003, 33(1): 16-18.
[9]Cintas P, Nguyen F, Boneu B, et a1. Enhancement of enzymatic ifbirnolysis with 2-MHz ultrasound and microbubbles [J]. J Thromb Haemost, 2004, 2(7): 1163-1166.
[10]Rosenschein U, Furman V, Kerner E, et a1. Ultrasound imaging-guided noninvasive ultrasound thrombolysis: preclinical results[J]. Circulation, 2000, 102(2): 238-245.
[11]Porter TR, Kricsfeld D, Lof J, et a1. Effectiveness of transcranial and transthoracic ultrasound and microbubbles in dissolving intravascular thrombi[J]. J Ultrasound Med, 2001,20(12): 1313-1325.
[12]徐亚丽, 刘政, 高云华, 等. 治疗超声介导微泡造影剂对体外血栓的助溶研究[J]. 中国超声医学杂志, 2006, 22(2): 81-83.
[13]区文超, 修建成, 谢国晋, 等. 超声联合微泡对兔股动脉的促溶作用[J]. 第一军医大学学报, 2004, 24(5): 536-538.
(本文编辑:吴昔昔)
Ultrasound-microbubble mediated heparin-poloxamer thrombolysis study in vitro
WANG Yan1, ZHAO Yingzheng2, TANG Qinqin2.
1.Department of Pharmacy, Traditional Chinese Medicine Hospital of Zhejiang,Hangzhou, 310006; 2.School of Pharmacy, Wenzhou Medical University, Wenzhou, 325035
Objective: To explore and discuss the mechanism of theapeutical ultrasound combined with heparin-poloxamer (HP) on thrombus dissolution in vitro. Methods: Blood clots were prepared from rabbit ear blood. Main factors on the thrombolysis effects in vitro were investigated, including blood clot age, ultrasonic intensity (pure intensity seted in the range of 2~8 W/cm2), ultrasound time and material concentration. Five experimental groups were as follows: ①US; ②US+MB; ③HP; ④US+HP; ⑤US+MB+HP. Through the results of the experiment, thrombolysis effect in each group was determined and the mechanism was discussed. Results: The group (US+MB+HP) showed the best result in the thrombolysis with less ultrasound time, though the other groups showed certain thrombosis effects in vitro. Conclusion: Heparin-poloxamer combined with ultrasound microbubble has an improved effect in thrombolysis, which may be a potential technique for clinical treatment of thrombotic diseases.
heparin-poloxamer; ultrasound; microbubbles; thrombolysis
R94
B DOI: 10.3969/j.issn.2095-9400.2015.11.011
2015-01-12
王艳(1987-),女,浙江建德人,初级药师。
赵应征,教授,硕士生导师,Email:pharmtds@163. com。

