MOF-5对PEO基电解质导锂及界面稳定性能的改善
袁长福,刘晋,韩鹏飞,徐俊毅,李劼
MOF-5对PEO基电解质导锂及界面稳定性能的改善
袁长福,刘晋,韩鹏飞,徐俊毅,李劼
(中南大学冶金与环境学院,湖南长沙,410083)
以一种金属有机框架Zn4O(1,4-苯二甲酸)3(MOF-5)为填料,加入聚氧乙烯(Polyethylene oxide,PEO)中,以双三氟甲基磺酰亚胺锂(LiN(SO2CF3)2)为锂盐,通过溶液浇注法制备锂离子电池用复合电解质(Composite polymer electrolyte,CPE)膜。采用交流阻抗及其与电势阶跃相结合的方法分别对电解质的离子电导率和离子迁移数进行测定。另外,研究CPE与锂负极的界面稳定性以及计时电流曲线、阻抗随存储时间变化以及恒流极化循环曲线。研究结果表明:掺入质量分数为10%的MOF-5后,20 ℃时离子电导率从6.3×10−7S/cm提高到最高的1.9×10−5S/cm,锂离子迁移数则随MOF-5质量分数的增加而增加,从质量分数为0时的0.012增加到20%时的0.232,表明MOF-5具有阴离子受体效应,对锂离子移动起到了很好的促进作用;MOF-5的加入明显提高了CPE与锂负极界面在静态存储及动态工作条件下的稳定性,进一步证明MOF-5能改善PEO基固体聚合物电解质关键性能。
复合聚合物电解质;MOF-5;聚氧乙烯;阴离子受体;界面稳定性;锂离子电池
使用易挥发、易燃的有机电解液是传统锂离子电池存在较大安全隐患的关键原因,制约着锂离子电池在电动汽车等市场的推广应用。聚氧化乙烯(PEO)基聚合物与碱金属锂盐的络合物具有传输锂离子的特性,且高温稳定性好,安全性能高,是一种理想的替代电解液的电解质材料,自Wright等[1]报道以来,一直备受关注。对于固体聚合物电解质,较高离子电导率和良好的界面稳定性是实现应用的重要基础,也是该研究领域关注的焦点[2−3]。然而,PEO基聚合物电解质的电导率较低(<1 μS/cm),且界面稳定性较差,其与锂负极之间的钝化作用会使得电池工作过程中界面阻抗逐渐增加[4],从而降低电池的倍率性能和循环寿命。加入特定性质的陶瓷填料制备成复合聚合物电解质(Composite polymer electrolyte,CPE)是改善这两方面性能的有效途径[5−7]。加入PEO基电解质中充当填料的材料以金属氧化物纳米颗粒为主[8]。纳米颗粒的加入主要起3个方面作用:1) 打乱PEO链的有序排列,降低其结晶度,提高其链段运动能力,从而提高导电率[5];2) 填料表面的富余电荷可以帮助解离锂盐,提高导电率;3) 纳米颗粒在电解质表面富集,减缓了锂与电解质界面的钝化过程。然而,金属氧化物纳米颗粒与PEO的相容性较差,与PEO混合后易发生团聚,极大地影响了其作用的发挥。本文针对此不足,采用金属−有机框架材料(Metal organic framework,MOF)作为一种新型填料。此材料在发挥上述3个方面作用的同时,在提高迁移数和界面稳定性方面也具有显著效果。Zn4O(1,4-苯二甲酸)3(MOF-5)是一种典型的金属有机框架材料,以对苯二甲酸根为桥联配体,Zn4O6+金属簇为桥联中心组成三维立方网络拓扑结构,具备有机无机杂化性质[9],与PEO的相容性较好,可以有效阻碍PEO的结晶和改善锂/电解质界面的稳定性。同时,由于其在制备过程中,金属盐通常保持化学计量比过量,使晶体表面富有未饱和配位的Zn4O6+。这些带正电性的不饱和金属配位点可以与PEO中的氧原子配位,还可作为锂盐中阴离子的受体,吸附阴离子减缓其移动,对提高总体电导率和锂离子迁移数非常有利[10]。另一方面,由于MOF-5还是一种具有极高比表面积的晶态微孔材料(孔径为12.94×10−10 m),对小分子气体和溶剂具有较强的捕获能力[11],有利于限制电解质中的痕量杂质(如水和氧)向界面迁移而与锂反应,从而进一步提高电解质与锂之间的界面稳定性。本文在前期工作基础上[12],合成了微米级(约4 μm)的MOF-5材料,并以其作为填料制备PEO-LiN(SO2CF3)2(LiTFSI)/MOF-5复合电解质。
1 实验
1.1 MOF-5的制备
采用滴加法合成所需MOF-5,流程如图1所示。首先将1.35 g Zn(NO3)2·6H2O(99.99%,质量分数,下同)和0.25 g对苯二甲酸(H2BDC,99%)分别溶解于100 mL和50 mL二甲基甲酰胺(N,N-Dimethylformamide,DMF)(+99.9%)中。然后,采用250 mL的三口烧瓶盛装H2BDC-DMF溶液,Zn(NO3)2·6H2O-DMF溶液则转移到100 mL的恒压滴定管。在高纯氩保护气氛下,往三口烧瓶滴加1 mL 三乙胺(TEA,HPLC纯),随后加热到100 ℃并以200 r/min速度搅拌。在7 h内将Zn(NO3)2·6H2O-DMF溶液匀速滴加到H2BDC-DMF溶液中进行反应,生成白色沉淀。冷却至室温后,过滤取出沉淀物并用100 mL DMF和100 mL CH2Cl2分别对其浸泡清洗3次,每次12 h。先将溶液转移到旋转蒸发仪,在80 ℃抽真空下进行预干燥,再转移到真空干燥箱中100 ℃干燥12 h获得白色粉末,存储于充满氩气的手套箱中备用。

图1 MOF-5制备流程图
1.2 复合电解质的制备
PEO(平均相对分子质量为4 000 000,99.9%,阿拉丁试剂)、LiTFSI(Lithium bis(trifluoromethane sylfonimide,99.5%,上海恩氟佳科技)在使用之前先在50 ℃的真空环境下进行干燥。复合电解质(CPE)制备全程在手套箱中进行。PEO中氧化乙烯单元与锂盐摩尔比为25:1,MOF-5的质量分数为0~25%。按预定组成称取LiTFSI,MOF-5和PEO,以乙腈为溶剂搅拌混合形成流动性良好的溶液,浇注到钢壳模具中,于55 ℃干燥24 h,获得CPE膜。
1.3 检测与表征
利用Rigaku/TTR-III型X线衍射仪(XRD)(Cu-K,波长=1.541 8×10−10 m)和JSM-6360LV型扫描电镜(SEM)分别对样品的物相和形貌进行检测。采用Micromeritics ASAP 2020测定样品在液氮温度下(77 K)的氮气吸附等温线,计算所合成MOF-5样品的比表面积。
在手套箱中,将所制备的电解质膜组装成SS/CPE/SS(Stainless steel,SS为不锈钢片)电池,采用交流阻抗法测试其电导率。为尽可能减小界面接触阻抗对电导率测试的影响,测试之前将SS/CPE/SS在70 ℃预处理5 h,冷却至设定温度后直接采用交流阻抗的方法进行测量。将所制备的电解质膜组装成Li/CPE/Li电池,对迁移数和界面稳定性进行测试。离子迁移数采用Evans等[13]提出的交流阻抗与电势阶跃相结合的方法测得。在静态存储条件下,电解质与锂负极间的界面稳定性通过测量Li/CPE/Li电池阻抗随静置时间的变化来表征。采用Land测试仪对Li/CPE/Li电池施加恒电流(0.08 mA/cm2),并每隔2 h改变电流方向进行循环极化,模拟Li/CPE界面在实际电池中的工作状态,通过极化曲线本身和极化前后阻抗变化可表征工作条件下的Li/CPE界面稳定性。所有交流阻抗谱均采用相同的测试参数:频率范围为0.01 Hz~100 kHz,振幅为10 mV,外加直流电压为0 V,并用Zview软件对所得阻抗谱进行解析得到具体结果。所有电化学测试均在型号为PARSTAT 2273的电化学工作站(美国PerkinElmer仪器)上进行。测试温度则采用GDH-2005C型高低温箱进行控制。
2 结果与讨论
2.1 MOF-5表征
所得MOF-5样品的SEM照片如图2(a)所示。样品形貌为规则立方体,大小均匀,晶体尺寸约为4 μm。图2(b)所示则为样品的实测XRD图谱以及MOF-5的理论XRD图谱。从图2可见:实测XRD图谱上的特征峰与理论MOF-5结构中各晶面特征峰一一对应[14],可以确定所制备的白色粉末为MOF-5。但是,实测图谱相比于理论图谱9.7°处有右肩峰出现,而且200和220晶面峰强度发生了反转,可能是由于MOF-5孔道对溶剂分子的吸附使得MOF-5在干燥后仍然会有微量溶剂(如DMF)残存在晶格孔道中,引起晶格扭曲[15]。

(a) SEM照片;(b) XRD图谱;(c) 理论计算MOF-5 XRD图谱
2.2 离子电导率
将所制备的复合电解质膜(CPE)裁成圆片,与不锈钢片(SS)组装成SS/CPE/SS电池进行交流阻抗测试,取谱中高频区直线与实轴的交点为电解质的本体阻抗,根据公式=/()计算电解质的电导率(其中,为CPE膜的厚度,为CPE膜与钢片接触面积,为本体阻抗)。图3(a)所示是MOF-5质量分数为10%时,电池在不同温度下的交流阻抗谱,据此可以计算该电解质膜在不同温度下的电导率,如表1所示。不同MOF-5质量分数的电解质电导率随温度(20~80 ℃)变化规律如图3(b)所示。从图3可见:温度及MOF-5的质量分数对电导率影响较大,随着温度升高,电导率不断上升;随着MOF-5的质量分数增加,电导率呈先增大后减小趋势;当温度小于等于55 ℃时,MOF-5质量分数为10%的电解质电导率最高,20 ℃时可达1.9×10−5S/cm,与目前报道的性能优良的PEO基复合电解质的电导率水平处于同一数量级[16],比不加MOF-5的电解质(6.3×10−7S/cm)高1个数量级以上,证明MOF-5的加入对离子传递产生了有利影响。原因解释如下:一方面,Zn4O6+与PEO中的氧配位可降低PEO链的结晶性,有利于链段运动;另一方面,Zn4O6+与TFSI−离子作用可促进锂盐解离。但当填料质量分数过高时,会产生稀释效应,进而导致电导率降低[17]。MOF-5孔道中吸附的溶剂可使MOF-5孔道也具有一定的锂离子传导能力,这应该也是电导率提高的一个原因。另外,与文献[2]报道的相似,所有曲线在55~60 ℃间均出现明显的转折点,这与PEO的相转变有关。PEO的熔化温度约为60 ℃,在达到此温度时,PEO会从部分结晶态转变为完全无定形态,其电解质中锂离子及阴离子迁移的活化能也随之变小,使得曲线弯折[18]。同时,由于温度升高,MOF-5质量分数高的样品界面接触改善效果更明显,因此,在达到转折温度后,质量分数为15%的MOF-5电解质电导率增加更快,与质量分数为10%的MOF-5电解质接近。

(a) MOF-5质量分数为10%时,电解质在不同温度下的交流阻抗谱(插图为实部阻抗小于60 Ω的局部放大图);(b) MOF-5质量分数不同时电解质电导率随温度的变化曲线

表1 质量分数为10%的MOF-5电解质在不同温度下的电导率
注:电解质膜厚度=0.018 cm,接触面积=2.0 cm2。
2.3 锂离子迁移数
基于Evans等[13]提出的方法对电解质在25 ℃时的锂离子迁移数(t)进行测试,以研究MOF-5的加入对迁移数的影响。t计算公式如下:
式中:Δ为电势阶跃电压;0和s分别为阶跃过程中的初始电流和稳态电流;into为初始界面阻抗;ints为极化后界面阻抗。0需以△0计算校准而得,而不是直接从计时电流曲线读得[19]。对于该种方法,into和ints的解析非常重要,为此需要确立电池的等效电路。Li/CPE/Li电池等效电路及典型交流阻抗谱解析示例见图4。这里测试的Li/CPE/Li电池在25 ℃时的Nyquist图由高频区狭长弧线、中频区拉伸半圆以及低频区斜线3部分组成。参考其他研究人员提出的几种等效电路[20−21],提出适合于该复合电解质体系的等效电路。图4中:b为电解质本体阻抗;g,f和c分别为电解质晶界、Li/CPE界面钝化层以及电荷转移过程的阻抗;恒相位原件(Constant phase element,CPE)CPE1,CPE2和CPE3分别代表电解质晶界、Li/CPE界面钝化层以及电荷转移过程的容抗;w代表锂离子的Warburg扩散阻抗。理论上,在Nyquist图中可以观察到3个半圆,分别对应着上述3对阻抗和容抗,但由于MOF-5具有有机无机杂化性质,与本体电解质具有较好相容性,使得两者界面偏离理想电容特性,导致对应电解质晶界的高频区响应变形严重,半圆与钝化层阻抗半圆相重叠。而中频区两半圆有所重叠则与f//CPE2和c//CPE3两组合元件具有相似的弛豫时间常数相关。在测试频率范围内,来自g//CPE1和w元件的响应难以解析,考虑到t计算仅需要知道界面阻抗的具体数值,而界面阻抗等于钝化膜阻抗和电荷传递阻抗之和(int=f+c),因此,这里仅对中频区响应进行选择性解析。

图4 Li/CPE/Li电池等效电路及典型交流阻抗谱解析示例
分别对4种(质量分数为0,5%,10%,20%)MOF-5的电解质极化前后的交流阻抗图进行解析,得到into及ints,并结合极化的初始电流和稳态电流计算迁移数(t),结果及计算需要用到的相关参数如表2所示。由计算结果可知:对应0,5%,10%和20%的 MOF-5电解质的t分别为0.012,0.076,0.090和0.232,t随着MOF-5质量分数的增大而增大。PEO基电解质t的报道值一般在0~0.4范围内[22−23],且常温下测试值较低,这里测试结果与相关体系报道值相当。PEO基电解质迁移数较低,其原因主要有2方面[24]:1) 锂离子作为PEO链上氧的配位中心,锂离子的移动比阴离子的移动更加缓慢;2) PEO链极性较低,解离能力较弱,锂离子容易与阴离子络合,以带负电荷的离子对形式进行迁移。而MOF-5表面富含正电性的Zn4O6+不饱和配位点,一方面可以促进锂盐解离,释放更多的自由锂离子,另一方面可以起到阴离子受体作用,将部分TFSI−离子束缚于MOF-5表面,使得锂离子相对于阴离子的迁移能力得到明显增强。因此,加入MOF-5可以明显提高电解质的锂离子迁移数。

表2 MOF-5质量分数不同时电解质的锂离子迁移数(t+)以及与其计算相关的参数
2.4 Li/CPE界面稳定性
电解质与锂的界面稳定性直接影响聚合物锂离子电池的循环性能,是聚合物电解质的一个重要性 质[25]。将纯PEO基电解质及MOF-5质量分数为10%的电解质圆片组装成Li/CPE/Li电池,分别采用交流阻抗法和恒流极化法测试其静态存储[26]及工作状态下的界面稳定性,以研究MOF-5对Li/CPE间的界面稳定性能的影响。
当MOF-5质量分数为0和10%时,Li/CPE/Li电池阻抗谱随存储时间的变化如图5所示。从图5可见:加入MOF-5后电池的界面阻抗明显减小,MOF-5质量分数为0时界面阻抗为27.2 kΩ,MOF-5质量分数为10%时界面阻抗则仅为7.8 kΩ。同时,加入MOF-5后,界面阻抗随静置时间增大的速度也明显减慢。静置5 d后,MOF-5质量分数为0时界面阻抗增大了11.8 kΩ,而质量分数为10%时仅增大了2.6 kΩ,这表明MOF-5的加入不仅有利于降低界面阻抗,还有利于提高存储条件下的界面稳定性。关于普通金属氧化物填料提高存储条件下的界面稳定性已有较多的研究报导,其原因一般归结于2点:1) 电解质表面富集的纳米颗粒部分阻碍了电解质与电极的直接接触,从而减缓了锂与电解质界面的钝化过程;2) 填料对痕量有害杂质(如水、残留溶剂和氧)具有较强的吸附能力,可以阻止这些杂质迁移到电极界面与锂反应形成钝化膜。在这点上,MOF-5相较于一般填料的优势在于:其不仅具有较大的比表面积(Langmuir比表面积约为920 m2/g),而且具有贯穿材料本体的微孔网络结构,对这些杂质具有超高的吸附容量,且被吸附后的杂质还不易从微孔结构中“逃逸”。
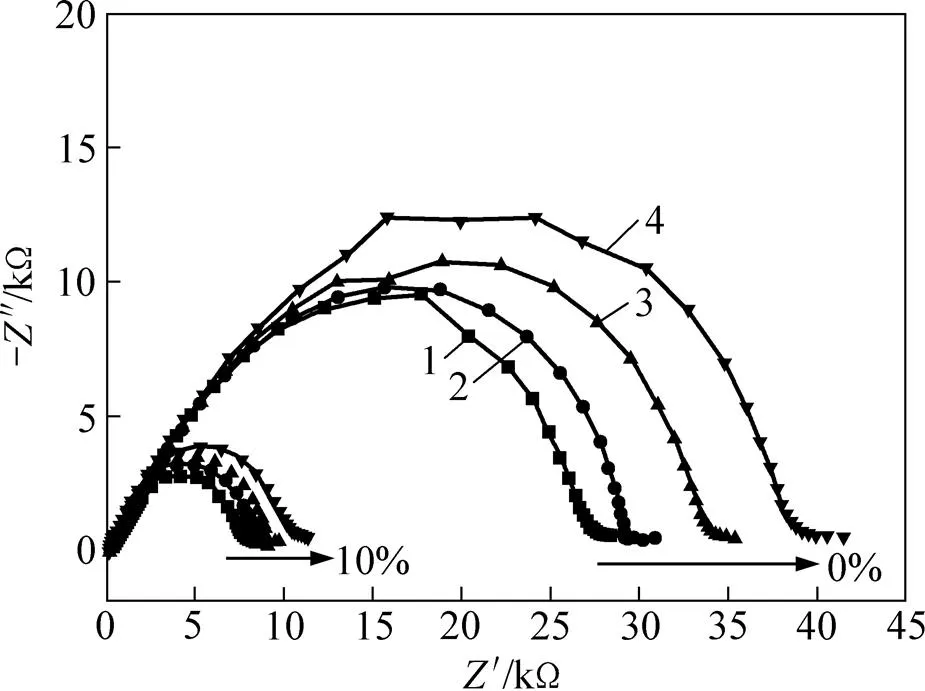
时间/d:1—1;2—2;3—3;4—5
然而,在实际电池工作过程中,Li/CPE界面会发生电化学反应,前面的静态测试无法反映充放电情况下的界面状态变化。为此,对Li/CPE/Li电池进行恒流极化,每隔2 h改变电流方向,以模拟表征Li/CPE界面在实际工作条件下(锂沉积−溶解循环)的稳定性。当温度为60 ℃、电流密度为0.08 mA/cm2时,质量分数为0和10%的MOF-5电解质的极化循环曲线以及循环前后阻抗测试结果分别如图6(a)和图6(b)所示。从图6可见:当MOF-5质量分数为0时,随着时间推移其极化波动较大,正、反极化最高电压之差先增大后减小,然后又逐渐增大;25圈循环后,电池整体阻抗由146 Ω增加至241 Ω;而当MOF-5质量分数为10%时,电池在循环7圈后就达到稳定状态,阻抗与电池极化不仅没增加,反而减小,阻抗由97 Ω下降至53 Ω,而且在第7圈后基本达到稳定状态,说明加入MOF-5对提高PEO工作过程中的界面稳定性具有非常显著的效果。

MOF-5质量分数:(a) 0;(b) 10%
在工作状态下,Li/CPE界面稳定性受2种相反因素影响:一种使界面阻抗增加,另一种使界面阻抗减小。前者与静态存储条件下阻抗增加原因相同,为PEO及痕量溶剂对锂的钝化过程,而后者则与循环过程中两相界面不断融合有关。随着锂不断沉积和溶解,Li/CPE界面会形成锂突起和凹陷(这一现象已被Liu等[21]原位观测到),使得界面接触面积增大,电池整体阻抗降低。MOF-5的加入减缓了Li/CPE界面的钝化,并改善了两者界面的相容性,因此,使得两者界面可以快速稳定,且电阻减小。
另外,在表征迁移数的过程中,发现纯PEO基电解质和复合电解质的计时电流曲线存在显著差别。MOF-5质量分数为0和10% 时的计时电流曲线如图7所示。从图7可见:当MOF-5质量分数为0时,极化达到稳态所需时间超过9 000 s,而加入10% MOF-5后,所需时间降低至1 500 s以下。该领域内其他文献报导的极化电流达到稳态所需时间则从几天到几分钟[27−28]不等。Li/CPE/Li电池的计时电流曲线可分成2阶段:电流下降较快的初始阶段,主要与阴离子浓度梯度的形成有关;电流缓慢下降的后续阶段,主要与界面阻抗缓慢增加有关。界面稳定性越高,阻抗增加的程度越小,达到稳态所需时间也越短,因此,加入MOF-5后极化稳定所需时间大幅度减小进一步说明其对Li/CPE界面的稳定性提高。

MOF-5质量分数:(a) 0;(b) 10%
3 结论
1) 电导率随着MOF-5质量分数的增加先增大后减小。当温度小于等于55 ℃时,MOF-5质量分数为10%的电解质电导率最高,20 ℃时,电导率从MOF-5质量分数为0时的6.3×10−7S/cm提高到1.9×10−5S/cm,表明适当质量分数的MOF-5可以起到提高PEO基电解质电导率的作用。
2) 锂离子迁移数随MOF-5质量分数的增大而增大。当MOF-5质量分数从0增加到20%时,迁移数从0.012增大到0.232,说明MOF-5起到了阴离子受体作用。
3) 当加入10% MOF-5时,Li/CPE/Li电池的计时电流曲线达到稳态所需时间从至少9 000 s缩短到不足1 500 s,静态存储条件下的阻抗增加速度显著减慢,而且动态极化循环后阻抗不仅没增加,反而因界面融合而减小。三方面结果相互印证,表明MOF-5在提高Li/CPE界面静态存储条件及工作条件下的稳定性方面都有显著作用。
[1] Wright P V. An anomalous transition to a lower activation energy for dc electrical conduction above the glass-transition temperature[J]. Journal of Polymer Science: Polymer Physics Edition, 1976, 14(5): 955−957.
[2] Kil E H, Choi K H, Ha H J, et al. Imprintable, bendable, and shape-conformable polymer electrolytes for versatile-shaped lithium-ion batteries[J]. Advanced Materials, 2013, 25(10): 1395−1400.
[3] LIN Yue, LI Jie, LAI Yanqing, et al. A wider temperature range polymer electrolyte for all solid-state lithium ion batteries[J]. RSC Advances, 2013, 3(27): 10722−10730.
[4] JIANG Yanxia, XU Jinmei, ZHUANG Quanchao, et al. A novel PEO-based composite solid-state polymer electrolyte with methyl group-functionalized SBA-15 filler for rechargeable lithium batteries[J]. Journal of Solid State Electrochemistry, 2008, 12(4): 353−361.
[5] Masoud E M, El-Bellihi A A, Bayoumy W A, et al. Organic-inorganic composite polymer electrolyte based on PEO-LiClO4and nano-Al2O3filler for lithium polymer batteries: Dielectric and transport properties[J]. Journal of Alloys and Compounds, 2013, 575: 223−228.
[6] Stephan A M, Nahm K S. Review on composite polymer electrolytes for lithium batteries[J]. Polymer, 2006, 47(16): 5952−5964.
[7] Lin C W, Hung C L, Venkateswarlu M, et al. Influence of TiO2nano-particles on the transport properties of composite polymer electrolyte for lithium-ion batteries[J]. Journal of Power Sources, 2005, 146(1/2): 397−401.
[8] 刘晋, 徐俊毅, 林月, 等. 全固态锂离子电池的研究及产业化前景[J]. 化学学报, 2013, 71(6): 869−878. LIU Jin, XU Junyi, LIN Yue, et al. All-solid-state lithium ion battery:Research and industrial prospects[J]. Acta Chimica Sinica, 2013, 71(6): 869−878.
[9] ZHOU Hongcai, Long J R, Yaghi O M. Introduction to metal-organic frameworks[J]. Chemical Reviews, 2012, 112(2): 673−674.
[10] Lee H S, YANG Xiaoqing, XIANG Chunlei, et al. The synthesis of a new family of boron-based anion receptors and the study of their effect on ion pair dissociation and conductivity of lithium salts in nonaqueous solutions[J]. Journal of The Elecrochemical Society, 1998, 145(8): 2813−2818.
[11] ZHAO Zhenxia, MA Xiao, LI Zhong, et al. Synthesis, characterization and gas transport properties of MOF-5 membranes[J]. Journal of Membrane Science, 2011, 382(1/2): 82−90.
[12] YUAN Changfu, LI Jie, HAN Pengfei, et al. Enhanced electrochemical performance of poly(ethylene oxide) based composite polymer electrolyte by incorporation of nano-sized metal-organic framework[J]. Journal of Power Sources, 2013, 240(15): 653−658.
[13] Evans J, Vincent C A, Bruce P G. Electrochemical measurement of transference numbers in polymer electrolytes[J]. Polymer, 1987, 28(13): 2324−2328.
[14] LI Hailian, Eddaoudi M, O’Keeffe M, et al. Design and synthesis of an exceptionally stable and highly porous metal-organic framework[J]. Nature, 1999, 402(6759): 276−279.
1996 年国家公布的管理学类公共管理一级学科下设行政管理、社会保障、教育经济与管理、社会医学与卫生事业管理、土地资源管理5个二级学科或专业,从此社会保障学从之前保险学与劳动经济学所属的经济学一级学科划入公共管理学科。由于目前我国公共管理二级学科的划分基础是横向的领域分工,之前都分属于不同的一级学科,这使得公共管理呈现出了的多学科融合性的特质,在教学方案中必须对政治学、经济学、管理学、社会学等学科的基础知识都有所涉及,如果脱离了导师的个性化指导,学生就不能有重点地掌握某一学科方法进行课题研究和科研创新。
[15] CHEN Bi, WANG Xiujian, ZHANG Qianfeng, et al. Synthesis and characterization of the interpenetrated MOF-5[J]. Journal of Materials Chemistry, 2010, 20: 3758−3767.
[16] 李雪莉, 郭娟, 吴强, 等. 含锂沸石Li-FER提高PEO复合聚合物电解质电导率[J]. 物理化学学报, 2005, 21(4): 397−401. LI Xueli, GUO Juan, WU Qiang, et al. Research on the enhanced conductivity of poly(ethylene oxide) electrolyte by adding zeolite Li-FER[J]. Acta Physico-Chimica Sinica, 2005, 21(4): 397−401.
[17] Capuano F, Croce F, Scrosati B. Composite polymer electrolytes[J]. Journal of the Electrochemical Society, 1991, 138(7): 1918−1922.
[18] Lascaud S, Perrier M, Vallée A, et al. Phase diagrams and conductivity behavior of poly(ethylene oxide)-molten salt rubbery electrolytes[J]. Macromolecules, 1994, 27(25): 7469−7477.
[19] CHENG Hu, ZHU Changbao, HUANG Bin, et al. Synthesis and electrochemical characterization of PEO-based polymer electrolytes with room temperature ionic liquids[J]. Electrochimica Acta, 2007, 52(19): 5789−5794.
[20] Kumar J, Rodrigues S J, Kumar B. Interface-mediated electrochemical effects in lithium/polymer-ceramic cells[J]. Journal of Power Sources, 2010, 195(1): 327−334.
[21] Liu S, Imanishi N, Zhang T, et al. Effect of nano-silica filler in polymer electrolyte on Li dendrite formation in Li/poly(ethylene oxide)-Li(CF3SO2)2N/Li[J]. Journal of Power Sources, 2010, 195(19): 6847−6853.
[22] Masayoshi W, Atsushi N. Effects of network structures and incorporated salt species on electrochemical properties of polyether-based polymer electrolytes[J]. Solid State Ionics, 1995, 79: 306−312.
[23] Cameron G G, Harvie J L, Ingram M D. The steady state current and transference number measurements in polymer electrolytes[J]. Solid State Ionics, 1989, 34(1/2): 65−68.
[24] Minami T, Tatsumisago M, Wakihara M. Solid state ionics for batteries[M]. Tokyo: Springer-Verlag, 2005: 209−219.
[25] 古宁宇, 敖鹤, 裴建军. 表面改性纳米SiO2复合聚合物电解质的制备及性能[J]. 高等学校化学学报, 2012, 33(6): 1295−1300. GU Ningyu, AO He, PEI Jianjun. Preparation and characterization of composite polymer electrolytes containing surface-modified nano silica[J]. Chemical Journal of Chinese Universities, 2012, 33(6): 1295−1300.
[26] XI Jingyu, QIU Xinping, CUI Mengzhong, et al. Enhanced electrochemical properties of PEO-based composite polymer electrolyte with shape-selective molecular sieves[J]. Journal of Power Sources, 2006, 156(2): 581−588.
[27] ZHANG Jiawei, HUANG Xiaobin, FU Jianwei, et al. Novel PEO-based composite solid polymer electrolytes incorporated with active inorganic–organic hybrid polyphosphazene microspheres[J]. Materials Chemistry and Physics, 2010, 121(3): 511−518.
[28] WANG Yanjie, PAN Yi, CHEN Linshen. Ion-conducting polymer electrolyte based on poly(ethylene oxide) completed with Li1.3Al0.3Ti1.7(PO4)3salt[J]. Materials Chemistry and Physics, 2005, 92(2/3): 354−360.
(编辑 陈灿华)
Li-transfer promotion and interface stabilization of MOF-5 on PEO-based polymer electrolyte
YUAN Changfu, LIU Jin, HAN Pengfei, XU Junyi, LI Jie
(School of Metallurgy and Environment, Central South University, Changsha 410083, China)
A kind of metal-organic framework Zn4O(1,4-benzenedicarboxylate)3(MOF-5) was employed as hybrid filler in poly(ethylene oxide)(PEO)-LiN(SO2CF3)2based on composite polymer electrolyte (CPE) for lithium ion batteries. The CPE was prepared by using a solvent-casting method. The ionic conductivity was measured by AC impedance and the transference number by the AC impedance combined with a potential step measurement. When 10% MOF-5 is incorporated. In addition, the chronoamperometry, resistance stability upon storage and constant-current polarization were studied. The results show that the highest ionic conductivity of 1.9×10−5S/cm is obtained, which is 6.3×10−7S/cm without MOF-5 at 20℃. The lithium-ion transference number increases from 0.017 to 0.232 with the increase of mass fraction of MOF-5 from 0 to 20%, which suggests that the MOF-5 plays an anion receptor role in the electrolyte. The interfacial stability of CPE against lithium anode is significantly improved by MOF-5 under both storing and constant-current operating, indicating the application value of MOF-5 in PEO-based solid polymer electrolyte.
composite polymer electrolyte; MOF-5; polyethylene oxide (PEO); anion receptor; interfacial stability; lithium ion battery
10.11817/j.issn.1672-7207.2015.04.003
O646
A
1672−7207(2015)04−1189−08
2014−05−11;
2014−07−21
国家自然科学基金资助项目(51274239)(Project (51274239) supported by the National Natural Science Foundation of China)
刘晋,博士,教授,从事表界面分析及固体电解质研究;E-mail:liujincsu@163.com

