氰戊菊酯对斑马鱼和稀有鮈鲫不同生命阶段的毒性效应
蒋金花,陈江滨,吴声敢,俞瑞鲜,王彦华,苍涛,蔡磊明,赵学平
浙江省农业科学院农产品质量标准研究所省部共建国家重点实验室培育基地—浙江省植物有害生物防控重点实验室,农业部农药残留检测重点实验室,杭州 310021
氰戊菊酯对斑马鱼和稀有鮈鲫不同生命阶段的毒性效应
蒋金花,陈江滨,吴声敢,俞瑞鲜,王彦华,苍涛,蔡磊明,赵学平*
浙江省农业科学院农产品质量标准研究所省部共建国家重点实验室培育基地—浙江省植物有害生物防控重点实验室,农业部农药残留检测重点实验室,杭州 310021
为探明氰戊菊酯对鱼类不同生命阶段的毒性效应,以斑马鱼和稀有鮈鲫为测试生物,评价了氰戊菊酯对斑马鱼和稀有鮈鲫不同生命阶段的急性毒性差异。研究发现,氰戊菊酯对斑马鱼和稀有鮈鲫胚胎的96 h-LC50值分别为0.901 (0.664~1.22)和0.636 (0.233~1.74) mg·L-1。氰戊菊酯对稀有鮈鲫胚胎孵化有明显的促进作用,染毒48 h后,0.188和0.375 mg·L-1氰戊菊酯对稀有鮈鲫胚胎的孵化率分别为88.9%和100%。氰戊菊酯对斑马鱼仔鱼、幼鱼和成鱼的96 h-LC50值分别为0.00340、0.0183、0.00487 mg·L-1,氰戊菊酯对稀有鮈鲫仔鱼、幼鱼和成鱼的96 h-LC50值分别为0.0520、0.00277、0.00345 mg·L-1。因此,氰戊菊酯对斑马鱼不同生命阶段的毒性从高到低顺序依次为:仔鱼>成鱼>幼鱼>胚胎,氰戊菊酯对稀有鮈鲫胚胎、仔鱼、幼鱼和成鱼的毒性为幼鱼>成鱼>仔鱼>胚胎。试验结果表明,斑马鱼仔鱼对氰戊菊酯的敏感性高于稀有鮈鲫相应的生命阶段,相对于斑马鱼,稀有鮈鲫胚胎、幼鱼以及成鱼对氰戊菊酯的毒性作用更为敏感,说明氰戊菊酯对斑马鱼和稀有鮈鲫不同生命阶段的毒性效应差异较大。
氰戊菊酯;斑马鱼;稀有鮈鲫;急性毒性
氰戊菊酯是拟除虫菊酯类农药的主要品种,具有高效、低残留等特点,在各国得到广泛使用,2011年我国农业部已将氰戊菊酯列为蔬菜、水果检测农药残留重点监测对象之一。随着农药的广泛使用,农药残留及其对环境污染、健康和食品安全产生的危害问题已成为公众关注的热门话题。对国内外多种蔬菜、水果和茶叶的调查中均有发现氰戊菊酯残留[1-3],国外土壤检测也显示氰戊菊酯大量残留[4]。农药在施用过程中约有1%作用于目标生物,大量残余的农药留于土壤中并通过雨水冲刷等途径进入水体进而造成水污染,鱼类是水环境中的主要生物之一,鱼类的生态毒理反应和变化可作为水环境评价的良好指标。现有研究发现,氰戊菊酯对不同鱼类的急性毒性差异大,氰戊菊酯对胭脂鱼幼鱼96 h的LC50值为2.0 μg·L-1[5],对斑马鱼成鱼96 h的急性毒性LC50值为0.09 μg·L-1[6],对金鱼96 h的急性毒性LC50值为12.5 μg·L-1[7]。目前,关于氰戊菊酯对鱼类的急性毒性研究较多,而对鱼类不同生命阶段的毒性影响报道相对较少,因此研究氰戊菊酯对鱼类不同生命阶段的毒性效应,为氰戊菊酯风险管理和安全使用提供更加全面的毒理学依据。
鱼类的毒性实验在研究水污染和水环境中占有重要地位,目前OECD、EPA、ISO等各国组织机构常用的生态毒性检测鱼种是斑马鱼,他们将化学品对斑马鱼急/慢性毒性作为评价污染物对水生环境危害程度的指标。2003年我国颁布的《新化学物质环境管理办法》中明确规定,“新化学物质的生态毒理学数据必须包括在中国境内用中国的供试生物完成的测试数据”,其中要求在鱼的毒性试验中应选择稀有鮈鲫(Gobiocypris rarus)为试验生物[8]。稀有鮈鲫是一种中国特有的淡水鱼类,主要生活于支流的沟渠等小水体中,分布于中国四川省汉源县等地,具有性成熟快、易于饲养,实验室内可周年产卵、连续产卵等优点。现有试验表明,稀有鲍鲫对重金属、农药等化学品非常敏感,是进行化学品毒性测试和环境水样毒性实验的理想材料[9-10]。一般情况下,以一种鱼类模式生物的急性毒性结果作为化学品的生态毒理学数据,可能会造成对本土生物的欠保护或过保护,也无法对化学品的安全性作出全面的评价。因此,本研究以斑马鱼和稀有鮈鲫为供试生物模型,研究了氰戊菊酯对斑马鱼和稀有鮈鲫不同生命阶段的毒性效应,通过比较氰戊菊酯对斑马鱼和稀有鮈鲫的毒性差异,补充、完善氰戊菊酯对水生生物尤其是我国特有鱼种稀有鮈鲫的毒性效应数据库,进而为稀有鮈鲫发展成为国际通用种提供理论数据支撑。试验结果对进一步研究氰戊菊酯的致毒机制具有一定的现实意义,也为评价氰戊菊酯的安全使用及环境监测提供科学依据。
1 材料与方法(Materials and methods)
1.1仪器与试剂
仪器:24孔细胞培养板和6孔细胞培养板均购自浙江拱东医疗科技有限公司,分别作为胚胎和仔鱼染毒器具;
试剂:氰戊菊酯原药(90%),杭州庆丰农化有限公司;分析纯吐温-80(国药集团化学试剂有限公司);N,N-二甲基甲酰胺(DMF),天津市福晨化学试剂厂。
1.2实验材料
稀有鮈鲫种鱼购自江苏无锡中科水质环境技术有限公司,斑马鱼种鱼购自武汉中科院水生生物研究所的国家斑马鱼资源中心,AB型品系,本试验所用斑马鱼和稀有鮈鲫的胚胎、仔鱼、幼鱼和成鱼均为种鱼繁殖所得。斑马鱼和稀有鮈鲫胚胎分别为同一天收集的健康胚胎;仔鱼为孵化后8日龄;幼鱼为孵化后55日龄;成鱼为3月龄。仔鱼、幼鱼和成鱼均于正式试验前24 h停止投饵。
试验用水为曝气除氯并经活性炭过滤的自来水,水温为(25±1) ℃,pH控制在6.5~7.5,光/暗比为14 h/10 h,溶解氧≥5.8 mg·L-1。
1.3试验方法1.3.1试验药液配制
氰戊菊酯原药用吐温-80和DMF溶解,经超声混匀定容后配制成一定浓度的标准储备液,冷藏备用。试验时,用移液器吸取适量储备液加入一定量的标准稀释水,超声混匀,按相应倍数逐级稀释至设计浓度。试验期间,各试验容器内的助溶剂DMF在水中的最终浓度均低于0.001mg·L-1。标准稀释水按照《化学品鱼类急性毒性试验》[11]方法配制。
1.3.2胚胎染毒试验
参考世界经济合作与发展组织(OECD)方法[12],通过立体显微镜观察,挑选发育正常的健康受精卵供试。采用24孔细胞培养板,每孔加入2 mL供试药液并放入1枚受精卵。根据预备试验结果,设定氰戊菊酯对斑马鱼和稀有鮈鲫胚胎毒性试验浓度(表1),按最高浓度组的助剂浓度设置助剂对照组,以稀释水为空白对照组。每浓度设3次重复,每重复为1个24孔板。
染毒期间环境温度为(25±1) ℃,光/暗比为14 h/10 h。每24 h更换1次溶液。试验期间分别于染毒6、24、48、72、96 h观察并记录死亡数、孵化数及相关中毒症状,并及时取出死亡个体。
1.3.3仔鱼、幼鱼和成鱼试验
参考OECD TG 203[13]方法,设计氰戊菊酯对不同生命阶段斑马鱼和稀有鮈鲫的急性毒性试验。试验用水为曝气除氯并经活性炭过滤的自来水。根据预备试验结果,设定斑马鱼和稀有鮈鲫仔鱼、幼鱼和成鱼的试验浓度(表1),按最高浓度组的助剂浓度设助剂对照组,以曝气自来水为空白对照组。
仔鱼急性毒性试验采用6孔板,每孔放入3条仔鱼,设2次重复,每重复为1个6孔板;幼鱼和成鱼采用6 L鱼缸,每缸15条鱼,均设2次重复。仔鱼、幼鱼和成鱼的试验过程均采用“半静态法” ,每24 h更换1次药液。
试验期间分别于6、24、48、72和96 h时间点观察并记录各组斑马鱼和稀有鮈鲫中毒症状及死亡情况,每隔24 h检查各组的pH值及溶解氧含量,并及时清除死鱼。
1.4数据处理
用DPS数据处理系统9.50标准版计算斑马鱼和稀有鮈鲫胚胎、仔鱼、幼鱼和成鱼的LC50值及其95%置信区间,分析氰戊菊酯对斑马鱼和稀有鮈鲫各生命阶段的毒性差异。
2 结果(Results)
2.1氰戊菊酯对斑马鱼和稀有鮈鲫胚胎的毒性效应
2.1.1致死效应
图1为斑马鱼胚胎经不同浓度氰戊菊酯处理不同时间后的死亡率。24~72 h不同处理组的胚胎死亡率都在20%以下,72~96 h时胚胎死亡率逐渐上升,0.188、0.375、0.750、1.50、3.00、6.00 mg·L-1氰戊菊酯在96 h时的胚胎死亡率分别达到12.5%、12.5%、41.7%、79.2%、87.5%、91.7%。相对于药剂处理组,空白对照组和助剂对照组对斑马鱼胚胎的死亡率没有影响。
图2为稀有鮈鲫胚胎经不同浓度氰戊菊酯处理不同时间后的死亡率。在24~96 h内,随着暴露时间的延长,氰戊菊酯各浓度处理组的胚胎死亡率逐渐增加,在96 h时,0.0234、0.0469、0.0938、0.188、0.375、0.750、1.50 mg·L-1试验组的死亡率分别为0%、5.56%、0%、11.1%、22.2%、50.0%、94.4%。从图2可见,48~96 h为氰戊菊酯对稀有鮈鲫胚胎毒性作用较明显的时间段。相对于药剂处理组,空白对照组和助剂对照组对斑马鱼胚胎的死亡率没有影响。

表1 氰戊菊酯对斑马鱼和稀有鮈鲫不同生命阶段的急性毒性试验浓度

图1 氰戊菊酯对斑马鱼胚胎死亡率的影响Fig. 1 Effect of fenvalerate on mortality rate of zebrafish embryo
结果表明,氰戊菊酯对斑马鱼和稀有鮈鲫胚胎的毒性随处理浓度的增大而增加,同时随暴露时间的延长而增加,具有一定的剂量-效应和时间-效应关系。

图2 氰戊菊酯对稀有鮈鲫胚胎死亡率的影响Fig. 2 Effect of fenvalerate on mortality rate of rare minnow embryo
表2为96 h时氰戊菊酯对斑马鱼和稀有鮈鲫胚胎的半致死浓度(LC50)及95%置信区间。从中可看出,稀有鮈鲫胚胎对氰戊菊酯比较敏感,氰戊菊酯对稀有鮈鲫胚胎的毒性高于斑马鱼胚胎。
2.1.2亚致死效应
从图3可见,不同浓度的氰戊菊酯对斑马鱼胚胎的孵化有微弱的抑制作用。染毒96 h后,0.188、0.375、0.750、1.50、3.00、6.00 mg·L-1氰戊菊酯对斑马鱼胚胎的孵化率分别为91.7%、95.8%、95.8%、91.7%、83.3%、87.5%。空白对照组和助剂对照组对斑马鱼胚胎的孵化率没有影响。
图4为不同浓度氰戊菊酯处理后对稀有鮈鲫胚胎孵化的影响。研究发现,在一定的浓度范围内,高浓度的氰戊菊酯对稀有鮈鲫胚胎的孵化有明显的促进作用,染毒48 h后,助剂对照、空白对照组以及试验组0.0234、0.0469、0.0938、0.188、0.375、0.750、1.50 mg·L-1氰戊菊酯对稀有鮈鲫胚胎的孵化率分别为5.56%、5.56%、0%、0%、16.7%、88.9%、100%、100%、100%,染毒72 h后,试验组与空白对照和助剂对照组胚胎全部孵化。
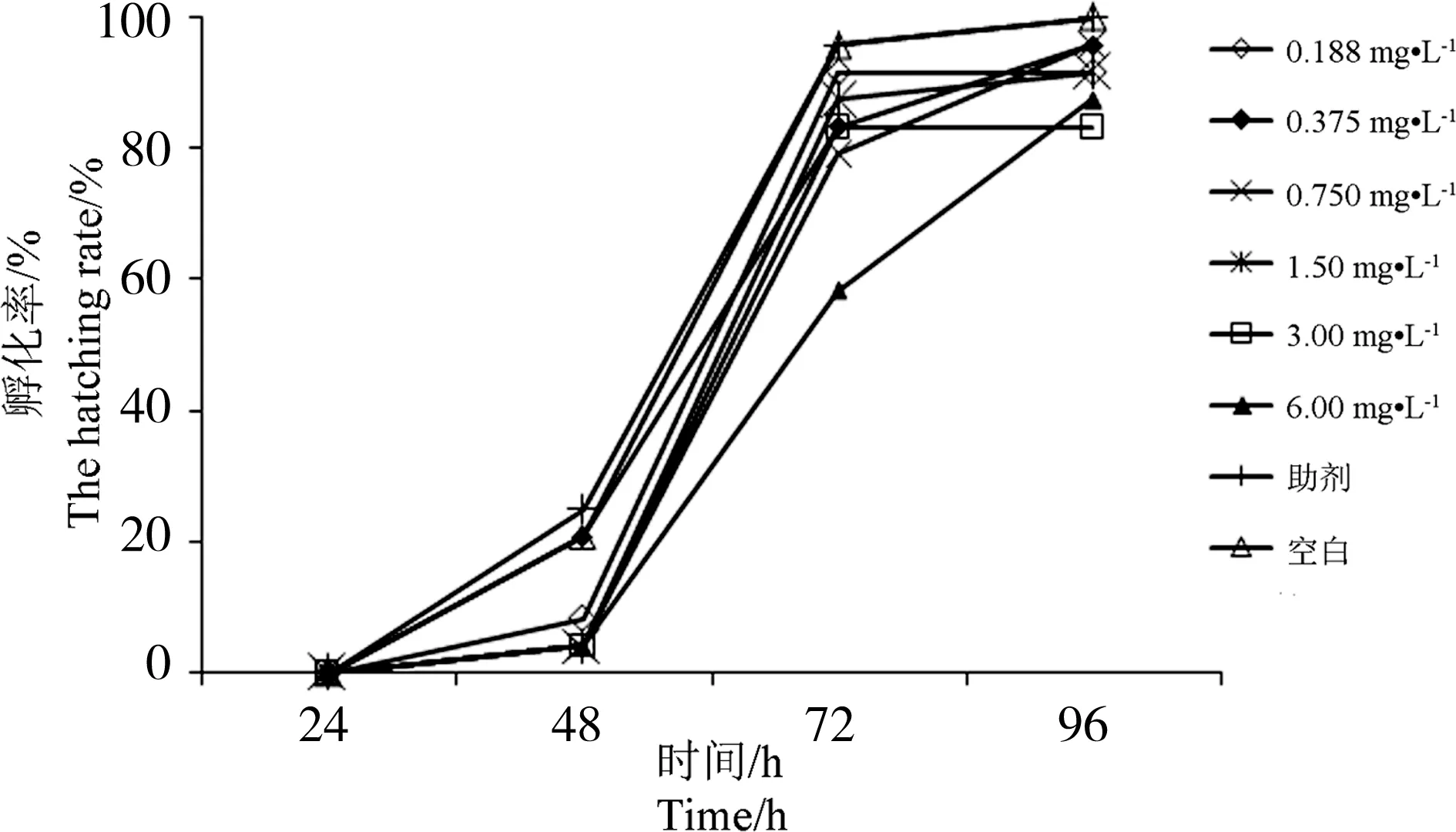
图3 氰戊菊酯对斑马鱼胚胎孵化率的影响Fig. 3 Effect of fenvalerate to hatching rate of zebrafish embryos
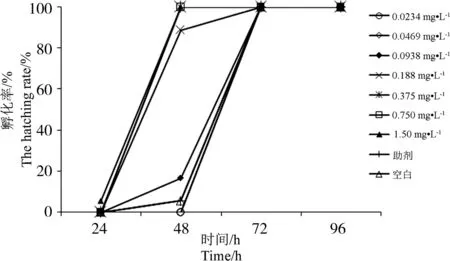
图4 氰戊菊酯对稀有鮈鲫胚胎孵化率的影响Fig. 4 Effect of fenvalerate to hatching rate of rare minnow embryos

表2 氰戊菊酯对斑马鱼和稀有鮈鲫胚胎的急性毒性(96 h)
2.2氰戊菊酯对斑马鱼和稀有鮈鲫仔鱼、幼鱼和成鱼的急性毒性
研究发现,随着氰戊菊酯浓度的增加,斑马鱼和稀有鮈鲫仔鱼、幼鱼和成鱼的死亡率都出现逐渐上升的趋势,说明氰戊菊酯和毒性之间存在剂量-效应关系。斑马鱼和稀有鮈鲫成鱼对氰戊菊酯的最终中毒症状主要表现为游动变得迟缓,对外界刺激变得迟钝,嘴开合速度降慢,个别鱼出现侧翻失衡及沉底现象,最终死亡。氰戊菊酯处理后,斑马鱼和稀有鮈鲫仔鱼和幼鱼的中毒症状没有成鱼明显,随着染毒时间的延长,个别鱼体出现侧翻,脊柱弯曲或者鱼体变白腐烂。空白组和助剂对照组鱼游动正常,无异常症状。
氰戊菊酯对斑马鱼和稀有鮈鲫3个不同生命阶段的急性毒性见表3。由表可见,氰戊菊酯对斑马鱼仔鱼、幼鱼和成鱼的96 h-LC50值分别为0.00340、0.0183、0.00487 mg·L-1,氰戊菊酯对稀有鮈鲫仔鱼、幼鱼和成鱼的96 h-LC50值分别为0.0520、0.00277、0.00345 mg·L-1。因此,氰戊菊酯对斑马鱼仔鱼、幼鱼和成鱼的毒性为:仔鱼>成鱼>幼鱼,氰戊菊酯对稀有鮈鲫仔鱼、幼鱼和成鱼的毒性为:幼鱼>成鱼>仔鱼。研究表明,斑马鱼仔鱼对氰戊菊酯的敏感性高于稀有鮈鲫相应的生长阶段,相对于斑马鱼幼鱼和成鱼,稀有鮈鲫幼鱼和成鱼对氰戊菊酯的毒性作用更为敏感。
3 讨论(Discussion)
鱼类早期发育阶段是对毒性物质最为敏感的阶段,利用鱼类进行污染物毒性研究,可以较精确的掌握污染物对鱼类的影响。我国尚没有建立起标准的实验鱼类,缺乏本土生物的生态毒性数据不但影响了对化学品安全性的全面评价,也难以满足我国化学品管理的需要。因此,本试验分别以胚胎、8日龄仔鱼、55日龄幼鱼和3月龄成鱼为研究样本,以国际通用种斑马鱼和我国特有种稀有鮈鲫为测试生物,研究了氰戊菊酯对斑马鱼和稀有鮈鲫不同生命阶段的毒性效应。目前关于化学品对稀有鮈鲫某一生命阶段的急性毒性或者慢性毒性效应研究较多[14-18],对其不同生命阶段的毒性差异研究还十分有限。研究氰戊菊酯对斑马鱼和稀有鮈鲫生命周期四个典型生命阶段的毒性效应,对氰戊菊酯的生态风险评估以及水体污染的生物监测具有一定的指导意义,在丰富稀有鮈鲫毒性数据库的同时,为制定相关的测试导则和标准提供数据参考。
目前还没有氰戊菊酯对稀有鮈鲫毒性效应的相关研究报道,本研究发现,氰戊菊酯对稀有鮈鲫不同生命阶段的毒性为幼鱼>成鱼>仔鱼>胚胎,对斑马鱼胚胎、仔鱼、幼鱼和成鱼的毒性从高到低顺序依次为:仔鱼>成鱼>幼鱼>胚胎。斑马鱼和稀有鮈鲫胚胎在四个生命阶段中敏感性最低,可能胚胎卵膜起着一定的保护作用。斑马鱼仔鱼对氰戊菊酯的敏感性高于稀有鮈鲫相应的生命阶段,相对于斑马鱼,稀有鮈鲫成鱼、幼鱼以及胚胎对氰戊菊酯的毒性作用更为敏感。有趣的是,在仔鱼、幼鱼和成鱼这三个生命阶段中,氰戊菊酯对斑马鱼幼鱼和稀有鮈鲫仔鱼的毒性效应显著低于斑马鱼和稀有鮈鲫另两个生命阶段,这些毒性差异可能是由于不同生命阶段的个体发育不同,对农药的吸收和代谢能力不同所导致。
近年来,胚胎毒性试验以其特有的优势正逐步成为传统成鱼急性毒性试验的替代手段,也被广泛应用于化合物的致毒和致畸效应研究,孵化率也是评价化合物对鱼类是否产生毒性作用的一个敏感指标[19]。已有研究表明,氰戊菊酯对斑马鱼有一定的致畸效应[20-21],本研究发现,氰戊菊酯的暴露对斑马鱼和稀有鮈鲫也存在致畸作用,可以引起心包水肿、脊柱弯曲、尾部弯曲等症状。试验结果表明,在一定的浓度范围内,较高浓度的氰戊菊酯可明显促进稀有鮈鲫胚胎的孵化,染毒48 h后,0.0938、0.188、0.375、0.750、1.50 mg·L-1氰戊菊酯对稀有鮈鲫胚胎的孵化率分别为16.7%、88.9%、100%、100%、100%,而随着处理浓度的降低,氰戊菊酯对胚胎孵化率的影响则逐步降低,当浓度为0.0234、0.0469 mg·L-1时胚胎孵化率与对照组相当。但在相同试验条件下,氰戊菊酯对斑马鱼胚胎的孵化没有很大的影响。此差异一方面可能是由于稀有鮈鲫胚胎卵膜比较粘稠,有利于吸附氰戊菊酯,另一方面可能是斑马鱼和稀有鮈鲫的卵膜结构存在一定的差异性,推测当高浓度氰戊菊酯处理时,氰戊菊酯可以与稀有鮈鲫卵膜的活性成分相互作用,进而促进卵膜的溶解,因此高浓度的氰戊菊酯对稀有鮈鲫胚胎孵化具有一定的促进作用。而在相同试验条件下,斑马鱼胚胎可以作出应急反应,将卵膜上的膜孔迅速关闭,因此氰戊菊酯对斑马鱼胚胎孵化的影响较小。

表3 氰戊菊酯对斑马鱼和稀有鮈鲫不同生长阶段的急性毒性(96 h)
研究表明,氰戊菊酯对斑马鱼和稀有鮈鲫不同生命阶段的毒性效应差异较大,一方面原因可能是这两种鱼类的起源分布不同,其次是两者的基因组差异,研究表明,斑马鱼的基因组大小为1.8~1.9 Gb,稀有鮈鲫约为1.3 Gb[22],推测基因组的差异以及不同生命阶段基因表达水平的不同导致了斑马鱼和稀有鮈鲫对氰戊菊酯敏感性的差异。因此,进一步从分子水平研究氰戊菊酯对斑马鱼和稀有鮈鲫不同生命阶段的毒性效应,对于阐明氰戊菊酯的生态毒理学机制具有一定的指导意义。此外,目前农药对鱼类的毒性等级划分仅局限于成鱼阶段[23],而本研究表明不同生命阶段的鱼类对农药的敏感性差异较大,因此为了更好的评价农药的水生毒性效应,应进一步开展不同种类农药对鱼类不同生命阶段的毒性效应,寻找毒性效应的规律和机制,为制定相应的毒性判断标准提供参考数据,也为农药安全使用及环境监测提供科学依据。
通讯作者简介:赵学平(1969-),男,本科,研究员,主要研究方向为农药应用与毒理学,发表学术论文60余篇。
[1]Koesukwiwat U, Lehotay S J, Leepipatpiboon N. Fast, low-pressure gas chromatography triple quadrupole tandem mass spectrometry for analysis of 150 pesticide residues in fruits and vegetables [J]. Journal of Chromatography A, 2011, 1218(39): 7039-7050
[2]张力群, 张宜明, 王妹婷, 等. 杭州市市售蔬菜拟除虫菊酯类农药残留现状调查分析[J]. 中国卫生检验杂志, 2013, 23(17): 3423-3424, 3427
Zhang L Q, Zhang Y M, Wang S T, et al. Investigation on the pyrethrin pesticide residues in vegetables in Hangzhou city [J]. Chinses Journal of Health Laboratory Technology, 2013, 23(17): 3423-3424, 3427 (in Chinese)
[3]Wang M, Kang H, Xu D, et al. Label-free impedimetric immunosensor for sensitive detection of fenvalerate in tea [J]. Food Chemistry, 2013, 141(1): 84-90
[4]Yu F B, Shan S D, Luo L P, et al. Isolation and characterization of a Sphingomonas sp strain F-7 degrading fenvalerate and its use in bioremediation of contaminated soil [J]. Journal of Environmental Science and Health Part B-Pesticides Food Contaminants and Agricultural Wastes, 2013, 48(3): 198-207
[5]陈昕, 胡石柳. 几种常见农药对胭脂鱼幼鱼的急性毒性研究[J]. 江西水产科技, 2008, 4: 20-23
[6]吕爱军, 李晓芹, 胡秀彩, 等. 硫酸铜和氰戊菊酯对斑马鱼急性毒性试验[J]. 安全与环境学报, 2011, 11(2): 8-11
Lv A J, Li X Q, Hu X C, et al. Acute toxicity of copper sulfate and fenvalerate to zebrafish (Brachydanio rerio) [J]. Journal of Safety and Environment, 2011, 11(2): 8-11 (in Chinese)
[7]刘慎. 氰戊菊酯对金鱼的急性毒性试验及残留测定[J]. 水产科学, 2004, 23(11): 21-22
Liu S. Acute toxicity and residues of fenvalerate to Carassius auratus [J]. Fisheries Science, 2004, 23(11): 21-22 (in Chinese)
[8]国家环境保护总局. 新化学物质环境管理办法[EB/OL]. [2014-11-14]. http:// www.zhb.gov.cn/gkml/hbb/bl/201002/t20100201_185231.htm
SEPA. Measures for environmental management of new chemical substances [EB/OL]. [2014-11-14].
http://www.zhb.gov.cn/ gkml/hbb/bl/201002/t20100201_185231.htm (in Chinese)
[9]曹文宣, 王剑伟. 稀有鮈鲫——一种新的鱼类实验动物[J].实验动物科学与管理, 2003, 20: 96-99
Cao W X, Wang J W. Rare minnow: A new laboratory animal in China [J]. Laboratory Animal Science and Administration, 2003, 20: 96-99 (in Chinese)
[10]王剑伟. 稀有鮈鲫的繁殖生物学[J]. 水生生物学报, 1992, 16(2): 165-175
Wang J W. Reproductive biology of Gobiocypris rarus [J]. Acta Hydrobiologica Scinica, 1992, 16(2): 165-175 (in Chinese)
[11]中国国家标准化管理委员会. GB/T27861-2011 化学品鱼类急性毒性试验[S]. (2011-12-30).
SAC. GB/T27861-2011 Chemicals-Fish Acute Toxicity Test [S]. (2011-12-30). (in Chinese)
[12]Organization for Economic Co-operation and Development (OECD). Test No. 236: Fish Embryo Acute Toxicity (FET) Test [S]. (2013-7-26).
[13]Organization for Economic Co-operation and Development (OECD). Test No. 203: Fish,Acute Toxicity Test [S]. (1992-7-17).
[14]李莉, 马陶武, 吴振斌. 生活污水对稀有鮈鲫的毒性效应研究[J]. 水生生物学报, 2004, 28(1): 40-44
Li L, Ma T Y, Wu Z B.Toxic effect of domestic sew age on rare minnow (Gobiocypris rarus) [J]. Acta Hydrobiologica Sinica, 2004, 28(1): 40-44 (in Chinese)
[15]熊力, 马永鹏, 毛思予, 等. 五氯酚对稀有鮈鲫胚胎毒性效应研究[J]. 中国环境科学, 2012, 32(2): 337-344
Xiong L, Ma Y P, Mao S Y, et al. Toxic effects of pentachlorophenol on the Chinese rare minnow embryos [J]. China Evironmental Science, 2012, 32(2): 337-344(in Chinese)
[16]廖朝选, 杨鸿波, 杨昌彪, 等. 邻香草醛对稀有鮈鲫的急性毒性研究[J]. 贵州科学, 2013, 31(6): 69-71
Liao C X, Yang H B, Yang C B, et al. Research of acute toxicity of o-vanillin on Gobiocypris rarus [J]. Guizhou Science, 2013, 31(6): 69-71 (in Chinese)
[17]塔娜, 房彦军, 林本成, 等. 磷酸三(2,3-二氯丙基)酯阻燃剂对稀有鮈鲫的毒性效应[J]. 生态毒理学报, 2013, 8(5): 757-762
Ta N, Fang Y J, Lin B C, et al. Toxic effect of tri (2,3-dichloroprophyl) phosphate flame retardant on rare minnow (Gobiocypris rarus) [J]. Asian Journal of Ecotoxicology, 2013, 8(5): 757-762 (in Chinese)
[18]辛苗苗, 危起伟, 王志坚, 等. 对硝基酚对稀有鮈鲫胚胎的急性毒性[J]. 淡水渔业, 2014, 44(5): 43-48
Xin M M, Wei Q W, Wang Z J, et al. Acute toxicity of P-nitrophenol to Gobiocypris rarus [J]. Freshwater Fisheries, 2014, 44(5): 43-48 (in Chinese)
[19]Lammer E, Cart G J, Wendler K, et a1. Is the fish embryo toxicity test (FET) with the zebrafish (Danio rerio) a potential alternative for the fish acute toxicity test [J]. Comparative Biochemistry and Physiology Part C: Toxicology & Pharmacology, 2009, 149(2): 196-209
[20]Gu A, Shi X, Yuan C, et al. Exposure to fenvalerate causes brain impairment during zebrafish development [J].Toxicology Letters, 2010, 197(3): 188-192
[21]Ma Y, Chen L H, Lu X T, et al. Enantioselectivity in aquatic toxicity of synthetic pyrethroid insecticide fenvalerate [J]. Ecotoxicology and Environmental Safety, 2009, 72: 1913-1918
[22]童金苟, 俞小牧, 张菁, 等. 稀有鮈鲫与其他模式实验鱼类基因组大小的比较[J]. 水生生物学报, 2003, 27(2): 208-210
Tong J G, Yu X M, Zhang J, et al. Comparison of genome size of rare minnow (Gobiocypris rarus) with other model fishes [J]. Acta Hydrobiologica Scinica, 2003, 27(2): 208-210 (in Chinese)
[23]中国国家标准化管理委员会. GB/T 31270.12-2014化学农药环境安全评价试验准则, 第12部分: 鱼类急性毒性试验[S]. (2014-10-10).
SAC. GB/T 31270.12-2014 Guidelines on Environmental Safety Assessment for Chemical Pesticides, Part 12: Fish Acute Toxicity Test [S]. (2014-10-10). (in Chinese)
◆
Toxicity Effects of Fenvalerate to Different Life Stages of Zebrafish (Daniorerio) and Chinese Rare Minnow (Gobiocyprisrarus)
Jiang Jinhua, Chen Jiangbin, Wu Shenggan, Yu Ruixian, Wang Yanhua,Cang Tao, Cai Leiming, Zhao Xueping*
State Key Lab Breeding Base for Zhejiang Sustainable Plant Pest Control, Key Lab for Pesticide Residue Detection of Ministry of Agriculture, Institute of Quality and Standard for Agro-Products, Zhejiang Academy of Agricultural Sciences, Hangzhou 310021, China
10 February 2015accepted 13 May 2015
To explore the toxic effects of fenvalerate on fish, the acute toxicity of fenvalerate to zebrafish (Danio rerio) and Chinese rare minnow (Gobiocypris rarus) at different life stages were evaluated. The results showed that the 96 h LC50values of fenvalerate to the embryos of zebrafish and rare minnow was 0.901 (0.664~1.22) and 0.636 (0.233~1.74) mg·L-1, respectively. The hatching rate of rare minnow embryos was significantly increased after the exposure to 0.188 and 0.375 mg·L-1fenvalerate for 48 h, and the hatching rate was 88.9% and 100%, respectively. The 96 h LC50values of fenvalerate to larvae, juvenile and adult of zebrafish was 0.00340, 0.0183, 0.00487 mg·L-1, respectively. For the toxicity of fenvalerate to larvae, juvenile and adult of rare minnow, the 96 h LC50values was 0.0520, 0.00277, 0.00345 mg·L-1, respectively. The trend of acute toxicity of fenvalerate to zebrafish and rare minnow at different life stages was as follows: larvae>adult>juvenile>embryos for zebrafish, and juvenile>adult>larvae>embryos for rare minnow. Results demonstrated that zebrafish and rare minnow at different life stages exhibited the different levels of sensitivity to fenvalerate, and rare minnow was more sensitive to fenvalerate at the life stages of embryos, larvae and adult than zebrafish.
fenvalerate; zebrafish (Danio rerio); Chinese rare minnow (Gobiocypris rarus); acute toxicity
浙江省农业科学院科技创新能力提升工程项目
蒋金花(1985-),女,博士,研究方向为农药毒理学,E-mail: jinhuajjh@sina.com;
Corresponding author), E-mail: zhaoxueping@tom.com
10.7524/AJE.1673-5897.20150210001
2015-02-10 录用日期:2015-05-13
1673-5897(2015)6-269-07
X171.5
A
蒋金花, 陈江滨, 吴声敢, 等. 氰戊菊酯对斑马鱼和稀有鮈鲫不同生命阶段的毒性效应[J]. 生态毒理学报,2015, 10(6): 269-275
Jiang J H, Chen J B, Wu S G, et al. Toxicity effects of fenvalerate to different life stages of zebrafish (Danio rerio) and Chinese rare minnow (Gobiocypris rarus) [J]. Asian Journal of Ecotoxicology, 2015, 10(6): 269-275 (in Chinese)

