5种化学品对丽斑麻蜥和日本鹌鹑的毒性研究
常静,杨淞霖,戴欣,李济彤,王会利,瞿唯钢
1. 中国科学院生态环境研究中心环境生物技术重点实验室,北京100085 2. 中国农业部农药检定所,北京100125
5种化学品对丽斑麻蜥和日本鹌鹑的毒性研究
常静1,杨淞霖1,戴欣1,李济彤1,王会利1,瞿唯钢2,*
1. 中国科学院生态环境研究中心环境生物技术重点实验室,北京100085 2. 中国农业部农药检定所,北京100125
目前,在化学品生态风险评价体系中对爬行动物的毒性效应研究较少。本研究参考鸟类急性经口毒性试验建立了我国本土爬行动物——丽斑麻蜥(Eremias argus)的急性毒性测试方法,来评价化学品对爬行动物和鸟类的毒性效应之间的差异。选择异氰酸酯、1,2-苯并异噻唑-3-酮、2,4-二氯苯酚、苯并噻唑和二苯甲酮5种化学品分别对丽斑麻蜥进行暴露实验,并与鸟类模式物种——日本鹌鹑(Coturnix japonica)的急性毒性结果进行比较。结果发现异氰酸酯和苯并噻唑对丽斑麻蜥7 d的半数致死剂量(7 d-LD50)分别为125 mg·kg-1和500 mg·kg-1,而对日本鹌鹑的7 d-LD50值分别为27 mg·kg-1和37 mg·kg-1;1,2-苯并异噻唑-3-酮、2,4-二氯苯酚和二苯甲酮对丽斑麻蜥的7 d-LD50值分别为909 mg·kg-1、787 mg·kg-1和528 mg·kg-1,而对日本鹌鹑7 d-LD50值均大于剂量上限1 000 mg·kg-1。结果表明,丽斑麻蜥和日本鹌鹑对相同化学品的毒性敏感性是存在差异的,用鸟类来评价化学品对爬行动物的潜在风险可能不够准确,应该重视化学品对爬行动物的毒性效应研究。同时,以本土爬行动物的代表物种丽斑麻蜥作为化学品环境风险评价的模式生物,对保护我国本土物种及其多样性、维持生态平衡具有重要意义。
爬行动物;丽斑麻蜥(Eremias argus);日本鹌鹑(Coturnix japonica);急性毒性
爬行动物是脊椎动物的重要组成部分,其种类仅次于鸟类,是第二大类陆地脊椎动物。爬行动物在食物链中占据重要位置,对维护自然生态平衡起重要作用。而在脊椎动物环境毒理学研究中,很多学者以鸟类作为模式生物来评价化学品对陆生脊椎动物的风险[1],对爬行动物的研究相对较少,仅有不到1%的研究是关于爬行动物毒理学的[2-3]。近年来,爬行动物的种群数量呈现出严重下降的趋势,引起了毒理学家对自然界中爬行动物受污染状况的广泛关注[4]。如研究污染物对鳄鱼、海龟和蜥蜴的内分泌干扰作用[5]以及爆炸物[6]、有机磷酸酯类污染物[7]、农药[8-9]和重金属[10]在蜥蜴体内的富集与代谢。
据美国鱼和野生动物保护协会统计,爬行动物种类共计7 150种,其中蜥蜴物种有5 066种[4]。蜥蜴作为爬行动物中最庞大的家族,是研究爬行动物毒理学较为理想的模式生物[11],对蜥蜴的研究就爬行动物而言具较强的代表性。近年来,对蜥蜴毒性的研究仅限于测定蜥蜴体内各种农药及重金属在不同组织中的残留量[9-10,12-13],污染物暴露对蜥蜴活动能力、进食量和生长的影响[14-15],对体内酶活性的影响[16-17]以及毒物暴露之后对蜥蜴睾丸形态学的变化[18]。面对化学品对爬行动物的毒性数据还十分缺乏的现状,环境风险评估人员在进行化学品对爬行动物的风险评价时经常用鸟类来替代[19]。而该建议必须满足2个前提条件:第一,鸟类对化学品的敏感性高于爬行动物;第二,鸟类对化学品的吸收量大于爬行动物。但是由于蜥蜴独特的生理特征和生活习性,它们对化学品的敏感度可能与鸟类不一致,甚至高于鸟类,因此亟待开展以蜥蜴作为模式生物的爬行动物毒性测试方法研究。
由于不同的国家和地区分布的蜥蜴物种不尽相同,各国学者多围绕本土的蜥蜴物种展开毒理学研究。因为本土物种易受环境干扰,对环境变化更为敏感,能更好地反应当地的环境变化。选用本土物种进行毒理学研究对维护本地生态系统稳定、维持物种多样性也具有重要意义。在亚洲,Trinchella等[20]和Alexander等[21]学者用丽斑麻蜥(Eremias argus)和白条草蜥(Takydromus wolteri)来评价污染物对爬行动物的影响;在欧洲,Amaral等[22]学者用意大利壁蜥(Podarcis sicula)做爬行动物毒理学研究;在北美地区,近年来由于围栏蜥蜴(Sceloporus occidentalis)具有体型小、成熟所需时间较短、易在实验室繁殖等特点,许多学者将它作为化学品环境风险评价的受试生物[16,23]。丽斑麻蜥是我国重要的蜥种,隶属于蜥蜴目、麻蜥属,以昆虫为食,广泛地分布于河北、山西、陕西、内蒙古等地区。选用中国本土爬行物种——丽斑麻蜥作为受试生物评价化学品对爬行动物的毒性,对于我国的化学品环境管理可能更有意义。
综上所述,本研究选用我国本土爬行物种丽斑麻蜥为受试生物,在参考鸟类急性经口毒性试验方法的基础上,初步建立了基于丽斑麻蜥的化学品急性毒性测试方法。对异氰酸酯、1,2-苯并异噻唑-3-酮、2,4-二氯苯酚、苯并噻唑和二苯甲酮5种化学品进行丽斑麻蜥急性毒性试验,并与鸟类模式物种——日本鹌鹑(Coturnix japonica)的毒性进行对比,为评价化学品对爬行动物的毒性提供了科学依据。
1 材料与方法 (Materials and methods)
1.1器材与试剂
主要器材为30(长) cm×30(宽) cm×20(高) cm和5(长) m×1.2(宽) m×0.4(高) m的玻璃缸;金属网孔笼,规格为80(长) cm×50(宽) cm×50(高) cm。异氰酸酯(上海岚克医药科技发展有限公司,分析纯);1,2-苯并异噻唑-3-酮、2,4二氯苯酚、苯并噻唑(百灵威集团化学有限公司,分析纯);二苯甲酮(阿拉丁试剂有限公司,分析纯)。50 μL进样针以及25 W UVB3.0太阳灯。
1.2实验材料
丽斑麻蜥:种源来自于内蒙古阿巴嘎旗,经实验室自行饲养与繁殖。在5 m×1.2 m×0.4 m室内玻璃缸中饲养,缸内铺盖10 cm的软土。温度控制在(27.5±2.5) ℃,相对湿度为(45%±15%)。使用6盏100 W的白炽灯提供光照并维持光照时较高的温度,光暗比控制在14 h:10 h。每天分2次投喂黄粉虫幼虫(Tenebriomolitor L.),每2天提供1次水源,不定时喷水。每周清理1次脱皮、粪便及食物残渣。丽斑麻蜥已在实验室内饲养繁殖超过3年,可满足实验要求。
日本鹌鹑:购自北京密云兴盛养殖场,经实验室自行饲养与繁殖。日本鹌鹑在14 d龄之前容易出现死亡,在此期间,温度控制在(35±3) ℃,相对湿度为(60%±10%)。14 d龄后,温度每天降低1 ℃,最终控制在(25±2) ℃,湿度不变。对于10 d龄之前的幼体鹌鹑的饮用水为温水,24 h光暗比为20 h :4 h,光照时间逐日递减1 h,直至达到自然光照水平。在进入成熟期(30 d龄)后,将日本鹌鹑按雌雄比3:1进行分笼饲养。
1.3毒性试验
实验所用丽斑麻蜥来自同一种群,2年龄成熟蜥蜴,体重在(3.5±1.0) g。根据预试验确定的浓度范围按一定间距设置5个剂量组,每组随机选择10只蜥蜴(雌雄各半),并设空白对照组,分别放在30 cm×30 cm×20 cm的玻璃缸中。实验条件与饲养条件一致。试验开始24 h前停止喂食,仅供清水。试验用蜥蜴以经口灌胃法一次性给药5~10 μL·g-1体重,连续7 d观察试验用蜥蜴的死亡情况与中毒症状,试验期间正常饲喂。记录各处理组受试蜥蜴的死亡数,对试验数据进行数理统计,求出LD50值。
日本鹌鹑急性经口毒性实验参照GB/T 31270—2014《化学农药安全评价试验准则》[24]及OECD相关标准[25]。实验选择来自同一批次30 d龄的鹌鹑,体重在(100±10) g。根据预实验设置5个剂量组,每组10只鹌鹑,雌雄各半,并设置空白对照组。各组鹌鹑分别放入金属网孔笼中。试验前一天停止喂食,仅供清水。供试鹌鹑以经口灌注法一次性给药10 mL·kg-1体重,连续7 d观察记录鹌鹑的死亡情况以及中毒症状,求出LD50。
1.4数据处理
使用SPSS数据处理软件进行Probit线性回归分析,得到其LD50值。
2 结果(Results)
对丽斑麻蜥和日本鹌鹑进行了5种化学品的急性经口毒性试验,7 d-LD50值的比较结果如表1所示。
在丽斑麻蜥的急性经口毒性实验中,经口灌胃苯并噻唑、二苯甲酮、1,2-苯并异噻唑-3-酮和2,4-二氯苯酚后,处理组中观察到丽斑麻蜥出现眼睛紧闭、活动能力减弱的现象,几个小时之后逐渐恢复。但是发现蜥蜴进食量逐日减少,体重也随之下降。丽斑麻蜥暴露于500 mg·kg-1的异氰酸酯后,与对照组相比,随着时间的延长蜥蜴活动量日益减少,出现嗜睡、精神恍惚、皮肤皱起等现象,有些蜥蜴腹部出现淤青甚至死亡。将死亡的蜥蜴进行解剖,发现部分蜥蜴体内出现组织溃烂现象。由实验结果可以看出,随着浓度的升高死亡率不断增加,二者呈良好的S型剂量-效应关系。由SPSS软件计算得出异氰酸酯和苯并噻唑的7 d-LD50值分别为125 mg·kg-1和500 mg·kg-1。而二苯甲酮、1,2-苯并异噻唑-3-酮、2,4-二氯苯酚的7 d-LD50值分别为528 mg·kg-1、909 mg·kg-1和787 mg·kg-1。
对日本鹌鹑进行了以上5种化学品的急性经口毒性实验,实验中观察到,与对照组相比鹌鹑在用异氰酸酯和苯并噻唑灌胃后低剂量组没有明显的中毒症状,但是在高剂量组几分钟内就出现肌肉震颤、羽毛耸立、头部下垂等现象,日饮食量也有明显的减少,体重在不断下降。实验结果表明,异氰酸酯和苯并噻唑的LD50值分别为27.4 mg·kg-1和36.8 mg·kg-1,参考《化学农药安全评价实验准则》的毒性分级标准[24],异氰酸酯和苯并噻唑对日本鹌鹑的急性经口毒性为高毒。二苯甲酮、1,2-苯并异噻唑-3-酮、2,4-二氯苯酚在上限剂量1 000 mg·kg-1时,日本鹌鹑都没有出现死亡现象,属于低毒性。
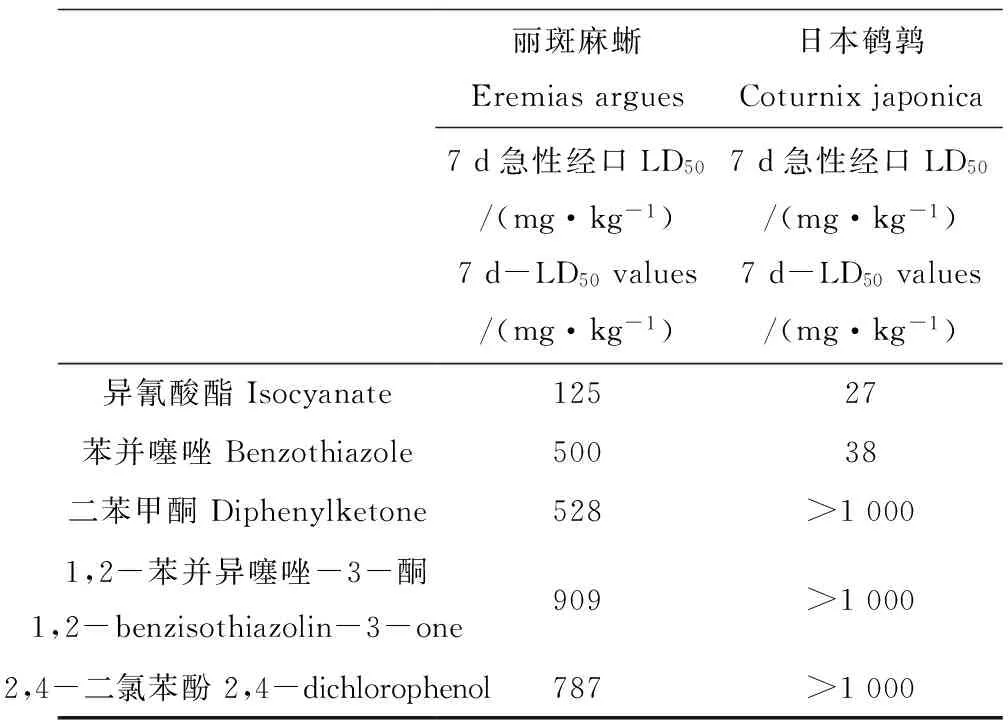
表1 5种化学品对丽斑麻蜥和日本鹌鹑的7 d-LD50值比较
3 讨论(Discussion)
在陆生脊椎动物中,鸟类是重要的受试生物,在目前的化学品环境风险评价中仍以日本鹌鹑作为陆生脊椎动物的代表物种。然而,由于生物学特征存在种属差异,化学品对于不同近缘种的毒性可能也存在差异,所以化学品对鸟类的毒性并不一定能够真实地反映其对爬行动物造成的影响。近年来,随着环境污染的加重,爬行动物数量在不断减少,而化学品对爬行动物的影响却遭到很多学者的忽视。目前,环境污染物对爬行动物的毒性测试还没有建立标准方法。现在用于毒性研究的爬行动物主要有蛇、龟和蜥蜴等。但由于蛇和龟的体型较大、不易获得和饲养等特点,不太适合作为毒性测试的模式生物。与之相比蜥蜴被认为是理想的受试生物来研究化学品对爬行动物的毒性。对蜥蜴进行毒物暴露的方式主要有经皮、经口灌胃和经口饲喂3种,根据定量的需要,以经口灌胃方式最为常用。本研究采用经口灌胃的暴露方式初步建立了丽斑麻蜥的急性毒性测试方法。
本研究对5种化学品进行了丽斑麻蜥和日本鹌鹑的急性毒性试验。结果表明,日本鹌鹑对异氰酸酯和苯并噻唑的毒性反应敏感性明显高于丽斑麻蜥,但是二苯甲酮、1,2-苯并异噻唑-3-酮和2,4-二氯苯酚对丽斑麻蜥的毒性明显高于日本鹌鹑。同时有研究表明,菊酯类农药作为一种神经毒性杀虫剂对蜥蜴的急性毒性是鹌鹑的374.6倍[26]。环三亚基三硝胺(RDX)作为一种军用高能炸药,对美洲鹑的14 d-LD50为187 mg·kg-1是蜥蜴14 d-LD50的2.6倍[27-28]。蜥蜴对菊酯类农药以及爆炸物RDX表现出更加明显的敏感性。马拉硫磷杀虫剂对鹌鹑的半数致死剂量LD50为466.5 mg·kg-1,造成20%西部围栏蜥蜴死亡的剂量为200 mg·kg-1,说明鹌鹑和蜥蜴对马拉硫磷杀虫剂的敏感性相当[29-30]。已有研究表明,苯并噻唑对小鼠的急性经口毒性为900 mg·kg-1,属于中毒,该化学品对丽斑麻蜥的毒性反应敏感性高于小鼠。对水生生物来说,2,4-二氯苯酚对黑头呆鱼的96 h半致死浓度为8.3 mg·L-1,属于中毒[31];对溞状钩虾的半致死效应浓度为2.48 mg·L-1[32],属于中毒。对于2,4-二氯苯酚的毒性效应,水生生物比日本鹌鹑更敏感。上述研究结果表明,对于相同的化学品,它们对不同的生物表现出不同的急性毒性效应。丽斑麻蜥和日本鹌鹑对相同化学品的毒性敏感性是存在差异的,由于爬行动物特殊的代谢系统和生理特征使得它们可能对化学品敏感性更强,因而更容易受到影响[21]。本研究进一步证明目前用化学品对鸟类的毒性来评价其对爬行动物的危害是不准确的,忽略了对爬行动物这一重大类群的毒性研究。因此,亟待开展化学品对爬行动物的环境风险评价研究。
面对化学品对爬行动物毒性数据较为缺乏的现状,近几年国内外选用本土蜥蜴物种进行爬行动物毒理学研究。对于我国而言,丽斑麻蜥作为本土爬行动物,已实现实验室的规模化饲养,是爬行动物毒理学研究中的理想模式生物。在今后的研究中,我们需要继续建立和完善丽斑麻蜥毒性测试方法,积累化学品对爬行动物的毒性数据,将爬行动物逐渐引入到化学品的毒性评价体系中。这是服务于化学品贸易中“绿色”技术壁垒的客观要求,同时也对维持生态平衡以及保护物种多样性具有重要意义。
通讯作者简介:瞿唯钢(1958),男,农艺师,主要从事农药环境毒理研究与农药登记管理。
[1]Vyas N B, Spann J W, Hulse C S, et al. Dermal insecticide residues from birds inhabiting an orchard [J]. Environmental Monitoring and Assessment, 2007, 133(1-3): 209-214
[2]Sparling D W, Linder G, Bishop C A, et al. Recent Advancements in Amphibian and Reptile Ecotoxicology [M]. Ecotoxicology of Amphibians and Reptiles, 2010: 1-11
[3]王瀛寰, 王会利, 张艳峰, 等. 爬行动物应用于毒理学研究的现状[J]. 生态毒理学报, 2012, 7(6): 585-592
Wang Y H, Wang H L, Zhang Y F, et al. Appication of reptiles in toxicology research: A review [J]. Asian Journal of Ecotoxicology, 2012, 7(6): 585-592 (in Chinese)
[4]Gibbons J W, Scott D E, Ryan T J, et al. The global decline of reptiles, Deja Vu amphibians [J]. Bioscience, 2000, 50(8): 653-666
[5]Willingham E. Developmental and reproductive Effects [M]// Gardner S C, Oberdörster E. eds. Toxicology of Reptiles. Taylor & Francis Group, LIC, 2006: 149-171
[6]McFarland C A, Quinn M J, Bazar M A, et al. Toxicity of oral exposure to 2,4,6-trinitrotoluene in the western fence lizard (Sceloporus occidentalis) [J]. Environmental Toxicology and Chemistry, 2008, 27(5): 1102-1111
[7]Bain D, Buttemer W A, Astheimer L, et al. Effects of sublethal fenitrothion ingestion on cholinesterase inhibition, standard metabolism, thermal preference, and prey-capture ability in the Australian central bearded dragon (Pogona vitticeps, Agamidae) [J]. Environmental Toxicology and Chemistry, 2004, 23(1): 109-116
[8]Wang Y H, Guo B Y, Gao Y X, et al. Stereoselective degradation and toxic effects of benalaxyl on blood and liver of the Chinese lizard Eremias argus [J]. Pesticide Biochemistry and Physiology, 2014, 108: 34-41
[9]Wang Y H, Yu D Y, Xu P, et al. Stereoselective metabolism, distribution, and bioaccumulation brof triadimefon and triadimenol in lizards [J]. Ecotoxicology and Environmental Safety, 2014, 107: 276-283
[10]Salice C J, Suski J G, Bazar M A, et al. Effects of inorganic lead on western fence lizards (Sceloporus occidentalis) [J]. Environmental Pollution, 2009, 157(12): 3457-3464
[11]Amaral M J, Bicho R C, Carretero M A, et al. The use of a lacertid lizard as a model for reptile ecotoxicology studies: Part 2-Biomarkers of exposure and toxicity among pesticide exposed lizards [J]. Chemosphere, 2012, 87(7): 765-774
[12]Rich C N, Talent L G. Soil ingestion may be an important route for the uptake of contaminants by some reptiles [J]. Environmental Toxicology and Chemistry, 2009, 28(2):311-315
[13]王瀛寰, 王会利, 张艳峰, 等. 全氟辛烷磺酸盐PFOS替代品对中国白羽鹌鹑的毒性[J]. 生态毒理学报, 2012, 7(5): 537-541
Wang Y H, Wang H L, Zhang Y F, et al. Toxicity of alternatives of perfluorooctane sulfonate( PFOS) to Chinese recessive white feather quail [J]. Asian Journal of Ecotoxicology, 2012, 7(5): 537-541 (in Chinese)
[14]DuRant S E, Hopkins W A, Talent L G. Impaired terrestrial and arboreal locomotor performance in the western fence lizard (Sceloporus occidentalis) after exposure to an AChE-inhibiting pesticide [J]. Environmental Pollution, 2007, 149(1): 18-24
[15]Coppen G D A, Jepson P C. Comparative laboratory evaluation of the acute and chronic toxicology of diflubenzuron, hexaflumuron and teflubenzuron against II instar desert locust, (Schistocerca gregaria) (Orthoptera Acrididae) [J]. Pesticide Science, 1996, 46(2):183-190
[16]Aguilera C, del Pliego P G, Alfaro R M, et al. Pollution biomarkers in the spiny lizard (Sceloporus spp.) from two suburban populations of Monterrey, Mexico [J]. Ecotoxicology, 2012, 21(8): 2103-2112
[17]Wack C L, Fox S F, Hellgren E C, et al. Effects of sex, age, and season on plasma steroids in free-ranging Texas horned lizards (Phrynosoma cornutum) [J]. General and Comparative Endocrinology, 2008, 155(3): 589-596
[18]Cardone A, Comitato R, Angelini F. Spermatogenesis, epididymis morphology and plasma sex steroid secretion in the male lizard Podarcis sicula exposed to diuron [J]. Environmental Research, 2008, 108(2): 214-223
[19]Sample B E, Aplin M S, Efroymson R A, et al. Methods and Tools for Estimation of the Exposure of Terrestrial Wildlife to Contaminants [R]. Oak Ridge, Tennessee USA: Oak Ridge National Laboratory, 1997
[20]Trinchella F, Riggio M, Filosa S, et al. Cadmium distribution and metallothionein expression in lizard tissues following acute and chronic cadmium intoxication [J]. Comparative Biochemistry and Physiology C-Toxicology & Pharmacology, 2006, 144(3): 272-278
[21]Alexander G J, Horne D, Hanrahan S A. An evaluation of the effects of deltamethrin on two non-target lizard species in the Karoo, South Africa [J]. Journal of Arid Environments, 2002, 50(1): 121-133
[22]Amaral M J, Carretero M A, Bicho R C, et al. The use of a lacertid lizard as a model for reptile ecotoxicology studies - Part 1 Field demographics and morphology [J]. Chemosphere, 2012, 87(7): 757-764
[23]Weir S M, Talent L G, Anderson T A, et al. Unraveling the relative importance of oral and dermal contaminant exposure in reptiles: Insights from studies using the western fence lizard (Sceloporus occidentalis) [J]. Plos One, 2014, 9(6): e99666
[24]中华人民共和国国家质量监督检查检疫总局. GB31270—2014化学农药环境安全评价试验准则[S].北京: 中国标准出版社, 2015
[25]OECD. No.223, OECD Guidelines for the Testing of Chemicals: Avian Acute Oral Toxicity Test [S]. Paris, France: OECD, 2010: 24
[26]Weir S M, Suski J G, Salice C J. Ecological risk of anthropogenic pollutants to reptiles: Evaluating assumptions of sensitivity and exposure [J]. Environmental Pollution, 2010, 158(12): 3596-3606
[27]McFarland C A, Quinn M J, Bazar M A, et al. Toxic effects of oral hexahydo-1,3,5-trinitro-1,3,5-triazine in the western fence lizard (Sceloporus occidentalis) [J]. Environmental Toxicology and Chemistry, 2009, 28(5): 1043-1050
[28]Gogal R M, Johnson M S, Larsen C T, et al. Dietary oral exposure to 1,3,5-trinitro-1,3,5-triazine in the northern bobwhite (Colinus virginianus) [J]. Environmental Toxicology and Chemistry, 2003, 22(2): 381-387
[29]Mineau P, Baril A, Collins B T, et al. Pesticide acute toxicity reference values for birds [J]. Reviews of Environmental Contamination and Toxicology, 2001, 170: 13-74
[30]Holem R R, Hopkins W A, Talent L G. Effect of acute exposure to malathion and lead on sprint performance of the western fence lizard (Sceloporus occidentalis) [J]. Archives of Environmental Contamination and Toxicology, 2006, 51(1): 111-6
[31]Phipps G L, Holcombe G W, Fiandt J T. Acute toxicity of phenol and substituted phenols to the fathead minnow [J]. Bulletin of Environmental Contamination and Toxicology, 1981, 26(5): 585-593
[32]Ashauer R, Hintermeister A, Potthoff E, et al. Acute toxicity of organic chemicals to Gammarus pulex correlates with sensitivity of Daphnia magna across most modes of action [J]. Aquatic Toxicology, 2011, 103(1-2): 38-45
◆
Toxicity Assessment of Five Chemicals onEremiasargusandCoturnixjaponica
Chang Jing1, Yang Songlin1, Dai Xin1, Li Jitong1, Wang Huili1, Qu Weigang2,*
1. Research Center for Eco-Environmental Science, Chinese Academy of Sciences, Beijing 100085, China 2. Institute for Control of Agrochemicals, Ministry of Agriculture, Beijing 100125, China
1 February 2015accepted 3 June 2015
Toxicity effects of chemicals have rarely been evaluated in reptiles. In this study, the acute toxicity test method of native reptile-Eremias argus was established in order to evaluate the toxicity of chemicals to reptiles. Eremias argus were exposed to isocyanate, 1,2-benzisothiazolin-3-one, 2,4-dichlorophenol, benzothiazole and diphenylketone respectively in acute oral toxicity test. 7 d-LD50values of lizard were compared with avian model species-Coturnix japonica. According to the results, 7 d-LD50values of isocyanate and benzothiazole to E. argus were 125 mg·kg-1and 500 mg·kg-1while to C. japonica the values were 27 mg·kg-1and 37 mg·kg-1; 7 d-LD50value of 1,2-benzisothiazolin-3-one, 2,4-dichlorophenol and diphenylketone to E. argus were all greater than 1 000 mg·kg-1while to C. japonica the values were 909 mg·kg-1, 787 mg·kg-1and 528 mg·kg-1. The results showed that avian could not be used as surrogate species to reflect the chemical toxicity to reptiles exactly. The toxicity of chemicals to reptiles should be paid more attention. Using native lizard as model animal for reptile ecotoxicology studies will benefit the protection of native reptile species and maintain the ecological balance.
reptile; Eremias argus; Coturnix japonica; acute toxicity
国家自然科学基金(21477152, 21277163)
常静(1990-),女,学士,研究方向为毒理学,E-mail: changjingforever@163.com;
Corresponding author), E-mail: quweigang111@163.com
10.7524/AJE.1673-5897.20150201001
2015-02-01录用日期:2015-06-03
1673-5897(2015)6-276-05
X171.5
A
常静, 杨淞霖, 戴欣, 等. 5种化学品对丽斑麻蜥和日本鹌鹑的毒性研究[J]. 生态毒理学报,2015, 10(6): 276-280
Chang J,Yang S L, Dai X, et al. Toxicity assessment of five chemicals on Eremias argus and Coturnix japonica [J]. Asian Journal of Ecotoxicology, 2015, 10(6): 276-280 (in Chinese)

