氰戊菊酯降解菌的筛选与鉴定及其降解条件优化
史 颖,唐 洁,*,姚 开,曾朝懿,蒋珍菊(.西华大学食品与生物工程学院,四川成都60039;.四川大学轻纺与食品学院,四川成都60065)
氰戊菊酯降解菌的筛选与鉴定及其降解条件优化
史 颖1,唐 洁1,*,姚 开2,曾朝懿1,蒋珍菊1
(1.西华大学食品与生物工程学院,四川成都610039;2.四川大学轻纺与食品学院,四川成都610065)
采用富集培养法从喷施拟除虫菊酯类农药的菜园土壤中,分离得到一株能降解氰戊菊酯的细菌BFE-023。经生理生化和16S rDNA序列分析,将菌株BFE-023鉴定为地衣芽孢杆菌(Bacillus licheniformis)。应用Plackett-Burman实验设计确定了影响该菌株降解氰戊菊酯的主要影响因素,利用响应面分析法优化了其降解条件。在优化条件下,研究菌株BFE-023对氰戊菊酯的降解过程及其中间产物3-苯氧基苯甲酸(3-PBA)的生成规律。结果表明,培养时间和降解体系中氰戊菊酯浓度及氯化铁含量是影响其降解的主要因素,优化条件下60 h内对氰戊菊酯降解率可达到88.71%,与所建立的模型预测值(88.78%)相吻合。菌株BEF-023降解氰戊菊酯的过程中,降解中间产物3-PBA的生成量呈现先明显增加后逐渐减少的趋势,说明菌株BEF-023可能具备继续降解中间产物3-PBA的能力。
氰戊菊酯,生物降解,地衣芽孢杆菌,降解条件优化
氰戊菊酯是应用最早最普遍的一种拟除虫菊酯类杀虫剂,适用于棉花、果蔬、茶叶等作物以及林木、家畜、卫生和仓储等害虫防治[1-2]。不论以何种方式将氰戊菊酯施用于果树等农作物,都会在土壤中残留。研究表明,氰戊菊酯具有蓄积性[3],虽然毒性相对较低,但是长期接触即使是低剂量也会引起慢性疾病[4],不可忽视的是,土壤中氰戊菊酯残留量的持续增加势必会造成环境污染和生态破坏。因此,寻找一种有效方法消除或降解环境中的氰戊菊酯农药残留已成为当前首要解决的问题。
近年来,随着人们对生物修复理论(bioremediation)的不断深入探索,因微生物对环境修复具有高效、廉价、安全、简便等特点,使得微生物逐渐成为处理农药污染、泄漏事故污染以及生化武器等各种污染的最佳选择[5]。目前,已通过富集培养、直接分离等技术,筛选得到了少量具有降解氰戊菊酯能力的微生物,如芽孢杆菌属(Bacillus sp.)[6]、产碱菌属(Alcaligenes sp.)[7]、微球菌属(Micrococcus sp.)[8]、鞘氨醇单胞菌属(Sphingomonas sp.)[9]、无色杆菌属(Achromobacter sp.)[10]、曲霉属(Aspergillus sp.)[11]和假单胞菌属(Pseudomonas sp.)[12]。已报道的氰戊菊酯降解菌大多只具有分解作用,甚至部分会产生具有更大环境危害性的中间降解产物。因此,获得更多的氰戊菊酯降解菌对进行生物修复研究和应用具有重要意义。本实验对筛选得到的一株氰戊菊酯降解菌进行了菌株鉴定和降解条件优化,并在优化条件下对氰戊菊酯的降解过程和重要中间产物3-苯氧基苯甲酸的生成规律进行了初步研究。
1 材料与方法
1.1 材料与仪器
99%氰戊菊酯标准品 国家标准物质中心;96%氰戊菊酯原农药 南京荣诚化工公司;98%3-苯氧基苯甲酸标准品 TCI试剂公司;99.9%乙腈(色谱纯) Adamas公司;99.5%乙酸乙酯、99%无水硫酸钠成都市科龙化工试剂厂。
waters2695高效液相色谱仪、waters2998检测器 上海沃特世科技有限公司;KQ-100DE型数控超声波清洗器 昆山市超声仪器有限公司;XW-80A涡轮混合器 上海金鹏分析仪器有限公司;RE-52A旋转蒸发器 上海亚荣生化仪器厂;冷冻离心机thermo;SKY-2102C空气摇床 上海科学仪器有限公司;Powerpac Basic电泳仪、凝胶成像系统 Bio-RAD。
1.2 实验方法
1.2.1 培养基配制
1.2.1.1 基础盐培养基(MM) (NH4)2SO41.5 g,KH2PO40.5 g,K2HPO41.5 g,MgSO40.2 g,NaCl 0.5 g,蒸馏水1000 mL,pH7.5。
1.2.1.2 Luria-Bertani培养基(LB) 胰蛋白胨10 g,酵母浸出粉5.0 g,NaCl 10 g,蒸馏水1000 mL,pH7.0。为使培养过程中微生物细胞与氰戊菊酯农药充分接触,加入0.2%吐温80(w/v)[13],121℃灭菌20 min。液体培养基中加入2.0%(w/v)的琼脂制成固体培养基。灭菌后加入不同体积氰戊菊酯工作液使其为实验所需的浓度。
1.2.2 菌样采集 土壤样品采集于施用拟除虫菊酯类农药的菜园土壤,采样深度为0~20 cm耕作层土壤,于无菌纸袋中取回实验室,经自然风干磨细,过2 mm筛备用。
1.2.3 氰戊菊酯和降解体系中3-苯氧基苯甲酸的检测
1.2.3.1 氰戊菊酯的提取 取培养液1.0 mL并加入1.0 mL乙腈于具塞试管中,超声波(40 kHz,100 W)辅助提取60 min,乙腈定容至10 mL,混匀后离心(13000 r/min)10 min,上清液用0.45 μm的有机相滤膜过滤,HPLC检测[14]。
1.2.3.2 氰戊菊酯的HPLC检测条件 色谱柱为Inertsil ODS-3(5.0 μm,150 mm×4.60 mm(i.d.)),流动相为乙腈-超纯水(90∶10,v/v),流速为1.0 mL/min,柱温为25℃,检测波长为210 nm,进样量为10 μL。
1.2.3.3 降解体系中3-苯氧基苯甲酸(3-PBA)的提取 取制备的降解体系10 mL,于4℃、10000 r/min冷冻离心10 min;取无菌上清液,用2 mol/L盐酸调整pH 至2,再加入等体积乙酸乙酯,涡旋振荡器充分振摇萃取30 s,室温静置10 min;收集上层有机相,用无水硫酸钠除水后旋转蒸发仪蒸干;用1 mL甲醇复溶,上机检测[15]。
1.2.3.4 3-PBA的HPLC检测条件 色谱柱为Inertsil ODS-3(5.0 μm,150 mm×4.60 mm(i.d.)),流动相为乙腈-超纯水(55∶45,v/v,磷酸调超纯水pH2.5),流速为0.7 mL/min,柱温为30℃,检测波长为210 nm,进样量10 μL[14]。
1.2.3.5 氰戊菊酯和3-PBA标准曲线方程的建立 分别配制浓度为10 μg/mL的氰戊菊酯和3-PBA标准液,依次进样量分别为1、2、5、10、20、50 μL,即氰戊菊酯和3-PBA的质量均为0.01、0.02、0.05、0.1、0.2、0.5 μg。拟合氰戊菊酯质量-峰面积的标准曲线和3-PBA质量-峰面积的标准曲线。
1.2.3.6 降解率的计算 根据所建立的标准曲线方程,计算样品中氰戊菊酯和3-PBA的降解率。
降解率(%)=(1-C/C0)×100
式中,C—样品液中氰戊菊酯或3-PBA质量;C0—空白对照中氰戊菊酯或3-PBA质量。
1.2.4 氰戊菊酯降解菌的筛选
1.2.4.1 降解菌株的富集驯化 取1 g土样分别加入含氰戊菊酯50 mg/L的100 mL的LB培养基和MM培养基于30℃摇床(180 r/min)培养72 h后,取5 mL培养液转接至氰戊菊酯浓度为100 mg/L的LB培养基和MM培养基中,再按上述培养条件继续培养72 h后,按照上述操作连续转接4次,并逐次提高培养基中氰戊菊酯的浓度直至其浓度提高到800 mg/L。
1.2.4.2 降解菌株的筛选和纯化 驯化后,分别将菌悬液(OD600=1.0)进行梯度稀释涂布转接到氰戊菊酯浓度为100 mg/L的LB培养基平板。30℃培养48 h,挑取单菌落于含100 mg/L氰戊菊酯的LB培养基平板连续划线纯化三代,挑选出能耐受高浓度氰戊菊酯且菌落形态规则、生长速度较快的菌株,进行传代、涂布,直至LB培养基平板上的菌落形态完全一致为止,挑取单菌落划线培养后进行编号,并用20%甘油于-70℃冷冻保存。
1.2.4.3 降解菌株对氰戊菊酯降解能力的测定 将分离得到的菌株制成菌悬液(OD600=1.0)按5.0%(v/v)的接种量分别接种于氰戊菊酯浓度为50 mg/L的两种培养基(MM和LB)中,以不接菌接入相同体积的无菌水作为空白培养基,30℃振荡(180 r/min)培养72 h,HPLC测定各菌株对氰戊菊酯的降解率,方法参照1.2.3,选取降解率高的菌株进行后续实验。
1.2.5 氰戊菊酯降解菌的鉴定 生理生化特征参照《伯杰细菌鉴定手册》第8版[16]。提取氰戊菊酯降解菌的DNA并以之为模板,采用常用的细菌通用引物进行16S rDNA系统发育分析[17]。
1.2.6 氰戊菊酯降解菌降解条件优化
1.2.6.1 适宜氮源的选择 将LB培养基中的胰蛋白胨替换成不同种类的氮源(蛋白胨、(NH4)2SO4、NH4NO3以及蛋白胨和(NH4)2SO4组合氮源)[18],添加浓度均为1.0%(w/v)。LB培养基的其他成分不变,酵母浸出粉0.5%(w/v),NaCl 1.0%(w/v),pH7.0。
1.2.6.2 适宜碳源的选择 除氰戊菊酯作为碳源外,将LB培养基中酵母浸出粉调整为0.1%,同时将其中的胰蛋白胨替换为适宜氮源(1.0%)。分别用0.1%可溶性淀粉、0.1%乳糖、0.1%葡萄糖、0.1%乙醇、0.1%甘油替换0.1%酵母浸出粉[18],进行外加碳源筛选。LB培养基的其他成分不变,NaCl 1.0%(w/v),pH7.0。
1.2.6.3 适宜无机盐的选择 根据碳、氮源筛选的实验结果,LB培养基中的胰蛋白胨和酵母浸出粉替换为适宜的氮源(1.0%)和碳源(0.1%),再分别添加不同种类无机盐(CaCl2、CuSO4、MnSO4、ZnCl2、MgSO4、FeCl3)进行适宜无机盐筛选[19],浓度均为0.05%(w/v),同时添加NaCl 1.0%(w/v),调节pH至7.0。
1.2.6.4 降解氰戊菊酯显著影响因素的筛选 采用Plackett-Burman(PB)设计[20],分别以三组平行样的氰戊菊酯降解率的平均值为响应值,进一步考察影响降解菌降解氰戊菊酯的因素,利用Minitab软件处理实验数据,根据其p值大小确定其主效应因素,其他因素的取值则根据PB实验效应值(T)的正负和大小确定,T值为正值取高水平,T值为负值取低水平。

表1 因素水平表Table1 Table of factors and levels
1.2.6.5 降解菌降解氰戊菊酯优化条件的确定 选用PB实验筛选得到的主效应因素,通过最陡爬坡实验[21]快速逼近最佳氰戊菊酯降解区域,筛选最优水平并建立因素水平表(见表1),采用Box-Behnken法,分别以三组平行样的氰戊菊酯降解率(Y)的平均值为响应值,建立有效的响应面模型。分析主效应因素间的交互作用,确定降解菌降解氰戊菊酯的优化条件[21]。
1.2.7 优化条件下氰戊菊酯的降解规律研究 依据
1.2.6 确定的优化条件,将筛选得到的氰戊菊酯降解菌制成菌悬液(OD600=1.0)接种于优化后的降解体系中(含0.2%的吐温80(w/v)),每组制作三个平行,35℃以180 r/min振荡培养48 h,采用HPLC法每隔8 h测定一次氰戊菊酯的降解率及3-PBA的生成量。通过对降解过程中氰戊菊酯的残留量、3-PBA的生成量、菌体生物量OD600的平均值变化,研究菌株对氰戊菊酯降解以及中间产物3-PBA生成的规律。
2 结果与讨论
2.1 氰戊菊酯和3-PBA的标准曲线方程
氰戊菊酯拟合所得标准曲线方程为:y= 7682043.58x-9046.39。式中,y为峰面积,x为氰戊菊酯质量(μg),线性范围0.01~0.5 μg,其决定系数R2>0.9999,表明线性关系良好。
3-PBA拟合所得标准曲线方程为:y=20974702.15x+40732.83。式中,y为峰面积,x为3-PBA质量(μg),线性范围0.01~0.5 μg,其决定系数R2>0.9999,表明线性关系良好。
2.2 降解菌的鉴定
2.2.1 降解菌的形态及生理生化特性 菜园土壤中的微生物经富集驯化,分离纯化得到一株能够降解氰戊菊酯的菌株,命名为BFE-023。菌株BFE-023在氰戊菊酯浓度为50 mg/L的LB和MM培养基中培养72 h降解率分别为70.81%和15.08%。根据《伯杰细菌鉴定手册》第8版[16],对菌株BFE-023进行形态学及生理生化鉴定。菌株BFE-023的形态结果显示,该菌株的菌落扁平、呈白色、表面粗糙褶皱、边缘不整齐,细胞形态和排列呈杆状,其生理生化特征见表2。

表2 菌株BFE-023生理生化特征Table2 Physiological and biochemical characteristics of strain BFE-023
2.2.2 菌株的系统发育树 经PCR扩增的菌株BFE-023的16S rDNA片段长1366 bp,于GenBank数据库中注册得到的登录号为KP877123,经Blast比对发现,该菌株的16S rDNA与地衣芽孢杆菌相似度最高,选取数据库中与其相似性达99%以上的菌株16S rDNA基因序列,运用邻法构建的系统发育树如图1所示,结合形态学和生理生化特征可鉴定该菌株为地衣芽孢杆菌(Bacillus licheniformis)。地衣芽孢杆菌是一种土壤常见菌,也是肠道益生菌,近年来国内对地衣芽孢杆菌降解拟除虫菊酯类农药的报道较多集中在其对氯氰菊酯的降解,如赖文等[22]分离得到地衣芽孢杆菌B-1可降解氯氰菊酯,并研究其培养基组分、培养优化条件及氯氰菊酯降解酶的分离纯化;于晓菲等[23]研究了芽孢杆菌属对高效氯氰菊酯的降解及碳源、氮源、温度、pH和底物浓度对菌种降解高效氯氰菊酯能力的影响;刘芳芳等[24]分离得到了β-氯氰菊酯降解菌地衣芽孢杆菌B-1,并研究了表面活性剂对菌株降解β-氯氰菊酯的影响。目前,地衣芽孢杆菌对氰戊菊酯的降解还鲜有报道,因此,研究地衣芽孢杆菌BFE-023对氰戊菊酯的降解率具有重要意义。

图1 菌株BFE-023系统发育树Fig.1 Phylogenetic tree of strain BFE-023
2.3 地衣芽孢杆菌BFE-023降解氰戊菊酯的优化条件
2.3.1 最适氮源 将初始培养基中的胰蛋白胨替换成等量不同种类的其他氮源,地衣芽孢杆菌BFE-023降解氰戊菊酯的结果如图2所示。可以看出,有机氮源(胰蛋白胨、蛋白胨)降解氰戊菊酯的效果比无机氮源((NH4)2SO4、NH4NO3)和复合氮源(蛋白胨+(NH4)2SO4)效果好;说明充足的有机氮源有利于地衣芽孢杆菌BFE-023降解氰戊菊酯,且有机氮源胰蛋白胨比蛋白胨对氰戊菊酯的降解率提高了3.66%。因此,选择胰蛋白胨为地衣芽孢杆菌BFE-023降解氰戊菊酯的最适氮源。

图2 不同氮源对地衣芽孢杆菌BFE-023降解氰戊菊酯的影响Fig.2 Effect of different nitrogen sources on fenvalerate degradation by Bacillus licheniformis BFE-023
2.3.2 最适碳源 不同碳源对地衣芽孢杆菌BFE-023降解氰戊菊酯的结果如图3所示。由图3可知,酵母浸出粉对地衣芽孢杆菌BFE-023降解氰戊菊酯的效果最好,这是由于酵母浸出粉是一种多功能营养素,在培养基中不仅可以作为菌株生长的主要碳源,也能为菌株生长提供氮源和生长因子。胡尚勤等[25]研究发现适宜的碳源和氮源,维生素、矿质元素有利于地衣芽孢杆菌的生长。在降解过程中,微生物的数量多少决定了该农药降解的速度和程度[26]。本实验中,酵母浸出粉增强了对微生物的刺激作用,提高了农药的降解率,因此,选择酵母浸出粉为地衣芽孢杆菌BFE-023降解氰戊菊酯的最适碳源。
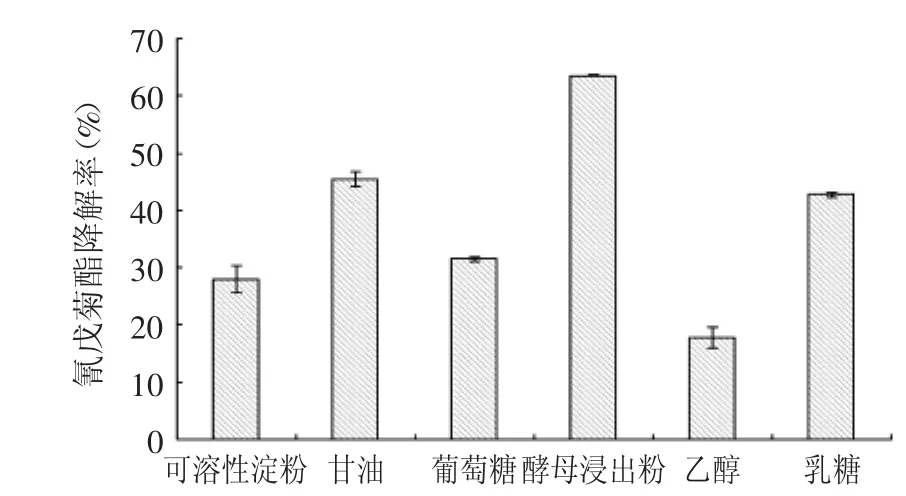
图3 不同碳源对地衣芽孢杆菌BFE-023降解氰戊菊酯的影响Fig.3 Effect of different carbon resources on fenvalerate degradation by Bacillus licheniformis BFE-023
2.3.3 最适无机盐 将初始LB培养基中的氮源和碳源替换成最适氮源和碳源(1.0%胰蛋白胨、0.5%酵母浸出粉,(w/v)后),分别添加0.05%(w/v)不同种类无机盐,结果如图4所示。由图4可知,Zn2+、Mn2+、Mg2+、Cu2+、Ca2+对菌株BFE-023降解氰戊菊酯的能力较低,而Fe3+对氰戊菊酯的降解率最高,可能是因为Fe3+与有机质螯合后,毒性会有所降低,或者Fe3+能作为某些降解酶的激活剂,而且其在菌体细胞呼吸中有着重要作用。因此,氯化铁是地衣芽孢杆菌BFE-023降解氰戊菊酯适宜的无机盐。
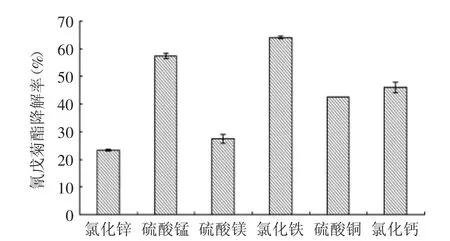
图4 不同无机盐对地衣芽孢杆菌BFE-023降解氰戊菊酯的影响Fig.4 Effect of different inorganic salts on fenvalerate degradation by Bacillus licheniformis BFE-023
2.3.4 地衣芽孢杆菌BFE-023降解氰戊菊酯的主要影响因素 根据单因素实验结果,采用Plackett-Burman(PB)实验设计,快速筛选可能影响地衣芽孢杆菌BFE-023降解氰戊菊酯的多个因素。PB实验设计及其影响氰戊菊酯降解率的不同因素和水平的效应分析如表3所示。由p值可以看出,氰戊菊酯浓度、氯化铁含量、培养时间是9个因素中影响氰戊菊酯降解效果的比较显著的因素,是主效应因素。可以认为,降解体系中浓度过高的氰戊菊酯会抑制菌株生长和酶促反应初速度,而浓度过低会造成对降解酶的诱导不充分;少量的氯化铁能促进菌株的生长和某些降解酶的活性,过量的氯化铁则会对菌株产生毒害作用,抑制酶促反应速度;培养时间的长短和降解反应直接相关。其他因素的取值则根据T值的正负和大小确定为:降解体系中胰蛋白胨含量1.25%(w/v)、酵母浸出粉含量0.125%(w/v)、接种量6.25%、培养温度35℃、菌龄24 h、初始pH7.5。

表3 PB实验设计及其因素水平效应分析Table3 Experiment design and analyses of Plackett-Burman
2.3.5 地衣芽孢杆菌BFE-023降解氰戊菊酯的响应面中心点 依据影响氰戊菊酯降解效果的主要因素的正负效应值设计的最陡爬坡实验及其结果见表4。由此可知,第3组实验的氰戊菊酯降解率为77.70%,降解率最高,因此响应面分析的中心点确定为第3组的水平。

表4 最陡爬坡实验设计及其结果Table4 Experiment design and results of steepest ascent test
2.3.6 地衣芽孢杆菌BFE-023降解氰戊菊酯的响应面优化结果 根据上述实验结果,得到该菌株的因素水平表及降解条件的优化实验设计及响应值(见表5)。通过对表5中的实验数据进行多项式回归分析建立二次响应回归模型,拟合得到氰戊菊酯降解率(Y)响应曲面模型:
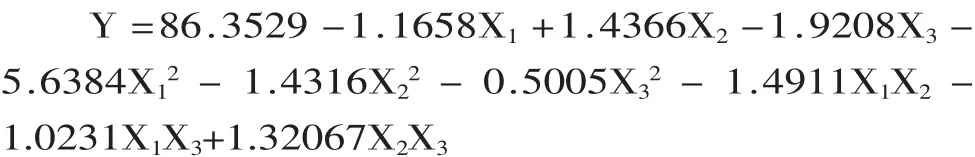
方差分析的显著性检验结果(见表6)表明,方程的F值(15.09)大于F0.01(9,5),说明方程在F0.01水平上显著;失拟项p值(0.075)大于0.05,说明失拟项不显著。
为求得最大降解率,分别对模型的各自变量求一阶偏导,令其为0,得出其极值点:X1=39.95,X2=60.19,X3=0.055%,即当氰戊菊酯浓度为39.95 mg/L、培养时间为60.19 h、氯化铁含量为0.055%(w/v)时,氰戊菊酯降解率的预测值为88.78%,为方便实际操作,将优化条件校正为氰戊菊酯浓度为40 mg/L、培养时间为60 h、氯化铁含量为0.055%(w/v)进行验证实验,实验结果为88.71%,与预测值基本一致,说明特定条件下氰戊菊酯的降解率能够准确的被所建立的响应面模型预测。

表5 Box-Behnken实验结果Table5 Results of Box-Behnken Experiment

表6 Box-Behnken实验结果的方差分析Table6 Variance analysis of the results from Box-Behnken test
2.4 地衣芽孢杆菌BFE-023降解氰戊菊酯的规律
地衣芽孢杆菌BFE-023降解氰戊菊酯的规律如图5所示,在0~8 h时,降解体系中地衣芽孢杆菌BFE-023生物量迅速增加,而氰戊菊酯农药降解缓慢,降解率仅为3.68%,是由于此阶段降解体系中充足的碳源和氮源最大限度的促进了菌株的生长,氰戊菊酯对菌株BFE-023的诱导作用尚未体现,因此降解率较小[27]。在8~32 h培养时间段,随着培养时间的延长,地衣芽孢杆菌BFE-023生物量趋于最大值,降解体系中容易被利用的外加碳、氮源逐渐被消耗,氰戊菊酯在降解体系中对菌株BFE-023的影响逐渐增大,地衣芽孢杆菌BFE-023在此环境中逐步受母体农药氰戊菊酯的诱导产生了降解酶,氰戊菊酯开始迅速降解,此时降解速率达到最大。在32~48 h培养过程中,氰戊菊酯农药降解速率减缓,一方面可能是此阶段地衣芽孢杆菌BFE-023的生长逐步进入衰亡期,另一方面可能是降解体系中氰戊菊酯的浓度逐渐减少,地衣芽孢杆菌BFE-023受环境诱导产降解酶的速率降低,同时氰戊菊酯降解生成的部分降解中间产物可能抑制了菌株BFE-023对母体农药氰戊菊酯的降解能力,从而使降解率减小[27]。
3-苯氧基苯甲酸(3-PBA)是氰戊菊酯农药降解过程中的重要中间产物,其在培养过程中的生成量如图5所示,在培养初期,由于氰戊菊酯降解率低,因此3-PBA的生成量比较低,为0.081 μg/mL。在8~32 h培养时间段,随着氰戊菊酯农药的快速降解,3-PBA也大量生成,并于28 h达到最大累积量为2.455 μg/mL;但培养到30 h后,3-PBA的含量出现缓慢下降趋势,可能是降解体系中地衣芽孢杆菌BFE-023受一定浓度3-PBA的诱导产生3-PBA降解酶,使3-PBA进一步降解成小分子物质,说明菌株BEF-023可能具备继续降解中间产物3-PBA的能力。

图5 氰戊菊酯的残留量、3-苯氧基苯甲酸的累积量及菌体生物量OD600的变化规律Fig.5 Residues fenvalerate,the cumulative amount of 3-PBA and variation of bacterial biomass OD600
3 结论
从喷施拟除虫菊酯农药的菜园土壤中分离得到的一株能降解氰戊菊酯的菌株BFE-023,经生理生化和16S rDNA序列分析鉴定为地衣芽孢杆菌(Bacillus licheniformis)。菌株BFE-023降解氰戊菊酯农药的效果受多种因素的影响,其中培养时间、降解体系中的氰戊菊酯浓度及氯化铁含量是其主要影响因素。依据所建立的响应面模型确定该菌株降解氰戊菊酯的优化条件经校正为:培养基中氰戊菊酯浓度40 mg/L、培养时间为60 h、氯化铁含量为0.055%(w/v)、胰蛋白胨含量1.25%(w/v)、酵母浸出粉含量0.125%(w/v)、接种量6.25%(w/v)、培养温度35℃、菌龄24 h、初始pH7.5。在此优化条件下,氰戊菊酯的平均降解率为88.71%,与预测值基本一致。
在优化条件下,对降解体系中氰戊菊酯的降解情况和中间产物3-苯氧基苯甲酸(3-PBA)的生成及菌体生物量OD600的变化规律进行研究,结果表明,地衣芽孢杆菌BFE-023不仅在培养过程中产生了降解氰戊菊酯的关键酶,使氰戊菊酯快速降解,还可能具有对中间产物3-PBA一定的降解能力。由于地衣芽孢杆菌BFE-023对氰戊菊酯的降解与菌株分泌的降解酶有关,因此其降解途径和机理有待于进一步研究探讨。研究结论不仅丰富了氰戊菊酯降解菌资源库,还对进一步研究氰戊菊酯的降解途径及机理奠定了基础。
[1]GIRI S,SHARMA G D,GIRI A,et al.Fenvalerate-induced chromosome aberrations and sister chromatid exchanges in the bone marrow cells of mice in vivo[J].Mutat Res,2002,520(1-2):125-132.
[2]TRIPATHI G,VERMA P.Fenvalerate-induced changes in a catfish.clarias batrachus:Metabolic enzymes,RNA and protein [J].C-omp Biochem Physiol,C:Pharmacol Toxicol,2004,138 (1):75-79.
[3]Al-Makkawy H K,Madbouly MD.Persistence and accumulation of some organic insecticides in Nile water and fish resources[J].Conservation and Recycling,1999,27(1-2):105-115.
[4]Kolaczinski J H,Curtis C F.Chronic illness as a result of low-level exposure to synthetic pyrethroid insecticides:A review of the debate[J].Food and Chemical Toxicology,2004,42(5):697-706.
[5]Singh B K,Walker A.Microbial degradation of organophorus compounds[J].FEMS Microbiology Reviews,2006,30(3):428-471.
[6]Maloney S E,Maule A,Smith A R.Purification and preliminary characterization of permethrinase from a pyrethroid-transforming strain of Bacillus cereus[J].Applied and Environmental Microbiology,1993,59(7):2007-2013.
[7]虞云龙,陈鹤鑫,樊德方,等.拟除虫菊酯类杀虫剂的酶促降解[J].环境科学,1998,19(3):66-69.
[8]Tallur P N,Megadi V B,Ninnekar H Z.Biodegradation of cypermethrin by Micrococcus sp.strain CPN1[J].Biodegradation,2008,19(1):77-82.
[9]Guo P,Wang B Z,Hang B J,et al.Pyrethroid degrading Sphingobium sp.JZ-2 and the purication and characterization of a novel pyrethroid hydrolase[J].International Biodeterioration&Biodegradation,2009,63(8):1107-1107.
[10]虞云龙,宋风鸣,郑重,等.一株广谱农药降解菌(Alcaligenes sp)分离与鉴定[J].浙江农业大学学报,1997,23 (2):111-115.
[11]Liang W Q,Wang Z Y,Li H,et al.Purification and characterization of a novel pyrethroid hydrolase from Aspergillus niger ZD11[J].Journal of Agricultural and Food Chemistry,2005,53(19):7415-7420.
[12]田盼.氰戊菊酯降解菌的筛选及其降解酶的初步纯化[D].福州:福建农林大学,2009.
[13]刘书亮,姚开,贾冬英,等.HPLC法检测米曲霉降解体系中氯氰菊酯前处理方法的研究[J].四川大学学报,2011,43(4):179-183.
[14]Jie Tang,Kai Yao,Shuliang Liu,et al.Biodegradation of 3-phenoxybenzoic acid by a novel sphingomonas sp.SC-1[J].Fresenius Environmental Bulletin,2013,22(5a):1564-1572.
[15]Chen S,Luo J,Hu M,et al.Enhancement of cypermethrindegradation by a coculture of Bacillus cereus ZH-3 and Streptomyces aureus HP-S-01[J].Bioresource Technology,2012,110(2):97-104.
[16]布坎南R E,吉本斯N E.伯杰细菌鉴定手册[M].第8版.中国科学院微生物研究所《伯杰细菌鉴定手册》翻译组,译.北京:科学出版社,1984:729-732.
[17]刘君寒,王兆守,何健,等.一株氯氰菊酯降解菌的分离和鉴定[J].南京农业大学学报,2007,30(3):68-72.
[18]顾宝群.氯氰菊醋降解菌的筛选及降解特性研究[D].南宁:广西大学,2006.
[19]张丽萍,徐莲,吴莹,等.氯氰菊酯降解菌的筛选鉴定及其降解特性研究[J].生态与农村环境学报,2009,25(3):67-72.
[20]Reddy L,Wee Y J,Yun J S,et al.Optimization of alkaline protease production by batch culture of Bacillus sp.RKY3 through Plackett-Burman and response surface methodological approaches[J].Bioresource Technology,2008,99(7):2242-2249.
[21]阎金勇,杨江科,闫云君.单因子-响应面法优化白地霉Y162产脂肪酶条件[J].中国生物工程杂志,2007,27(8):69-75.
[22]赖文.氯氰菊酯降解菌的筛选、降解条件优化及其酶纯化研究[D].雅安:四川农业大学,2011.
[23]于晓菲,夏清风,金朝霞.高效氯氰菊酯降解菌的筛选及其降解特性[J].大连工业大学学报,2013,32(6):417-421.
[24]刘芳芳,迟原龙,喻志强,等.表面活性剂对地衣芽孢杆菌B-1降解β-氯氰菊酯的影响[J].食品科技,2015,40(1):10-13.
[25]胡尚勤,刘天贵.地衣芽孢杆菌营养要求的研究[J].河北省科学院学报,2000,17(4):224-227.
[26]方晓航,仇荣亮.农药在土壤环境中的行为研究[J].土壤与环境,2002,11(1):94-97.
[27]秦坤,朱鲁生,王金花.氯氰菊酯降解真菌的筛选及其降解特性研究[J].环境工程学报,2010,4(4):950-954.
Isolation and characterization of fenvalerate degrading strain and optimization of degradation conditions
SHI Ying1,TANG Jie1,*,YAO Kai2,ZENG Chao-yi1,JIANG Zhen-ju1
(1.School of Food and Biotechnology,Xihua University,Chengdu 610039,China;2.College of Light Industry and Food,Sichuan University,Chengdu 610065,China)
Bacterial strain BFE-023 with high ability to degrade fenvalerate was isolated from garden soil which contaminated by pyrethroid pesticides.According to physiological and biochemical characteristics and 16S rDNA sequence,the bacterial strain was identified as Bacillus licheniformis.The main factors influencing fenvalerate degradation were confirmed by using Plackett-Burman design,and the degradation condition was optimized with response surface method.Under the optimal conditions,the degradation of fenvalerate and the generation of 3-phenoxy benzoic acid(3-PBA)were researched.The results showed that fenvalerate concentration,incubation time and ferric chloride content were the major factors which influencing fenvalerate degradation.In addition,the degradation rate of fenvalerate under the optimized conditions in 60 h reached 88.71%,which was similar to predictive value from response surface model(88.78%).The concentration of 3-PBA in the degradation system of fenvalerate was increased obviously at first and then decreased gradually.It was proved that the strain BFE-023 could degrade the intermediate 3-PBA.
fenvalerate;biodegradation;Bacillus licheniformis;optimization of degradation conditions
TS201.3
A
1002-0306(2016)02-0217-07
10.13386/j.issn1002-0306.2016.02.036
2015-05-22
史颖(1989-),女,硕士研究生,研究方向:食品安全,E-mail:1215481052@qq.com。
*通讯作者:唐洁(1982-),女,副教授,研究方向:食品安全,E-mail:tangjie1225@mail.xhu.edu.cn。
国家自然科学基金项目(31371775);四川省教育厅自然科学项目(114ZB0122);西华大学人才培养重点项目(z1310525);四川省食品生物技术重点实验室开放基金(szjj2014-011);西华大学研究生创新项目基金(ycjj2015023)。

