黑土微生物量和酶活性对邻苯二甲酸二丁酯污染的响应
王志刚,赵晓松,徐伟慧,苏云鹏,由义敏,刘帅,胡影,胡云龙,张颖
1. 齐齐哈尔大学生命科学与农林学院,齐齐哈尔 161006 2. 东北农业大学资源与环境学院,哈尔滨 150030
黑土微生物量和酶活性对邻苯二甲酸二丁酯污染的响应
王志刚1,赵晓松1,徐伟慧1,苏云鹏1,由义敏1,刘帅1,胡影1,胡云龙1,张颖2,*
1. 齐齐哈尔大学生命科学与农林学院,齐齐哈尔 161006 2. 东北农业大学资源与环境学院,哈尔滨 150030
邻苯二甲酸二丁酯(di-n-butyl phthalate, DBP)是一种在环境中广泛存在的有毒有机化合物,已被我国列为优先控制污染物之一。本研究探讨了不同浓度的DBP污染对黑土呼吸、微生物量以及黑土酶活性的影响。结果表明,DBP污染处理的黑土呼吸速率和微生物量碳较对照均显著增加;微生物氮在DBP污染过程中呈“降低-升高-降低”波动性变化;微生物磷与DBP污染浓度呈显著负相关;DBP对黑土多酚氧化酶表现为先促进后抑制,对转化酶和蛋白酶活性表现为低浓度促进而高浓度抑制;在DBP污染过程中脲酶呈现被激活状态;黑土过氧化氢酶和酸性磷酸酶均受到DBP污染的显著抑制。通过相关性分析发现,土壤微生物量、土壤酶活性与DBP污染浓度之间存在着高度的相关性。由此可推断,DBP污染改变了黑土呼吸、微生物量和酶学活性的代谢特征,进而有可能影响了黑土的生态系统功能,威胁到黑土的可持续利用。
邻苯二甲酸二丁酯(DBP);土壤呼吸;微生物量;土壤酶;黑土;污染
邻苯二甲酸酯(phthalate esters, PAEs)是一类人工合成的有机化合物[1],主要用于塑料产品的成型剂。目前,PAEs已经成为全球最为普遍的工业化合有机污染物之一,其中邻苯二甲酸二丁酯(di-n-butyl phthalate, DBP)在土壤、地表水、沉积物、淡水生物、植物和蔬菜中被广泛检出[2],也因其具有潜在的环境危害[3-4],中国环境检测中心和美国环境保护局已经将DBP列为优先控制污染物[5]。
东北黑土是世界上仅有的三大黑土区之一,在保障我国粮食安全方面具有不可替代的作用[6]。DBP可以通过塑料薄膜、灌溉和农药等方式进入土壤环境[7],在东北黑土中DBP含量在2.8~14.6 mg·kg-1[8],远远超过美国环境保护局制定的0.08 mg·kg-1土壤净化标准[9],但是其在黑土中的行为特征及其规律尚不明确,因此,研究DBP污染对黑土微生物生物量和酶活性的影响,对于阐释DBP的环境行为和黑土资源保护具有重要意义。
1 材料与方法 (Materials and methods)
1.1试验地点与实验土壤制备
本试验始于2014年9月30日,在东北农业大学园艺站(哈尔滨市)的温室中进行。供试土壤取自哈尔滨香坊农场(45°41′N, 126°45′E)的大豆田,为表层土壤(0~20 cm),在土壤中未检测到DBP残留。土壤被充分混均后,过2 mm筛,去除植物残体和石块。土壤基本性质如表1所示。
1.2实验设计
DBP(纯度>99.9%)购于中国标准物质标准样品信息中心,助溶剂为丙酮,制备成1 000 mg·L-1的DBP储备液,于4 ℃冰箱内避光保存备用。
每个样品称取650 g土壤置于1 L(12.2 cm × 12 cm)花盆中,调整实验土壤湿度到田间最大持水量的80%,在25 ℃的黑暗培养箱中预培养7 d后,用DBP储备液调整土壤DBP浓度,共计5个处理,分别为对照(CK),0 mg·kg-1;DBP1处理,5 mg·kg-1;DBP2处理,10 mg·kg-1;DBP3处理,20 mg·kg-1;DBP4处理,40 mg·kg-1。对照处理(CK)添加等量丙酮进行处理。每个处理5次重复,置于培养箱内培养。在实验期间,用恒重法保持土壤含水量30%,温度为(25±2) ℃,培养箱内相对湿度为70%±5%。于不同时间取样测定土壤中的微生物学各项指标。
1.3土壤微生物呼吸速率与生物量的测定
土壤微生物呼吸速率采用碱液吸收滴定法测定,用每小时呼出的CO2量表示(mg (CO2)·kg-1·h-1)[10]。土壤微生物量碳采用氯仿熏蒸0.5 mol·L-1K2SO4溶液浸提,重铬酸钾氧化法测定;微生物量氮采用氯仿熏蒸0.5 mol·L-1K2SO4溶液浸提,茚三酮比色法测定;微生物量磷采用氯仿熏蒸NaHCO3提取,钼锑抗比色法测定[11-12]。

表1 试验黑土的基本性质
注:USDA代表美国农业部。
Note: USDA stands for U.S. Department of Agriculture; TOC stands for total organic carbon; CEC stands for cation exchange capacity; TN stands for total nitrogen; TP stands for total phosphorus.
1.4土壤酶活性的测定
脲酶活性测定用苯酚-次氯酸钠比色法,以37 ℃、24 h后,1 g土壤生成的NH3-N质量(μg)表征,表示为μg·g-1·h-1(以NH3-N计);土壤过氧化氢酶活性的测定采用KMnO4滴定法,结果以20 min后1 g土壤消耗0.05 mol·L-1KMnO4的毫升数来表示;多酚氧化酶采用邻苯三酚比色法;土壤转化酶采用3,5-二硝基水杨酸比色法测定;蛋白酶活性测定用酪蛋白酸钠分析方法,以50 ℃、2 h后,5 g土壤生成的酪氨酸质量(μg)表征,表示为μg·g-1·h-1(以酪氨酸计);酸性磷酸酶活性以24小时每克土壤中释放出酚的毫克数表征[13-14]。为了消除土壤和试剂的误差,每一土样均设无基质和无土壤对照,3次重复。
1.5数据统计分析方法
数据用SPSS 17.0软件进行统计分析,采用Sigma Plot 12.5作图。
2 结果与分析(Results and analysis)
2.1黑土微生物呼吸速率对DBP污染的响应
土壤呼吸是衡量土壤微生物活性或评价土壤肥力的重要指标,通过图1可知,DBP污染处理10 d内,4个污染浓度处理的黑土呼吸速率均显著(P<0.05)高于对照(CK),在处理7 d后增幅逐渐减少,且在10 d内各浓度处理间的呼吸速率呈现显著差异。
2.2黑土微生物量对DBP污染的响应
黑土微生物碳、氮和磷在DBP污染过程中呈现了不同的变化规律(图2)。微生物碳在DBP污染5 d后,与对照相比,表现为低浓度(5和10 mg·kg-1)促进,高浓度(20和40 mg·kg-1)抑制;10 d后各个浓度处理均表现为促进效应,但是低浓度DBP处理强于高浓度的促进效应,20 d后促进效应逐渐减弱(图2a)。微生物氮在DBP污染过程中呈“降低-升高-降低”波动性变化(图2b),在5 d时,微生物氮与DBP污染浓度呈显著负相关(r2=0.75**),处理10 d后各处理均呈现相似的波动变化,但是并未发现与DBP污染浓度之间的相关性。微生物磷受到DBP污染的抑制(图2c),且微生物磷与DBP污染浓度呈显著负相关(r2=0.63**),在15 d后这种抑制效应有逐渐恢复的趋势。
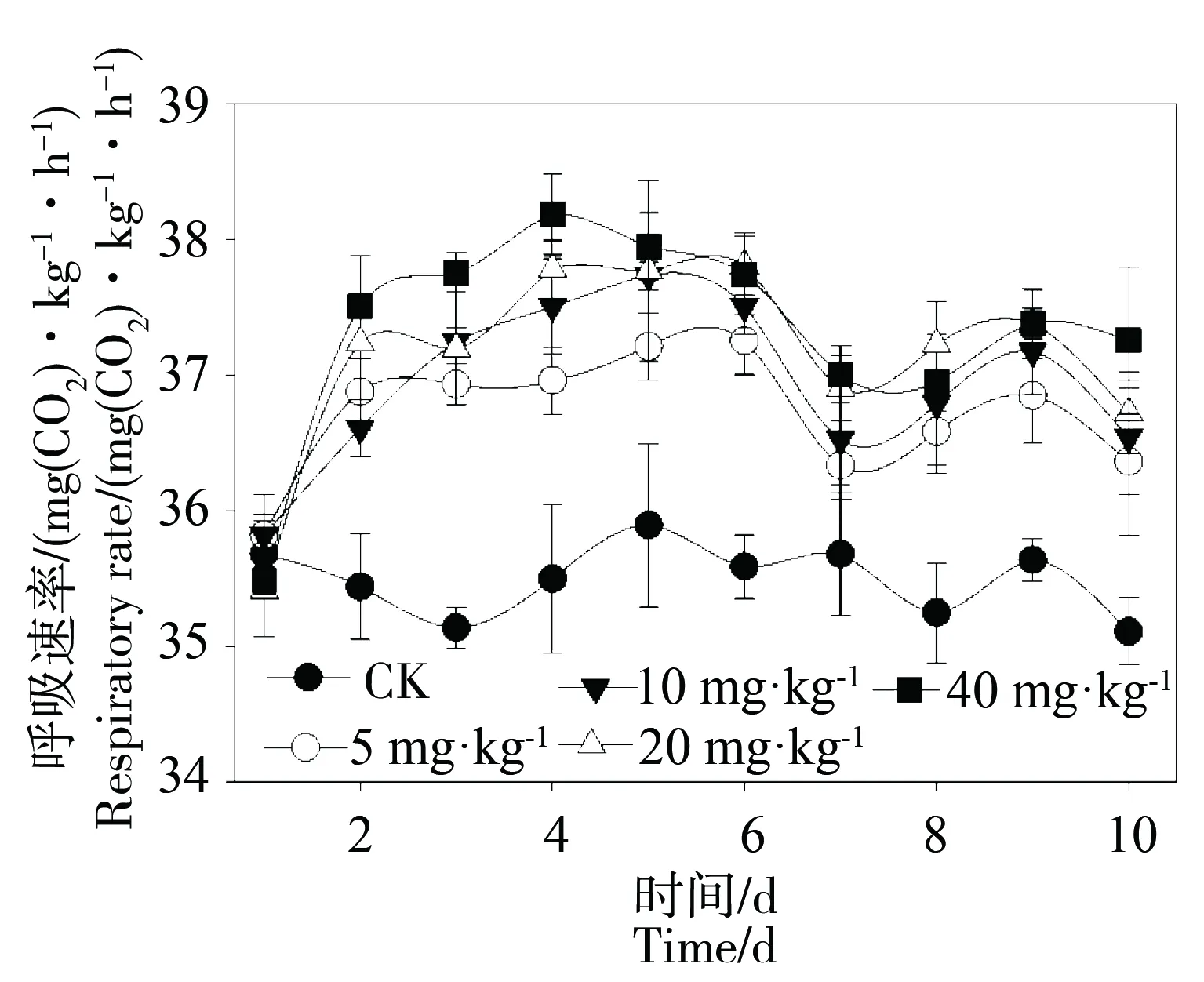
图1 黑土微生物呼吸速率对邻苯二甲酸二丁酯(DBP)污染的响应Fig. 1 Response of black soil respiratory rate to di-n-butyl phthalate (DBP) contamination

图2 黑土微生物量对DBP污染的响应Fig. 2 Response of microbial biomass in black soil to DBP contamination
2.3黑土酶活性对DBP污染的响应
黑土酶活性在DBP污染过程中的动态变化结果见图3。在处理5 d时,DBP对黑土多酚氧化酶有促进作用,且低浓度(5和10 mg·kg-1)处理的促进效应显著强于高浓度(20和40 mg·kg-1)处理,10 d后呈现为抑制效应,且有随着污染浓度提升而增强的趋势(图3a)。转化酶活性在低浓度DBP(5和10 mg·kg-1)条件下表现为促进效应,而高浓度DBP(20和40 mg·kg-1)条件下表现为先抑制后促进(图3b)。在DBP污染过程中脲酶呈现激活效应,随着培养时间的增加激活效应逐渐增强,但在15 d后激活效应有减弱的趋势,且激活效应与DBP浓度正相关(r2=0.78)(图3c);黑土过氧化氢酶和酸性磷酸酶均受到DBP污染的显著抑制(P<0.05),且抑制程度与DBP处理浓度均呈显著相关(r2=0.85和r2=0.79)(图3d, e)。在处理25 d内,低浓度DBP(5、10和20 mg·kg-1)处理对黑土蛋白酶有促进作用,且差异极其显著(P<0.01),而高浓度DBP(40 mg·kg-1)处理中,黑土蛋白酶活性显著高于对照(P<0.01)(图3f)。
2.4土壤微生物量与酶活性的相关性分析
将黑土培养25 d时的生物量(碳、氮、磷)、土壤酶活性和DBP起始浓度进行Pearson双尾相关性分析,结果如表2所示。微生物碳含量与蛋白酶活性呈显著负相关,与转化酶活性呈显著正相关;微生物氮与酸性磷酸酶活性呈显著正相关;过氧化氢酶与微生物磷和酸性磷酸酶活性呈显著正相关,与脲酶和蛋白酶活性呈显著负相关;DBP污染浓度与脲酶活性呈显著正相关,与酸性磷酸酶和过氧化氢酶呈显著负相关。因此,土壤微生物量、土壤酶活性与DBP污染浓度之间存在相关性,有着紧密联系。
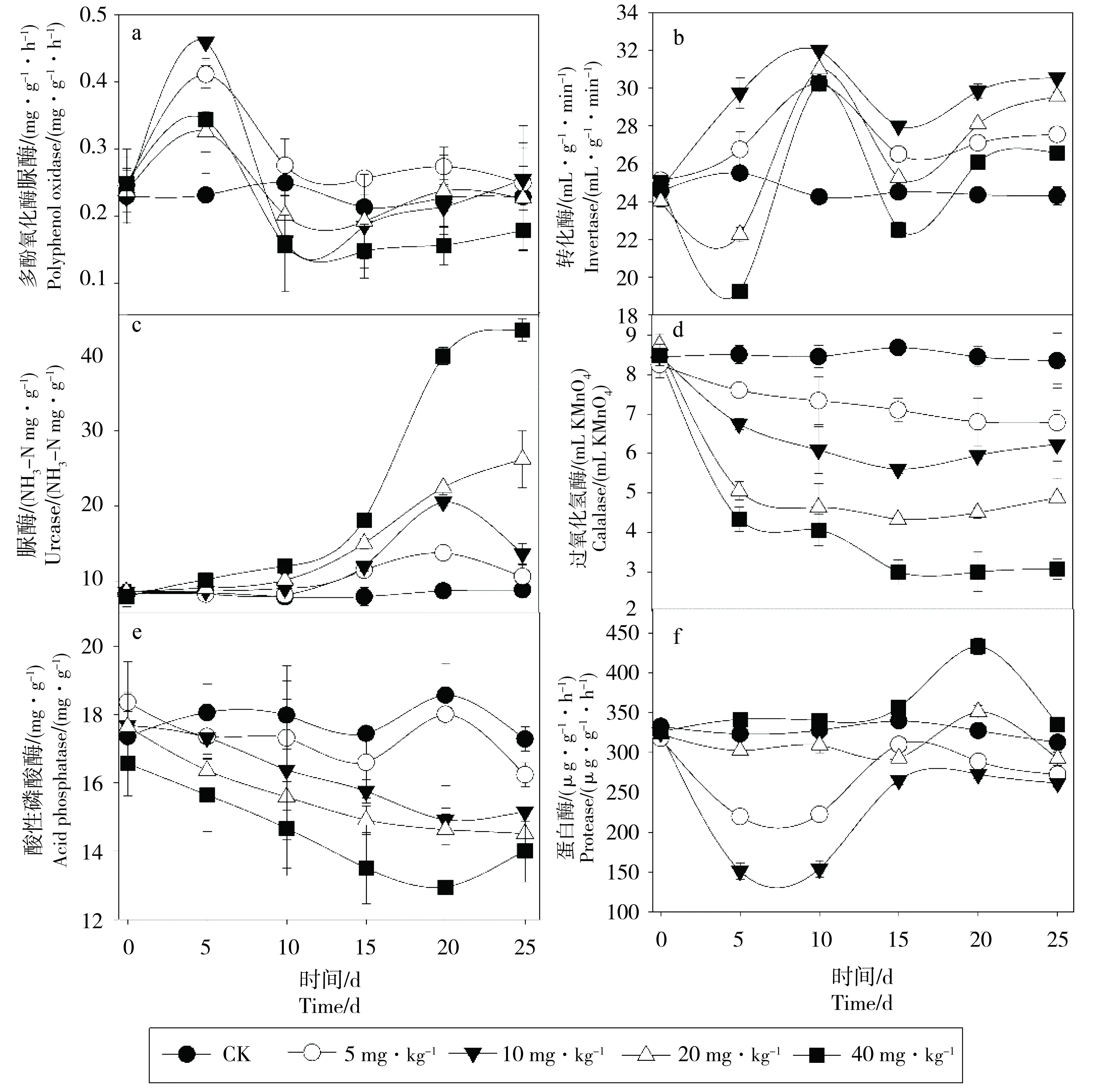
图3 黑土酶活性对DBP污染的响应Fig. 3 Effects of DBP contamination on enzyme activities in black soil
3 讨论(Discussion)
微生物在土壤生态系统中参与一切有机物质的分解和转化,且对土壤生态环境的变化极为敏感,可以反映土壤质量的变化和人类活动的干扰[15]。土壤呼吸速率可作为土壤生物活性和土壤肥力乃至透气性的指标,并且指示着土壤生态系统演替的过程与方向[16]。
本研究结果表明,DBP污染导致土壤基础呼吸被激活,且激活作用随培养时间的延长而减弱,这一结果与郭杨等(2010)[17]在水稻土中和高军等(2008)[18]在黄棕壤中的研究结果相一致。原因可能是PAEs可作为某些土壤微生物的碳源和能源,利用这些底物时表现出较高的代谢活性,土壤呼吸速率升高;但随着培养时间的延长其生物有效性降低,土壤呼吸下降。邻苯二甲酸二甲酯(DMP)对黑土呼吸具有低浓度促进高浓度抑制的效应[16],与DBP对黑土呼吸的影响不一致,可能是因为分子量(DMP和DBP分子量分别为194.19和278.34)和水分配系数(DMP和DBP的lgKow分别为1.60和3.74)不同所引起的[19]。土壤微生物量是土壤有机质和土壤养分转化与循环的动力,可作为土壤中有效养分的储备库[20]。本研究结果表明,DBP污染显著增加黑土微生物碳含量,这一现象与王鑫宏[21]在吉林软土上的研究结果相似,也与微生物呼吸速率增加的结果相互印证;微生物氮呈现波动降低的现象以及微生物磷受到DBP污染的显著抑制,说明DBP污染导致了黑土养分库的改变,这可能是酞酸酯污染导致了黑土微生物的功能代谢菌群的改变所致[22]。污染物进入到土壤中会引起土壤中各微生物种群活细胞数量及组成结构的变化,导致土壤中的微生物在生理代谢方面做出响应[23],最终影响到土壤酶活性。本研究发现,在DBP污染过程中,脲酶、蛋白酶、转化酶、酸性磷酸酶、过氧化氢酶和多酚氧化酶的活力均不同程度的受到了影响,与张建等 (2010)[24]和Gao等(2010)[25]在其他类型土壤上的研究结果不尽一致,这可能与土壤类型的不同有关系。过氧化氢酶、多酚氧化酶和转换酶活性可以反映出土壤有机碳素的转化速率,蛋白酶和脲酶可以反映土壤中有效氮素的代谢水平,磷酸酶可以反应土壤磷素代谢转化速率[26-27]。通过相关性分析发现,土壤微生物量、土壤酶活性和DBP污染浓度三者之间存在相关性,且脲酶、酸性磷酸酶和过氧化氢酶与DBP污染相关性更强,这一结果与Eivazi等[28]和Frankenberger等[29]的研究结果相一致。因此,我们可以推断DBP污染影响了黑土中碳氮磷元素的转化循环,从而有可能影响黑土生态系统功能。

表2 DBP污染过程中土壤微生物量与土壤酶活性的相关性分析
注:*在0.05水平(双侧)上显著相关,**在0.01水平(双侧)上显著相关。
Note:*P<0.05, ** P<0.01.
本研究发现黑土微生物呼吸速率受DBP污染的促进;DBP污染显著增加黑土微生物碳含量,微生物氮呈现波动降低,微生物磷受到显著抑制;DBP对黑土多酚氧化酶表现为先促进后抑制;DBP对过氧化氢酶和蛋白酶活性表现为低浓度促进而高浓度抑制;在DBP污染过程中脲酶呈现激活效应;黑土转化酶和酸性磷酸酶均受到DBP污染的显著抑制。且土壤微生物量、土壤酶活性与DBP污染浓度之间存在相关性,有着紧密联系。因此,DBP污染改变了黑土呼吸、微生物量和酶学活性的代谢特征,进而有可能影响了黑土的生态系统功能,威胁到黑土的可持续利用。
致谢:Kui Chen教授在论文写作过程中给予了指导与帮助,在此谨表谢忱!
通讯作者简介:张颖(1972—),女,环境科学与工程博士,教授,博士生导师,主要研究方向农业环境保护,发表学术论文近200篇。
[1]Boonnorat J, Chiemchaisri C, Chiemchaisri W, et al. Removals of phenolic compounds and phthalic acid esters in landfill leachate by microbial sludge of two-stage membrane bioreactor [J]. Journal of Hazardous Materials, 2014, 277(4): 93-101
[2]Yang C F, Wang C C, Chen C H. Di-n-butyl phthalate removal by strain Deinococcus sp. R5 in batch reactors [J]. International Biodeterioration & Biodegradation, 2014, 95(8): 55-60
[3]Chen X, An H, Ao L, et al. The combined toxicity of dibutyl phthalate and benzo (a) pyrene on the reproductive system of male Sprague Dawley rats in vivo[J]. Journal of Hazardous Materials, 2011, 186(1): 835-841
[4]王志刚, 胡影, 崔竞文. 邻苯二甲酸二甲酯对典型细菌生长和氧化应激酶系的影响[J]. 生态毒理学报, 2015, 10(3): 297-303
Wang Z G, Hu Y, Cui J W. Impact of dimethyl phthalate on the activities of oxidative stress enzymes and growth of typical bacteria [J]. Asian Journal of Ecotoxicology, 2015, 10(3): 297-303 (in Chinese)
[5]Jin D C, Kong X, Cui B J, et al. Biodegradation of di-n-butyl phthalate by a newly isolated Halotolerant sphingobium sp [J]. International Journal of Molecular Sciences, 2013, 14(12): 24046-24054
[6]Liu J J, Sui Y Y, Yu Z H, et al. High throughput sequencing analysis of biogeographical distribution of bacterial communities in the black soils of northeast China [J]. Soil Biology & Biochemistry, 2014, 70(2): 113-122
[7]Cartwright C D, Owen S A, Thompson I P, et al. Biodegradation of diethyl phthalate in soil by a novel pathway [J]. FEMS Microbiology Letter, 2000, 186(1): 27-34
[8]Xu G, Li F S, Wang Q H. Occurrence and degradation characteristics of dibutyl phthalate (DBP) and di-(2-ethylhexyl) phthalate (DEHP) in typical agricultural soils of China [J]. Science of the Total Environment, 2008, 393(2): 333-340
[9]Zheng X, Zhang B T, Teng Y G. Distribution of phthalate acid esters in lakes of Beijing and its relationship with anthropogenic activities [J]. Science of the Total Environment, 2014, 476(1): 107-113
[10]Gil-Sotres F, Trasar-Cepeda C, Leirós M C, et al. Different approaches to evaluating soil quality using biochemical properties [J]. Soil Biology & Biochemistry, 2005, 37(5): 877-887
[11]Vance E D, Brookes P C, Jenkinson D S. An extraction method for measuring soil microbial biomass C [J]. Soil Biology & Biochemistry, 1987, 19(6): 703-707
[12]李振高, 骆永明, 滕应. 土壤与环境微生物研究方法[M]. 北京: 科学出版社, 2008: 236-265
[13]关松荫. 土壤酶及其研究法[M]. 北京: 农业出版社, 1986: 274-346
[14]周礼恺, 张志明. 土壤酶的测定方法[J]. 土壤通报, 1980, 11(5): 37-38
Zhou L K, Zhang Z M. Research methods of soil enzyme [J]. Chinese Journal of Soil Science, 1980, 11(5): 37-38 (in Chinese)
[15]杨佳佳, 安韶山, 张宏, 等. 黄土丘陵区小流域侵蚀环境对土壤微生物量及酶活性的影响[J]. 生态学报, 2015, 35(17): 1-12
Yang J J, An S S, Zhang H, et al. Effect of erosion environment on soil microbial biomass and enzyme activity in the loess hills [J]. Acta Ecologica Sinica, 2015, 35(17): 1-12 (in Chinese)
[16]王志刚, 胡影, 徐伟慧, 等. 邻苯二甲酸酯污染对黑土土壤呼吸和土壤酶活性的影响[J]. 农业环境科学学报, 2015, 34(7): 1311-1316
Wang Z G, Hu Y, Xu W H, et al. Impact of dimethyl phthalate contamination on respiratory rate and enzyme activity in black soil [J]. Journal of Agro-Environment Science, 2015, 34(7): 1311-1316 (in Chinese)
[17]郭杨, 韩蕊, 杜文婷, 等. 邻苯二甲酸酯复合污染对土壤微生态的影响[J]. 环境科学研究, 2010, 23(11): 1410-1414
Guo Y, Han R, Du W T, et al. Effects of combined phthalate acid ester contamination on soil micro-ecology [J]. Research of Environmental Science, 2010, 23(11): 1410-1414 (in Chinese)
[18]高军, 陈伯清. 酞酸酯污染土壤微生物效应与过氧化氢酶活性的变化特征[J]. 水土保持学报, 2008, 22(6): 166-169
Gao J, Chen B Q. Effects of PAEs on soil microbial activity and catalase activity [J]. Journal of Soil and Water Conservation, 2008, 22(6): 166-169 (in Chinese)
[19]隆兴兴, 牛军峰, 史姝琼. 邻苯二甲酸酯类化合物正辛醇-水分配系数的QSPR研究[J]. 环境科学, 2006, 27(11): 2318-2322
Long X X, Niu J F, Shi S Q. Research on quantitative structure-property relationships forn-octanol/water partition coefficients of phthalic acid esters [J]. Environmental Science, 2006, 27(11): 2318-2322 (in Chinese)
[20]郭成藏, 李鲁华, 黄金花, 等. 秸秆还田对长期连作棉田土壤微生物量碳氮磷的影响[J]. 农业资源与环境学报, 2015, 32(3): 296-304
Guo C Z, Li L H, Huang J H, et al. Effects of cotton straw incorporation on soil microbial biomass carbon, nitrogen and phosphorus in long-term continuous cropping cotton field [J]. Journal of Agricultural Resources and Environment, 2015, 32(3): 296-304 (in Chinese)
[21]王鑫宏. DBP/DEHP单一及与Pb复合污染对土壤微生物量碳及土壤酶的影响研究[D]. 长春: 东北师范大学, 2010: 14-16
Wang X H. Effect of DBP/DEHP on soil microbial biomass carbon and enzyme in single and complex pollution with Pb [D]. Changchun: Northeast Normal University, 2010: 14-16 (in Chinese)
[22]Wang Z G, Hu Y L, Xu W H, et al. Impacts of dimethyl phthalate on the bacterial community and functions in black soils [J]. Frontiers in Microbiology, 2015, 6: 405. doi: 10.3389/fmicb.2015.00405
[23]朱凡, 洪湘琦, 闫文德, 等. PAHs污染土壤植物修复对酶活性的影响[J]. 生态学报, 2014, 34(3): 581-588
Zhu F, Hong X Q, Yan W D, et al. Enzymatic activity during phytoremediation of polycyclic aromatic hydrocarbon impacted soil [J]. Acta Ecologica Sinica, 2014, 34(3): 581-588 (in Chinese)
[24]张建, 石义静, 崔寅, 等. 土壤中邻苯二甲酸酯类物质的降解及其对土壤酶活性的影响[J]. 环境科学, 2010, 31(12): 356-361
Zhang J, Shi Y J, Cui Y, et al. Degradation of phthalate esters in soil and the effects on soil enzyme activities [J]. Environmental Science, 2010, 31(12): 356-361 (in Chinese)
[25]Gao J. Dynamic effects of PAEs on soil urease and phosphatase [J]. Agricultural Science & Technology-Hunan, 2010, 11(2): 189- 192
[26]Schloter M, Dilly O, Munch J C. Indicators for evaluating soil quality [J]. Agriculture Ecosystems & Environment, 2003, 98(1): 255-262
[27]Kaplan H, Ratering S, Hanauer T, et al. Impact of trace metal contamination and in situ remediation on microbial diversity and respiratory activity of heavily polluted Kastanozems [J]. Biology and Fertility of Soils, 2014, 50(5): 735-744
[28]Eivazi F, Bayan M R. Effects of long-term prescribed burning on the activity of selected soil enzymes in an oak-hickory forest [J]. Canadian Journal of Forest Research, 1996, 26(10): 1799-1804
[29]Frankenberger W T, Dick W A. Relationships between enzyme activities and microbial growth and activity indices in soil [J]. Soil Science Society of America Journal, 1983, 47(5): 945-951
◆
Response of Microbial Biomass and Enzyme Activities in Black Soil to Di-n-butyl Phthalate Contamination
Wang Zhigang1, Zhao Xiaosong1, Xu Weihui1, Su Yunpeng1, You Yimin1, Liu Shuai1, Hu Ying1, Hu Yunlong1, Zhang Ying2,*
1. Institute of Life Science and Agriculture and Forestry, Qiqihar University, Qiqihar 161006, China 2. Institute of Resource and Environment, Northeast Agriculture University, Harbin 150001, China
20 August 2015accepted 26 October 2015
Di-n-butyl phthalate (DBP), one of the phthalate esters, is ubiquitous environmental pollutant, and it is listed as an environmental priority pollutant by China State Environmental Protection Administration. The purpose of this study is to estimate the impact of DBP contamination on respiration, microbial biomass and enzyme activity in black soil. The results showed that the microbial respiratory rate and the content of the microbial biomass C in the black soil were promoted by the DBP contamination. The content of the microbial biomass N fluctuated greatly under the DBP contamination. The content of the microbial biomass P was correlated negatively with the DBP concentration. Further, the activity of polyphenol oxidase was promoted after the inhibition occurred at the beginning. The activities of protease and invertase were promoted by the low DBP concentration, but inhibited by the high DBP concentration. The activity of urease was activated by DBP in the black soil. The activities of catalase and acid phosphatase was significantly inhibited by the DBP contamination in the black soil. The correlation analysis showed the correlation among the soil microbial biomass, the soil enzyme activity and the DBP concentration. According to the results, DBP could be the key factor that alters the metabolism of the microorganisms in the black soil, and impacts the ecosystem functions in the black soil.
di-n-butyl phthalate (DBP); soil respiration; microbial biomass; soil enzyme; black soil; contamination
国家高技术研究发展计划(863计划)(2012AA101405);黑龙江省青年科学基金(QC2013C032)
王志刚(1980-),男,副教授,硕士生导师,研究方向为环境微生物学,E-mail: wzg1980830@sina.com
Corresponding author), E-mail: zhangying@hotmail.com
10.7524/AJE.1673-5897.20150820001
2015-08-20 录用日期:2015-10-26
1673-5897(2015)6-199-08
X171.5
A
王志刚,赵晓松,徐伟慧, 等. 黑土微生物量和酶活性对邻苯二甲酸二丁酯污染的响应[J]. 生态毒理学报,2015, 10(6): 199-205
Wang Z G, Zhao X S, Xu W H, et al. Response of microbial biomass and enzyme activities in black soil to di-n-butyl phthalate contamination [J]. Asian Journal of Ecotoxicology, 2015, 10(6): 199-205 (in Chinese)

