淮河流域安徽段水体成组生物毒性评价
阴琨,赵淑莉,郭辰,吕占禄,王先良,金小伟
1. 中国环境监测总站,北京 100012 2. 中国地质大学(北京),北京 100083 3. 中国环境科学研究院,北京 100012
淮河流域安徽段水体成组生物毒性评价
阴琨1,2,赵淑莉1,,郭辰3,吕占禄3,王先良3,金小伟1
1. 中国环境监测总站,北京 100012 2. 中国地质大学(北京),北京 100083 3. 中国环境科学研究院,北京 100012
在淮河流域安徽段某区域采集了3个地表水样和12个地下水样,通过大型溞急性毒性(活动抑制)、微核及SOS/umu试验,分析了这些水样的急性毒性及遗传毒性。结果表明,急性毒性测试中,该区域地表水及大部分地下水的急性毒性均未超过US EPA废水排放毒性的控制要求(0.3 TU),有2个位点的地下水样毒性当量为0.31 TU,超过限值;经t-test分析,地表水的急性毒性显著高于地下水。SOS/umu检测中,2个地表水样和7个地下水样的结果呈阳性,表现出DNA损伤效应,其诱导率IR在(2.20 ± 0.063)~(3.36 ± 0.067)之间,对应的致癌风险P基本处在10-6~10-7水平。微核检测结果表明,3个地表水样具有较严重的染色体损伤效应,9个地下水样表现为阴性。总之,该区域地表水急性毒性及遗传毒性相对较高;部分浅层地下水也存在一定程度的急性毒性和遗传毒性,致癌风险处在可接受范围,但仍可能对周围居民的健康产生潜在威胁;而深层地下水没有检测到任何毒性效应。研究为周边居民饮水安全和人体健康提供了基础信息。
大型溞;成组生物毒性;微核;SOS/umu;淮河流域
淮河流域水质的恶化和周边癌症的高发已使其水污染境况倍受关注,根据《淮河流域重点地区死因回顾性调查分析报告》中的结果,2006年,淮河流域部分区域总癌死亡率处于高发水平,特别是胃癌、肝癌、消化系统癌。基于此,有不少学者开展了相关研究,表明淮河流域居民饮用水中多环芳烃(PAHs)及邻苯二甲酸酯等有机污染物含量超标[1],酞酸酯类检出率也很高[2],主要无机污染物包括致癌物质亚硝酸盐[3],且当地居民长期饮用浅层地下水、饮用水井与水质已呈恶化的地表河流、河沟距离太近,受污染威胁的饮用水成为该地区肿瘤高发的重要因素[1]。淮河流域的这些特征污染物中,多环芳烃(PAHs)具有致癌、致畸、致突变的危害[4],在国内外的饮用水标准中已有明确的控制要求;酞酸酯类是激素类污染物有遗传毒性[5-7]。对于淮河流域的污染的研究已经开展了很多,但研究缺乏生物毒性的分析,而这对于从生物角度进一步评估水体的安全性就显得非常重要。
利用大型溞作为受试生物的毒性测试是一类非常重要的生物活体毒性测试,因其易于观察,繁殖速度快,对毒性物质具有较高的敏感性等特点,被国内外广泛应用于水体及化学品的毒性分析中[8]。其急性毒性(活动抑制)测试方法具有终点易于观察,测试周期短,而且能反映出最明显的有害影响的特点[9-10],不仅在化学品毒性[11-13]、各类型工业废水[14-15]生物毒性中开展了研究,也有不少研究集中在环境水体[16]、饮用水安全[16]等领域。微核及SOS/umu试验属于离体生物毒性测试技术,是两类非常有代表性的遗传毒性检测方法。SOS/umu试验以DNA损伤诱导umu操纵子表达作为检测由终点,所以其可以检测出由DNA损伤引起的遗传毒性,已被列为ISO环境水样及废水遗传毒性监测的标准方法[17]。微核试验以染色体损伤的结构和数量变化作为检测终点,所以其检测的是染色体异常所引发的遗传毒性[18],两者检测的终点不同,反映的遗传毒性作用机制也不同,可以互补。
本研究利用大型溞活动抑制试验、微核试验和SOS/umu试验对淮河流域某区域的地下水和地表水进行了急性毒性和遗传毒性分析,研究结果为周边居民饮水安全和人体健康提供了理论参考依据。
1 材料与方法(Materials and methods)
1.1试剂和仪器
4-硝基喹啉-1-氧化物(4-NQO,Sigma)、二甲基亚砜(DMSO,Sigma)、二氯甲烷、甲醇、丙酮(色谱纯,美国DIMA)、胰蛋白胨(OXIOD)、羟乙基哌嗪硫磺酸(Sigma)、邻硝基苯酚半乳糖苷(ONPG,Sigma)、RPMI-1640培养基(Hyclone)、澳洲产胎牛血清(Gibco)、TK6人成淋巴细胞(美国ATCC)。
氮吹仪(美国Organomation Associates)、人工气候箱(上海一恒)、连续波长酶标仪(Multiskan go USA)、CO2培养箱(上海博讯)、离心机(湖南湘仪)。
1.2样品采集和处理1.2.1采样位点
在淮河流域安徽段某区域设置15个采样位点(见图1),S1、S2、S3为地表水;S4~S14为分散式浅层地下水,S15为深层地下水。采样时间为2014年4月。
1.2.2水样的富集
用棕色玻璃瓶采集6 L水样,于在4 ℃保存,用0.45 μm的玻璃纤维滤膜及真空泵进行抽滤,将抽滤后的水样用活化后的HLB固相萃取小柱(6 mL,500 mg,waters oasis)进行浓缩,控制水样的流速在6~8 mL·min-1,并于48 h内完成。同一水样用3个小柱同时过滤,每根小柱最多富集2 L水样。富集完的HLB柱于-20 ℃保存待洗脱定容用。
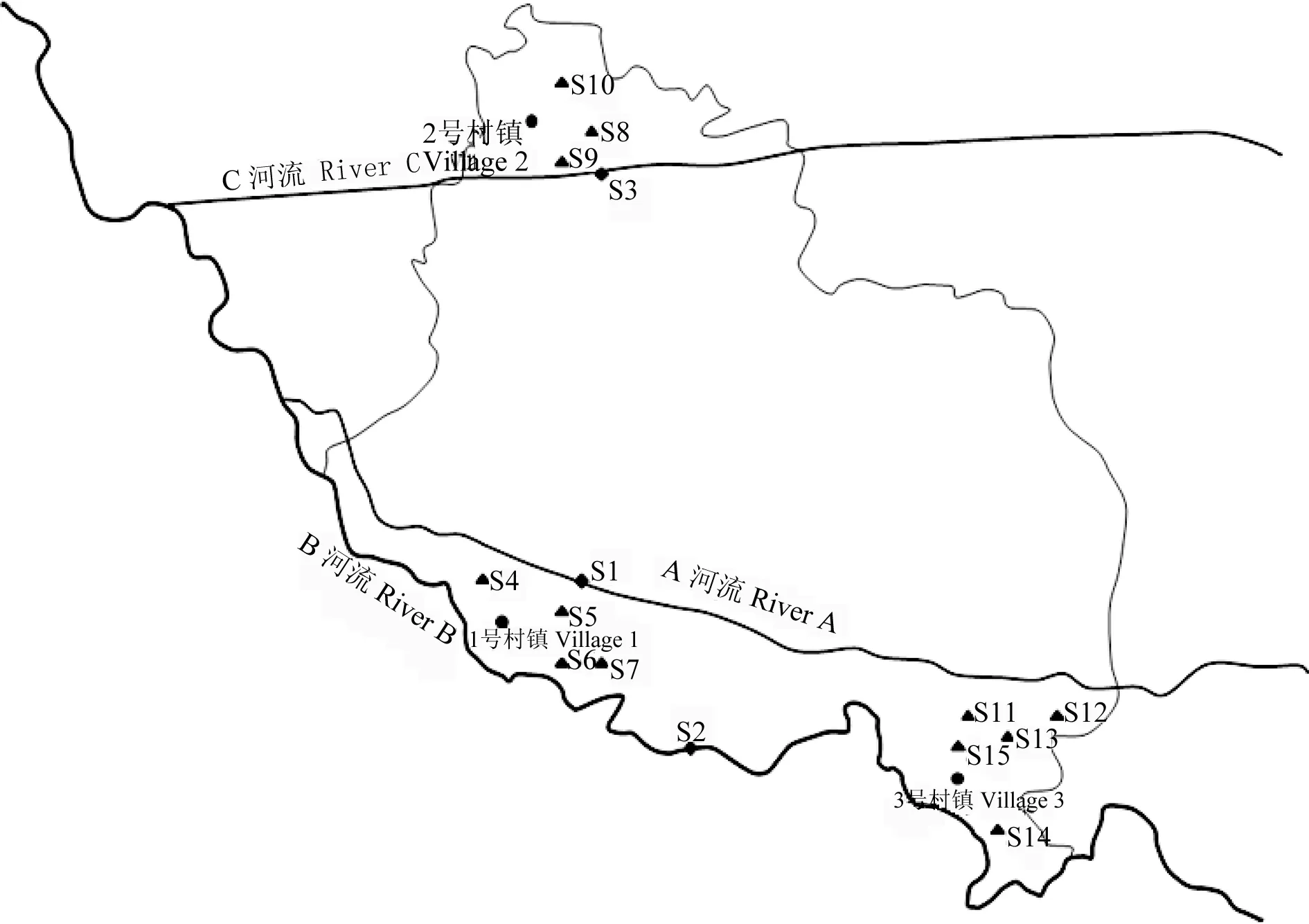
图1 淮河流域安徽段某区域采样位点Fig. 1 Sampling sites in the region of Anhui section in Huaihe River basin
1.2.3水样的洗脱和定容
用6~10 mL丙酮对抽干水分的小柱进行洗脱,洗脱至样品为无色为止。将同一样品的洗脱溶液合并,大型溞活动抑制试验洗脱溶液用氮吹仪吹至丙酮的量小于0.6 μL后,将其转移到容量瓶中用标准稀释液定容至600 mL,同时丙酮含量在1‰以内。定容样品作为毒性试验备用。微核及SOS/umu试验用氮吹仪吹至完全干燥,用DMSO定容,-20 ℃保存,待生物毒性分析备用。
1.3毒性测试1.3.1大型溞活动抑制试验
方法参照US EPA毒性测试方法进行[19],采用大型溞毒性测试试剂盒(欧陆科仪 DAPHTOXKIF FTM MAGNA)进行试验。具体方法如下:用标准稀释水将浓缩水样稀释为5个浓度梯度(即10×,5×,2.5×,1.25×及0.5×),以标准稀释水为空白,每个浓度组设4个平行,每个平行放置5个出生24 h内的幼溞,并以1‰丙酮做溶剂对照,于人工气候箱20 ℃下暗光培养。根据抑制情况计算半数抑制浓度EC50,并按以下公式计算毒性当量(TU)[20]:
TU=100%/EC50(%)
(1)
1.3.2SOS/umu试验
试验菌株选用鼠伤寒沙门氏菌 (Salmonella typhimurium )TA 1535/pSK 1002。首先对菌株进行复苏和培养,将-80 ℃冻存的受试菌株TA 1535/pSK1002缓慢解冻后混匀,吸取100 μL原菌液加入到10 mL TGA培养基中,于150~180 r·min-1,(37 ± 1) ℃下振荡孵育过夜。第2天用TGA培养液10倍稀释,于37 ℃振荡孵育1.5~3 h。过程中以TGA培养基为空白对照,测定菌液在600 nm处的吸光度值为0.25~0.30时,细菌达到指数生长期,将此时菌液作为暴露备用。
暴露试验参照ISO 13829进行[17]。具体方法如下:试验以500 ng·mL-1的4-NQO作为阳性对照,以无菌水为阴性对照、以DMSO为溶剂对照,空白为无菌水(不含菌液)。在酶标板内用无菌水将水样进行梯度稀释,配置成6个暴露组(暴露量为0.8 L,0.4 L,0.2 L,0.1 L,0.05 L,0.025 L),稀释后体积为180 μL,每个暴露组做3个平行;阳性对照组加入4-NQO 180 μL,终浓度为500 ng·mL-1;溶剂对照组加入153 μL无菌水和27 μL 30%的DMSO;再向以上各组每个测试孔内加入20 μL 10×TGA(胰蛋白10 g,NaCl 5 g,羟乙基哌嗪硫磺酸11.9 g,葡萄糖2 g于100 mL蒸馏水中,高压灭菌后,加入50 mg氨卞青霉素),再加入70 μL菌液,反应总体积为270 μL。将酶标板于(37±1) ℃,120~150 r·min-1下振荡培养2 h。取另一酶标板,每孔加入270 μL TGA培养基(同10×TGA,溶解于1 000 mL),预热至(37 ± 1) ℃;从上一培养板每孔中取30 μL培养物至相对应的孔中,培养2 h,在600 nm下测定吸光度。取此培养物每孔30 μL至已经加入120 μL B-buffer的新酶标板中,迅速加入30 μL ONPG,混匀后于(28 ± 1) ℃振荡培养30 min后,再向每孔加入1 mol·L-1Na2CO3酶反应阻断液,在420 nm处测定吸光度。
结果的计算参照程龙凤[21]的研究进行,按如下公式计算β-半乳糖苷酶活性U、生长因子G、诱导率IR、样品的4-NQO当量浓度TEQ4-NQO(μg·L-1)以及致癌风险P。
β-半乳糖苷酶活性U(unit)计算公式:
(2)
生长因子G计算公式:
G =(A600, S-A600, B)/(A600, N-A600, B)
(3)
诱导率IR计算公式:
(4)
TEQ4-NQO=IRS/IR4-NQO(μg·L-1)
(5)
P=[(TEQ4-NQO×0.001×1.5)/65]×0.369
(6)
其中,S:样品结果;B:空白对照结果;N:阴性对照结果;P:阳性对照结果。A420:菌液在420 nm波长下的吸光度(显色剂ONPG的显色强度);A600:菌液在600 nm波长下的吸光度(菌液浊度);致癌风险P计算中,按照调查区域实际情况取值,成年人体重按65 kg计,每日饮水量按1.5 L计。
1.3.3微核试验
参考相关学者测试方法,具体步骤如下[21]:
首先将冻存的TK6细胞进行复苏和传代培养(培养基:RPMI 1640培养基,再加入10%胎牛血清和双抗(青霉素100 Uint·mL-1、链霉素0.1 g·mL-1),使细胞浓度始终保持在2×105~1×106cells·mL-1之间。将待传代的细胞按2×105cells·mL-1以每孔1 mL的量加入24孔板中,培养24 h。将受试水样(地表水暴露量为0.03 L,地下水为0.3 L)加入培养液中继续培养48 h后离心收集细胞,加入1 mL冷PBS(51 mL的A液:二水合磷酸二氢钠31.2 g·L-1和49 mL的B液:十二水合磷酸氢二钠71.6 g·L-1)洗涤细胞,洗涤2次;先后分别以1 mL、500 μL固定液(V甲醇:V冰醋酸= 4:1)固定,吹散混匀;干燥后用Giemsa染液染色13 min;经洗脱后用显微镜观察计算微核千分率(MNC‰)和污染指数PI。
污染指数PI=实验组微核率-空白对照组微核率 / 阴性对照组的微核率(7)
2 结果与讨论(Results and discussion)
2.1大型溞急性毒性
急性毒性分析结果表明(见表1),淮河流域研究区的15个水样,除5个未出现抑制,其余10个水样都表现出不同程度的毒性。地表水中S2的毒性比较大,S3相对略轻;深层地下水样S16在试验中大型溞未出现任何抑制,水质安全;S4~S14 11个浅层地下水样中S13、S12、S7的毒性较大,居前3位;S6、S8、S9、S14未显示出毒性。美国EPA废水排放的毒性标准要求,排放水体的毒性当量应<0.3 TU(TU为毒性单位,TU越大表示毒性越大),否则会影响受纳地表水的安全,不允许排放[22],以此保护对地表水。参考此限值分析,24 h毒性试验中,地表水3条河流的毒性当量均小于0.3 TU,低于毒性限值。3条河流的毒性为S2>S1>S3,S1、S2水样的毒性是S3的2.7倍。地下水检测出毒性的7个水样的毒性当量在0.035~0.22之间,以S13位点的毒性最高。48 h毒性试验中,3条河流的毒性当量也均小于0.3 TU,但毒性均比24 h要高,48 h的毒性为S2>S3>S1,仍然是S2水样的毒性最大,S1,S2的平均毒性略高于S3,为其1.04倍。地下水S13和S12位点的毒性当量为0.31,均已经超过限值,水体毒性效应比较明显。

表1 淮河流域安徽段水体大型溞急性毒性检测结果
注:“——”表示未出现抑制,“+”表示毒性超过0.3 TU,“-”表示毒性未超过0.3 TU。
Note: “——” No inhibition, “+” Toxicity exceeded 0.3 TU, “-” Toxicity did not exceed 0.3 TU.
根据相关研究报道S3所经村镇癌症死亡率相对比S2和S1所经村镇的癌症死亡率要低[21]。本研究结果基本表现为癌症疾病高发区的毒性高于癌症低发区。此外,研究在采样时可见S1位点水质较差,发黑,并伴有轻微臭味,河岸两边可见大量垃圾堆放;S2采样点河流主要用作运输航道,据调查其早期水质很差,散发臭味,经常出现鱼类死亡的现象,目前水质有所好转。S3位点水质相对比较好,是当地的饮用水源地。由此可见,毒性分析结果与河流的水质情况也比较相符,表明受污染的水质确实产生了一定程度的毒性效应。
从地表水与地下水的毒性均值t-test结果可见(见表2),24 h和48 h的概率p值分别为0.038和0.002,均小于显著水平(P=0.05),表明地表水的24 h和48 h毒性与地下水存在显著差异,即研究区地表水的毒性显著高于地下水。淮河流域是我国主要的产粮区,流域内农业生产中施用的化肥农药(N、P、有机毒物)、生活中产生的生活污水和垃圾(重金属和难降解有机物)、以及畜禽养殖产生的污染物(氨)经地表径流、降水、灌溉、农田排水等途径进入并污染河流和地下水[23-24]。陈国良[25]对淮河流域的调查发现,安徽段面源污染问题是:部分农田用接纳生活污水的沟渠水灌溉;生活垃圾随意堆放;绝大多数农村都缺乏排水渠和污水处理系统,生活污水随意排放,或直接排入河流。这些面源污染已成为流域地表水和地下水污染的主要来源,而降水会携带面源污染物进入水体,导致水体污染物增高,这种影响在施肥季节十分显著[26]。基于以上分析,研究认为毒性很可能主要是由面源污染带入水体的农药、重金属、难降解有机物、氨等有毒物质引起的。另一方面,虽然当地居民多以浅水井中的地下水为饮用水源,且浅层地下水的毒性虽然比地表水要轻,但受污染的地表水体很可能通过灌溉、渗透等水体交换的方式影响到周围区域的浅层地下水水质[27],从而对周边居民的健康产生危害,而且这些浅层地下水本身也已经表现出不同程度的毒性反应。而研究结果显示深层地下水在未表现出毒性,比较安全,且其受到地表水污染的可能性也小。
2.2SOS/umu试验
根据SOS/umu检测结果分析(见表3),S2、S3、S6、S10~S15共9个位点水样的IR>2,水样呈阳性,表现出遗传毒性。S11、S13和S2位点水样遗传毒性最大,其IR值分别为3.36 ± 0.067、3.11 ± 0.073、3.01 ± 0.061,均远大于2。地表水仍然是S2位点的毒性最大,相似的结论在之前学者的研究中也得到了证实[21]。12个地下水位点中有7个浅层地下水位点表现出遗传毒性。由于SOS/umu试验作为一类重要的遗传毒性检测方法,其检测的是DNA损伤引发的遗传学改变,针对的是不同类型的致突变物质[28-29],所以以上结果表明这些位点的水样存在能导致DNA损伤的致突变物质。另一方面,以致癌风险P分析,除地表水S2位点的致癌风险达到10-6,其余位点水样的致害风险P均在10-7水平。美国EPA对于致癌物质的致癌风险要求控制在10-4~10-6可接受范围,并以10-6作为评价标准[30-31]。由此分析,地表水S2位点达到美国对于致癌风险的控制的最低水平要求,但仍在可接受范围内;其余位点均低于美国致癌风险的控制要求,因此认为虽然研究区超过一半的地表水和地下水在SOS/umu试验显示出遗传毒性,但对人体的健康风险仍处于可接受的水平。
2.3微核试验
微核检测结果表明,S1、S2、S3三个地表水样显示出较高的遗传毒性(暴露量为0.03 L),均达到重度污染,其PI值均超过3.5,分别为4.06、4.56和6.11,其中S2位点水样的遗传毒性最大,其微核率达到41.00 ± 2.08。地下水的遗传毒性(暴露量为0.3 L)比地表水明显要轻,其中除S6为中度污染,S8、S11为轻度污染外,其余9个位点均未检测出遗传毒性,而且其PI值基本都在0.5以下。可见,地表水的暴露量仅为地下水暴露量的1/10,但是其微核检测仍然表现出较高的遗传毒性,说明地表水的污染危害比地下水更大。这与大型溞急性毒性以及SOS/umu试验的检测结果基本相符,尤其是S2位点,在3个试验中均表现出较高的毒性。由于微核试验与SOS/umu不同,其指示的是染色体损伤的结构和数量变化[32]。所以,研究认为地表水和部分检测阳性的地下水中存在能引发染色体异常的污染物质,而且地表水的污染要更严重。

表2 淮河流域安徽段水体大型溞急性毒性的t-test结果
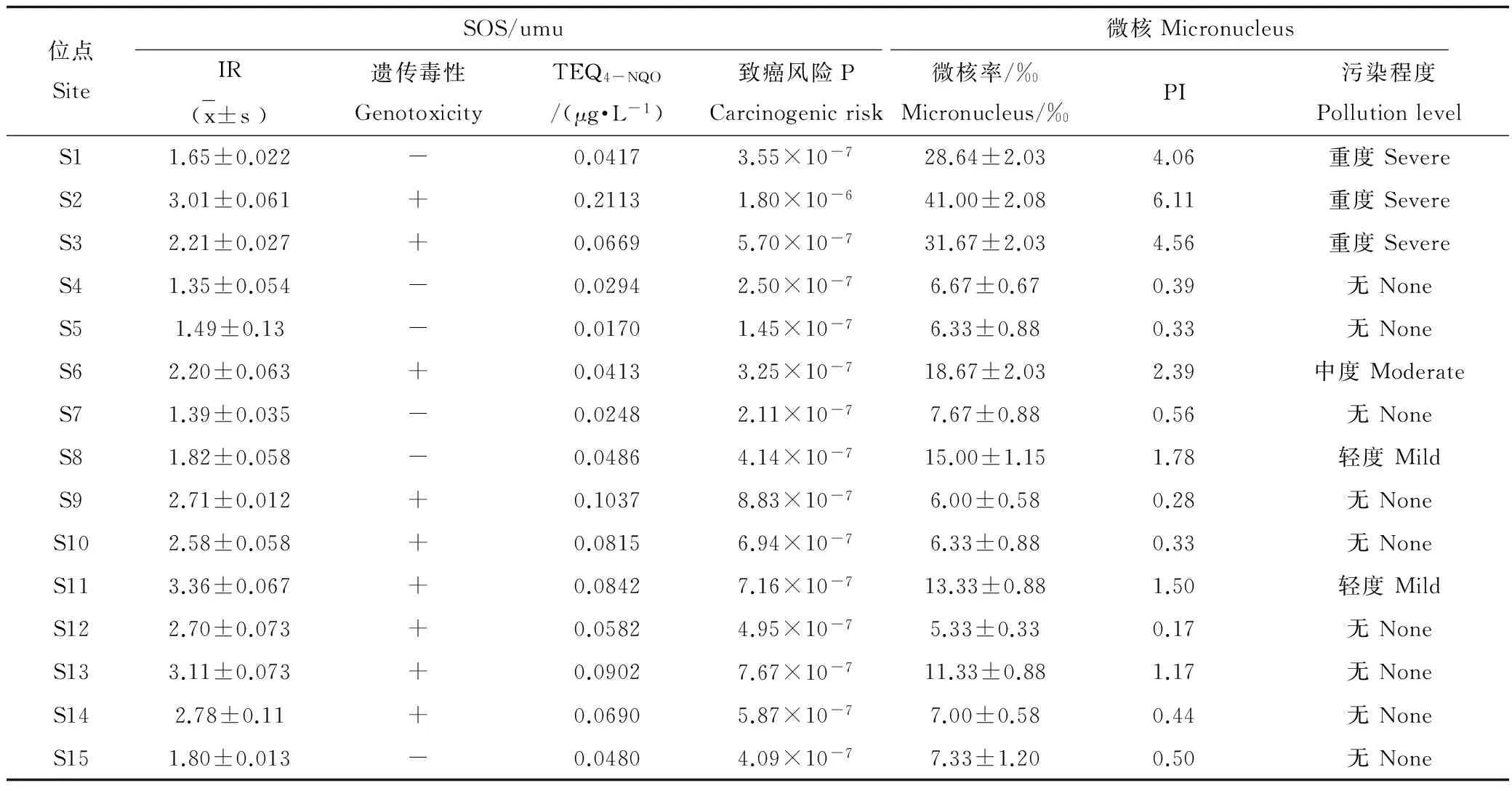
表3 淮河流域安徽段水质的遗传毒性检测结果
综上所述,本研究结果表明,3个地表水体对大型溞急性毒性及致DNA损伤和致染色体异常的遗传毒性均较高,尤其是S2位点最为严重。部分浅层地下水也检测到一定程度不同类型的遗传毒性,从致癌风险分析其还在可接受范围,但是水体已经受到污染,可能对周围居民的健康产生潜在威胁。同时,深层地下水在三类毒性测试中都表现为阴性,没有检测到任何毒性效应。因此,对于淮河流域安徽段的面源污染问题,以及地表水和地下水的污染情况应该予以重视。
通讯作者简介:赵淑莉(1967-),女,环境化学博士,研究员,主要从事环境健康监测与健康风险评价研究。
[1]路青艳. 某地下水污染农村地区肿瘤患者经济损失分析[D]. 北京: 中国疾病预防控制中心, 2007: 33-38
Lu Q Y. The analysis of economic burden for malignant patients in the groundwater polluted area [D]. Beijing: Chinese Center for Disease Control and Prevention, 2007: 33-38 (in Chinese)
[2]那金. 淮河流域浅层地下水中有机污染物特征及成因研究[D]. 常州: 江苏工业学院, 2009: 6-12
Na J. The characteristics and formations of organic pollutants in the shallow groundwater in Huaihe River Basin [D]. Changzhou: Jiangsu Polytechnic University, 2009: 6-12 (in Chinese)
[3]徐小磊. 淮河流域安徽段地下水污染调查评价与防治对策研究[J]. 安徽地质, 2007, 17(2): 128-133
Xu X L. Investigation evaluation of groundwater resources in the Huai River basin (in the part of Anhui) and the countermeasure study [J]. Geology of Anhui, 2007, 17(2): 128-133 (in Chinese)
[4]Luo X J, Chen S J, Mai B X, et al. Distribution, source apportionment, and transport of PAHs in sediments from the Pearl River Delta and the Northern South China Sea [J]. Archives of Environmental Contamination & Toxicology, 2008, 55(1): 11-20
[5]Blount B C, Silva M J, Caudill S P, et al. Levels of seven urinary phthalate metabolites in a human reference population [J]. Environmental Health Perspectives, 2000, 108(10): 979-982
[6]Tsumura Y, Ishimitsu S, Saito I, et al. Eleven phthalate esters and di-(2-ethylhexyl) adipate in one-week duplicate diet samples obtained from hospitals and their estimated daily intake [J]. Food Additives and Contaminants, 2001a, 18: 449-460
[7]Tsumura Y, Ishimitsu S, Saito I, et al. Di-(2-ethylhexyl) phthalate contamination of retail box lunches caused by PVC gloves used in preparation [J]. Food Additives and Contaminants, 2001, 18: 569-579
[8]阴琨, 赵淑莉. 生物毒性测试在环境与健康综合监测中的应用[J]. 环境科学与技术, 2014, 37(12): 321-327
Yin K, Zhao S L. Application of biological toxicity testing in environmental health comprehensive monitoring [J]. Environmental Science & Technology, 2014, 37(12): 321-327 (in Chinese)
[9]Wei D B, Kisuno A, Kameya T, et al. A new method for evaluating biological safety of environmental water with algae,daphnia and fish toxicity ranks [J]. Science of the Total Environment, 2006, 371(123): 383-390
[10]申颖洁, 顾永钢, 廖日红, 等. 受污染地表水的生物毒性效应分析[J]. 环境科学与技术, 2011, 34(10): 1-5
Shen Y J,Gu Y G, Liao R H, et al. Analysis of biotoxicity effect for the polluted surface rivers [J]. Environmental Science & Technology, 2011, 34(10): 1-5 (in Chinese)
[11]Wakabayashi M. Screening of organophosphate pollution in water by using Daphia magna [J]. Ecotoxical Environmental Safety, 2000, 47: 239-245
[12]黎艳霞, 杨俭美. 4种杀虫药剂对大型蚤(Daphia magna)的毒性和酶活性影响的比较[J]. 北京大学学报:自然科学版, 1997, 33(2): 197-202
Li Y X, Yang J M. Comparison of the toxicity and the influence of enzyme activity of four kinds of insecticides to Daphnia magna [J]. Universitatis Pekinensis:Acta Scientiarum Naturalium, 1997, 33(2): 197-202 (in Chinese)
[13]孙红文, 黄国兰, 李书霞, 等. 三苯基锡和三丁基锡对大型蚤(Daphnia magna)的毒性研究[J]. 环境化学, 2000, 19(3): 235-239
Sun H W, Huang G L, Li S X, et al. Study on toxic effects of triphenyltin and tributyltin on Daphnia magna [J]. Environmental Chemistry, 2000, 19(3): 235-239 (in Chinese)
[14]曲克明, 袁有宪, 陈民山, 等. 化纤废水中主要污染物对大型蚤的急性毒性及联合毒性作用[J] .中国水产科学, 2000, 7(1): 78-81
Qu K M, Yuan Y X, Chen M S, et al. Acute toxicity and joint effect of pollutants in fiber wastewater on Daphnia magna [J]. Journal of Fishery Sciences of China, 2000, 7(1): 78-81 (in Chinese)
[15]袁有宪, 王会平. 化纤废水中污染物对大型溞(Daphnia magna)繁殖的影响[J]. 中国环境科学, 1998, 18(2): 117-120
Yuan Y X, Wang H P. Effects of pollutants in chemical fiber wastewater on reproduction of Daphnia magna [J]. China Environmental Science, 1998, 18(2): 117-120 (in Chinese)
[16]潘力军, 高世荣, 孙凤英, 等. 应用大型水蚤对农药和无机砷污染的饮用水和地表水源水毒性检测[J]. 中国卫生检验杂志, 2007, 17(2): 233-235
Pan L J, Gao S R, Sun F Y, et al. Detection for toxicity of drinking water and water resource polluted by pesticides and in organic arsenic with Daphnia magna [J]. Chinese Journal of Health Laboratory Technology, 2007, 17(2): 233-235 (in Chinese)
[17]International Organization for Standardization (ISO). Water quality determination of the genotoxicity of water and wastewater using the umu-test [S]. Berlin, Germany:ISO/CD 13829, DIN, 2000
[18]Lorge E, Lambert C, Gervais V, et al. Genetic toxicity assessment: Employing the best science for human safety evaluation.Part II: Performances of the in vitro micronucleus test compared to the mouse lymphoma assay and the in vitro chromosome aberration assay [J]. Toxicological Sciences, 2007, 96(2): 214-217
[19]U. S. Environmental Protection Agency. Method 2021.0. Daphnia puplex and Daphnia magnaacute test [S]. Washington DC: Office of Water, 2002
[20]U.S. Environmental Protection Agency. EPA/600 /R-92 /080. Methods for aquatic toxicity identification evaluations: Phase II toxicity identification procedures for samples exhibiting acute and chronic toxicity [R]. Washington DC: Office of Research and Development, US EPA, 1993
[21]程龙凤. 淮河流域某地区浅地下水遗传毒性监测[D]. 武汉: 华中科技大学, 2013: 12-21, 42-45
Cheng L F. Genetic toxicity of shallow groundwater quality in some areas of the Huai River [D]. Wuhan: Huazhong University of Science and Technology, 2013: 12-21, 42-45
[22]U.S. Environmental Protection Agency. Technical Support Document for Water Quality-Based Toxics Control, EPA/505/2-90/001 [R]. Washington DC: Office of Research and Development, U.S. Environmental Protection Agency, 1991
[23]周涛, 刘文清, 张晓玲. 浅谈淮河流域农业面源污染的成因与防治[J]. 治淮, 2013, 12: 4-5
[24]王飞. 淮河流域水污染成因及防治对策探讨[C]. 青年治淮论文集, 2005, 125-131
[25]陈国良. 淮河流域部分地区农村环境卫生状况调查[D]. 石家庄: 河北医科大学, 2012: 1-19
Chen G L. Survey of environmental health in some rural areas of Huaihe River Basin [D]. Shijiazhuang: Hebei Medical University, 2012: 1-19 (in Chinese)
[26]金书秦, 武岩. 农业面源是水体污染的首要原因吗?—基于淮河流域数据的检验[J]. 中国农村经济, 2014, 9: 71-81
[27]张龙江, 朱维斌, 陶然, 等. 濉河符离集段地表水污染与傍河浅层地下水相互关系的研究[J]. 地下水, 2006, 28(5): 44-46
Zhang L J, Zhu W B, Tao R, et al. Study on the Interrelation between pollution of surface water and shallow groundwater around Sui River in Fuliji Area [J]. Ground water, 2006, 28(5): 44-46 (in Chinese)
[28]Hisama M, Matsuda S, Tanaka T, et al. Suppression of mutagens-induced SOS response by phytoncide solution using Salmonella typhimurium TA1535/pSK1002 umu test [J]. Journal of Oleo Science, 2008, 57(7): 381-390.
[29]Kirkland D, Speit G. Evaluation of the ability of a battery of three in vitro genotoxicity tests to discriminate rodent carcinogens and non-carcinogens III. Appropriate follow-up testing in vivo [J]. Mutation Research/Fundamental & Molecular Mechanisms of Mutagenesis, 2008, 654(2): 114-132.
[30]陈锡超, 罗茜, 宋翰文, 等. 北京官厅水库特征污染物筛查及其健康风险评价[J]. 生态毒理学报, 2013, 8(6): 981-992
Chen X C, Luo Q, Song H W, et al. Screening of priority contaminants and health risk assessment in Beijing Guanting reservoir [J]. Asian Journal of Ecotoxiciology, 2013, 8(6): 981-992 (in Chinese)
[31]United State Environmental Protection Agency. Selection of Carcinogenic Targent Risk Levels for Soil and Groundwater Remediation by Mark Malander, Mobil Oil Corporaton [OL]. 2008. heep://www.epa.gov/OUST/rbdm/sctrlsgw.htm
[32]CakalA O, Parlak H, Katalay S, et al. Detecting micronuclei frequency in some aquatic organisms for monitoring pollution of Izmir Bay (Western Turkey) [J]. Environmental Monitoring & Assessment, 2010, 165(1): 55-66
◆
Evaluation on Water Bodies in Anhui Section of Huaihe River Basin by a Battery of Bioassays
Yin Kun1,2, Zhao Shuli1,*, Guo Chen3, Lv Zhanlu3, Wang Xianliang3, Jin Xiaowei1
1. China National Environmental Monitoring Centre, Beijing 100012, China 2. China University of Geosciences (Beijing), Beijing 100083, China 3. China Research Academy of Environmental Sciences, Beijing 100012, China
18 August 2015accepted 28 September 2015
Three surface water samples and twelve groundwater samples were collected in the region of Anhui section in Huaihe River Basin. The acute toxicity and genetic toxicity of these samples were analyzed, by the test of Daphnia magna acute toxicity (inhibition), micronucleus test and SOS/umu test. The results showed that for the acute toxicity test, the acute toxicity of surface water and most of groundwater in the area did not exceed the threshold of US EPA for industrial effluents toxicity (0.3 TU), the toxicity of two groundwater samples was 0.31 TU which exceeded the threshold. The acute toxicity of surface water was significantly higher than that of groundwater by t-test analysis. In SOS/umu test, the results of two surface water samples and seven groundwater samples were positive, showing DNA damage, and the induction rate of IR was between (2.20 ± 0.063) ~ (3.36 ± 0.067), but the carcinogenic risk level was between 10-6~ 10-7. The results of micronucleus test showed that three surface water samples reached the severe pollution, and nine groundwater samples were negative. In conclusion, the acute toxicity and genetic toxicity of surface water body were relatively high, some shallow groundwater also existed some degree of acute toxicity and genetic toxicity, although their carcinogenic risk were in the acceptable range, still may have a potential threat to the surrounding residents’ health. However, the deep groundwater did not detect any toxicity. The study provided the basic information on the drinking water safety and human health for the surrounding residents.
Daphnia magna; a battery of bioassays;micronucleus; SOS/umu; Huaihe River Basin
环保公益性行业科研专项“典型水体污染区环境与健康综合监测关键技术及案例研究”项目(201309045);国家水体污染控制与治理科技重大专项“流域水生态环境质量监测与评价研究”项目(2013ZX07502001)
阴琨(1982-),女,博士,研究方向为生物监测与评价,E-mail: yinkun@cnemc.cn
Corresponding author), E-mail: zhaosl@cnemc.cn
10.7524/AJE.1673-5897.20150818001
2015-08-18 录用日期:2015-09-28
1673-5897(2015)6-093-08
X171.5
A
阴琨, 赵淑莉, 郭辰, 等. 淮河流域安徽段水体成组生物毒性评价[J]. 生态毒理学报,2015, 10(6): 93-100
Yin K, Zhao S L, Guo C, et al. Evaluation on water bodies in Anhui Section of Huaihe River Basin by a battery of bioassays [J]. Asian Journal of Ecotoxicology, 2015, 10(6): 93-100 (in Chinese)

