围生期毒死蜱暴露致子代8周雄鼠睾丸组织的氧化损伤
徐肖倩,张敏,王学梅,方鑫,李海玲,戴红,*,肖瑞,#
内蒙古医科大学,呼和浩特010010
围生期毒死蜱暴露致子代8周雄鼠睾丸组织的氧化损伤
徐肖倩1,张敏1,王学梅1,方鑫1,李海玲1,戴红1,*,肖瑞1,#
内蒙古医科大学,呼和浩特010010
毒死蜱是目前全世界使用和销售量最大的有机磷杀虫剂之一。为探讨围生期毒死蜱暴露致8周雄性子鼠睾丸组织的氧化损伤,选择健康Wistar妊娠母鼠于妊娠期(gestation days, GD)第6天至子鼠出生后(postnatal days, PND)21天通过灌胃染毒0、0.75、1.35和2.70 mg·kg-1剂量的毒死蜱,待雄性子鼠8周龄取左侧睾丸实施组织病理学检查,右侧睾丸用以检测丙二醛(maleic dialdehyde, MDA)的含量和谷胱甘肽S转移酶(glutathione S transferases, GST)、谷胱甘肽过氧化物酶(glutathione peroxidase, GSH-Px)、总超氧化物歧化酶(total superoxide dismutase, T-SOD)的活力。结果表明,与对照组比较,随着染毒剂量的增加子鼠体重和睾丸、附睾脏器系数有下降的趋势(P>0.05);而MDA呈升高趋势(P>0.05)。各组T-SOD和1.35、2.70 mg·kg-1剂量组GSH-Px活力的下降及2.70 mg·kg-1剂量组GST活力的升高均有统计学意义(P<0.05)。睾丸组织病理学检查结果可见2.70 mg·kg-1剂量组睾丸组织有明显的损伤,管腔中精液量减少,生精细胞脱落增多。上述研究结果提示母鼠于围生期暴露于毒死蜱,可通过氧化损伤诱导子代雄性大鼠睾丸的毒性作用。
毒死蜱;大鼠;氧化损伤;睾丸;子代;围生期
有机磷农药毒死蜱(O,O-二乙基-O-(3,5,6-三氯-2-吡啶基)硫代磷酸酯,chlorpyrifos,CPF)具有广谱、低毒和高效的特点,广泛应用于农业生产和家庭生活中,是目前全世界生产和销售量最大的杀虫剂之一,从而导致其在环境介质和多种食品中广泛残留[1-4],对人类健康和生态环境构成极大的潜在威胁。
有流行病学调查表明,在农药污染严重的地区男性生育力低下情况尤为突出,有机磷农药CPF对雄性的生殖毒性主要表现为引起精子质和量的下降及睾丸组织发生退行性变化[5-6]。CPF对雄性的生殖毒性可能主要是通过诱导睾丸的氧化应激和抑制睾丸标志酶的活性来影响睾丸的功能,从而影响精子的生成、发育及成熟;此外,毒死蜱对雄性激素水平也有一定的影响[7]。也有研究者认为CPF可通过形成DNA加合物而直接引起精子DNA的损伤[8]。
发育期的生理特点与CPF的理化性质决定生命早期对CPF易感。2000年,美国环保局就提示人们:胎儿和幼子的CPF暴露危险性是成年人的10倍以上。而由于CPF不但可以通过胎盘屏障还可以通过血睾屏障,此外,在接触者的尿液和乳汁等中都可以检测到CPF及其代谢产物,这就使得婴幼儿可以通过母体暴露于CPF[7]。截止目前,关于围生期通过母体暴露于CPF对子鼠是否具有潜在的和长期的雄性生殖毒性作用少有报道。本文力图通过母鼠于妊娠期(gestation days, GD)第6天至子鼠出生后(postnatal days, PND)21天(GD 6~PND21 d)灌胃染毒不同剂量的CPF,检测子鼠至8周龄时睾丸组织的脂质过氧化损伤及组织病理学变化,揭示围生期通过母体暴露于CPF后对子鼠睾丸组织的潜在远期毒性作用。
1 材料与方法 (Materials and methods)
1.1仪器与试剂
T6新悦可见分光光度计(北京普析通用仪器有限责任公司),L500台式低速自动平衡离心机(湘仪离心机仪器有限公司),FSH-Ⅱ高速电动匀浆机(江苏金坛金城国胜实验仪器厂),LEICA ASP 200S全自动组织脱水机、LEICA EG1150C包埋仪(德国徕卡),FINESSE 325切片机(北京弘泰嘉业科技发展有限公司),LEICA HI1210摊片机、LEICA HI1220烘片机(上海徕卡仪器有限公司),BM 2000倒置荧光显微镜(宁波市江东璟瑞仪器仪表有限公司)。
CPF(纯度为97%)购自太原瑞和平科贸有限公司,MDA、GST、GSH-Px、T-SOD及总蛋白测定试剂盒购自南京建成生物工程研究所,其余试剂均为分析纯。
1.2实验动物的分组及染毒
Wistar大鼠及饲料购自内蒙古大学实验动物中心,符合国家二级动物标准,合格证号:<京动字>第8806R0ll号。雌性50只,雄性21只,自然光照,给予充足的食物和水。
Wistar大鼠10周龄时进行交配,通过阴道涂片查精子法确定妊娠。将妊娠雌鼠随机分为4组,每组9只。于GD 6~PND21 d灌胃染毒以下剂量的CPF:0(灌胃等量玉米油)、0.75、1.35和2.70 mg·kg-1,灌胃容量为3 mL·kg-1,每周连续染毒6 d。子鼠PND21 d后不再给予任何处理,雌雄子鼠分笼饲养,直至子鼠8周时每组随机选择8只雄性子鼠进行实验。
1.3实验方法
1.3.1一般状况观察
每天观察实验大鼠的饮水、进食等情况及有无中毒症状出现。
1.3.2体重及睾丸、附睾脏器系数的测定
于染毒期末称量大鼠体重,处死大鼠后迅速分离睾丸和附睾并计算脏器系数,公式如下:
脏器系数(%)=脏器湿重(g)/体重(g)×100%
1.3.3脂质过氧化指标测定
10%睾丸组织匀浆的制备:处死实验动物后迅速分离出睾丸组织,并剔除周围的脂肪后称重。取右侧睾丸组织以1:9的比例加入生理盐水,在冰水浴中制备组织匀浆,再以3 000 r·min-1离心10 min后取上清。
MDA含量及GST、GSH-Px和T-SOD的活力及总蛋白的测定,均按试剂盒说明书进行操作。
1.3.4睾丸组织病理学检查
实验大鼠左侧睾丸经10%中性福尔马林固定、石蜡包埋、4 μm切片、HE染色并于光学显微镜下观察。
石蜡包埋:体积分数为70%的乙醇,1 h→体积分数为90%的乙醇,1.5 h→体积分数为95%的乙醇Ⅰ,1 h→体积分数为95%的乙醇Ⅱ,1 h→100%乙醇Ⅰ,40 min→100%乙醇Ⅱ,1 h→100%乙醇Ⅲ,1 h→二甲苯Ⅰ,1 h→二甲苯Ⅱ,1 h→石蜡Ⅰ,58 ℃,1 h→石蜡Ⅱ,58 ℃,1 h→石蜡Ⅲ,58 ℃,1 h。
HE染色:二甲苯Ⅰ,10 min→二甲苯Ⅱ,10 min→无水乙醇Ⅰ,3 min→无水乙醇Ⅱ,2 min→体积分数为95%的乙醇,3 min→体积分数为80%的乙醇,3 min→自来水洗,2 min→苏木精染液,3 min→蒸馏水洗,1 min→体积分数为1%的盐酸乙醇分化,10 s→自来返兰,2 min→体积分数为1%的伊红染液,5 s→体积分数为80%的乙醇,5 s→体积分数为95%的乙醇,5 s→无水乙醇Ⅰ,2 min→无水乙醇Ⅱ,2 min→二甲苯Ⅰ,2 min→二甲苯Ⅱ,2 min→中性树胶封片。
1.4统计学方法
2 结果(Result)
2.1CPF对雄鼠体重和睾丸、附睾脏器系数的影响
各组动物染毒期间活动正常、反应灵敏、被毛光滑整洁,未见明显中毒症状。母鼠于围生期染毒CPF后对8周雄性子鼠体重和睾丸、附睾脏器系数的影响如表1所示。随着CPF染毒剂量的增加,子鼠体重(ANOVA:F=0.338,P=0.798)、睾丸脏器系数(ANOVA:F=1.591,P=0.214)和附睾脏器系数(ANOVA:F=2.007,P=0.126)呈现下降趋势,但差异无统计学意义。
2.2CPF对雄鼠睾丸组织氧化损伤指标的影响
2.2.1CPF对雄鼠睾丸组织MDA含量的影响
母鼠于GD 6~PND21 d暴露于CPF,对8周雄性子鼠睾丸组织MDA含量的影响无统计学意义(ANOVA:F=1.321,P=0.287),但随CPF染毒剂量的增加MDA含量有升高的趋势(如图1)。
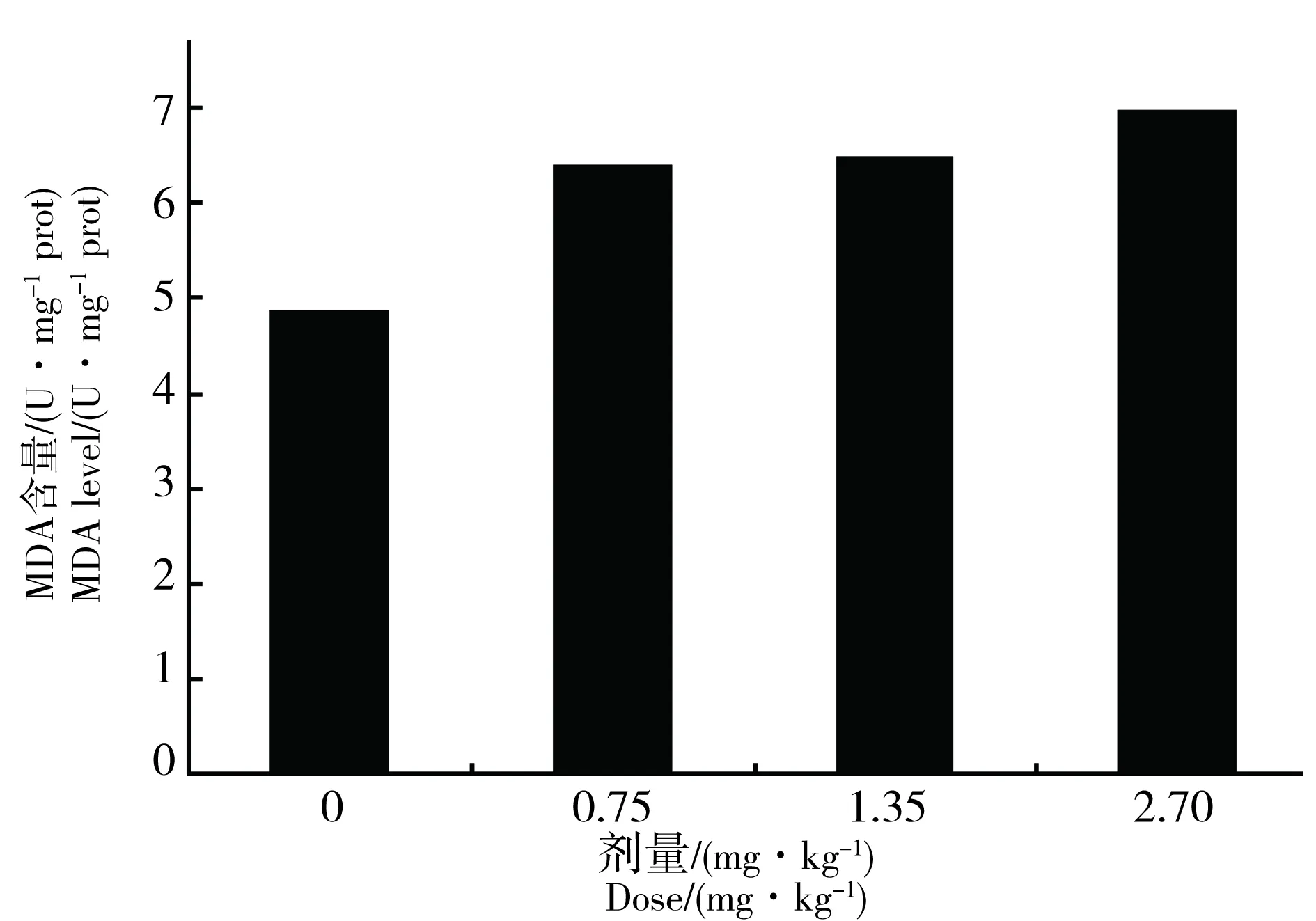
图1 围生期CPF暴露对8周雄性子鼠睾丸MDA的影响(n=8)Fig. 1 The influence of perinatal CPF exposure on testicular MDA level of 8 week offspring male rat (n=8)
2.2.2CPF对雄鼠睾丸组织GST活性的影响
母鼠围生期CPF暴露引起8周雄性子鼠睾丸GST酶活性的升高(ANOVA:F=6.563,P=0.002),但仅2.70 mg·kg-1剂量组酶活性的升高有统计学意义,并且各剂量组间的差异无统计学意义(P>0.05)。如表2所示。
表1 围生期毒死蜱(CPF)暴露对8周雄性子鼠体重和睾丸、附睾脏器系数的影响(x± s,n=8)
Table 1 The body weight, organ coefficient of testis and epididymis of 8 week offspring male rat after
perinatal exposure to chlorpyrifos (CPF) (x±s,n=8)

表1 围生期毒死蜱(CPF)暴露对8周雄性子鼠体重和睾丸、附睾脏器系数的影响(x± s,n=8)
组别Group体重/gBodyweight/g睾丸脏器系数/%Testicularorgancoefficient/%附睾脏器系数/%Epididymalorgancoefficient/%对照组Controlgroup235.600±10.2000.911±0.0580.187±0.008毒死蜱组CPFdosedgroup0.75mg·kg-1234.200±9.8000.870±0.0540.186±0.0301.35mg·kg-1231.900±8.9000.863±0.0650.174±0.0142.70mg·kg-1230.600±14.2000.860±0.0260.169±0.006
2.2.3CPF对雄鼠睾丸组织GSH-Px活性的影响
由表3可知,妊娠母鼠于GD 6~PND21 d暴露于CPF后,导致8周雄性子鼠睾丸组织GSH-Px活性的下降(ANOVA:F=351.363,P=0.000),1.35和2.70 mg·kg-1剂量组与对照组及0.75 mg·kg-1剂量组比,酶活性的下降有统计学意义。其余各组之间的差异无统计学意义(P>0.05)。
2.2.4CPF对雄鼠睾丸组织T-SOD活性的影响
母鼠围生期暴露于CPF后引起8周子鼠睾丸T-SOD活性的下降(ANOVA:F=6.162,P=0.002)。与对照组比较,CPF各剂量组酶活性的下降均有统计学意义(见表4);但各剂量组间酶活性的变化无统计学意义(P>0.05)。
2.3CPF对8周子鼠睾丸组织形态学的影响
睾丸生精小管各级生精细胞由外到内依次为精
表2 围生期CPF暴露对8周雄性子鼠睾丸GST活性
的影响(x± s,n=8)
Table 2 The effect of perinatal CPF exposure on testicular
GST activity of 8 week offspring male rat (x± s,n=8)
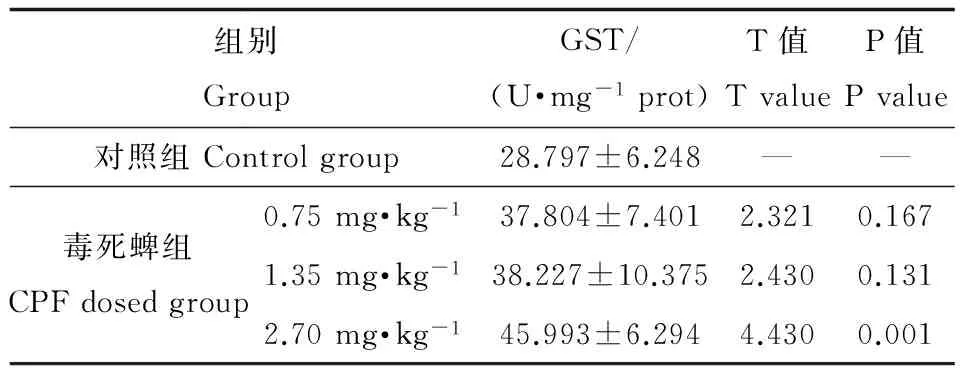
表2 围生期CPF暴露对8周雄性子鼠睾丸GST活性
组别GroupGST/(U·mg-1prot)T值TvalueP值Pvalue对照组Controlgroup28.797±6.248——毒死蜱组CPFdosedgroup0.75mg·kg-137.804±7.4012.3210.1671.35mg·kg-138.227±10.3752.4300.1312.70mg·kg-145.993±6.2944.4300.001
注:T值,与对照组比较的统计量值;P值,与对照组比较的P值。
Note:Tvalue, the statistical value compared with control group; P value, compared with the control group.
原细胞、初级精母细胞、次级精母细胞、精子细胞和精子。围生期CPF暴露后,8周子鼠睾丸组织病理切片显示,与对照组比较,2.70 mg·kg-1剂量组生精小管直径变小,各级生精细胞减少,管腔可见脱落的生精细胞,并且精液量有所下降。1.35 mg·kg-1剂量组腔内精子量减少,可见脱落的生精细胞;而0.75 mg·kg-1剂量组睾丸组织病理学变化不明显。如图2所示。
3 讨论(Discussion)
氧化应激和脂质过氧化作用是大多数组织细胞损伤的共同机制。在生理情况下,生物体内的氧自由基处于不断产生和清除的动态平衡状态。如果机体氧自由基的产生增多和/或清除能力下降,便会出现氧化应激。研究表明,有机磷农药能加剧机体的脂质过氧化作用[9-10];CPF也可扰乱机体的氧化还原平衡,导致氧化损伤[11]。本研究通过妊娠母鼠染毒CPF,检测对8周子鼠睾丸的抗氧化酶活力、脂质过氧化产物和睾丸组织病理学的影响,探讨围生期暴露于CPF后,对子代雄性生殖系统的潜在远期毒性
表4 围生期CPF暴露对8周雄性子鼠睾丸T-SOD
活性的影响(x±s,n=8)
Table 4 The effect of perinatal CPF exposure on testicular
T-SOD activity of 8 week offspring male rat (x± s,n=8)

表4 围生期CPF暴露对8周雄性子鼠睾丸T-SOD
组别GroupT-SOD/(U·mg-1prot)T值TvalueP值Pvalue对照组Controlgroup134.596±11.448——毒死蜱组CPFdosedgroup0.75mg·kg-198.742±10.2452.9420.0391.35mg·kg-190.584±19.3853.6110.0072.70mg·kg-188.767±42.0103.7600.005
注:T值,与对照组比较的统计量值;P值,与对照组比较的P值。Note:T value, the statistical value compared with control group; P value, compared with the control group.

表3 围生期CPF暴露对8周雄性子鼠睾丸GSH-Px活性的影响(x± s,n=8)
注:T值,与对照组及0.75 mg·kg-1组比较的统计量值;P值,与对照组及0.75 mg·kg-1组比较的P值。Note:T value, the statistical value compared with control group and 0.75 mg·kg-1group; P value, compared with the control group and 0.75 mg·kg-1group.
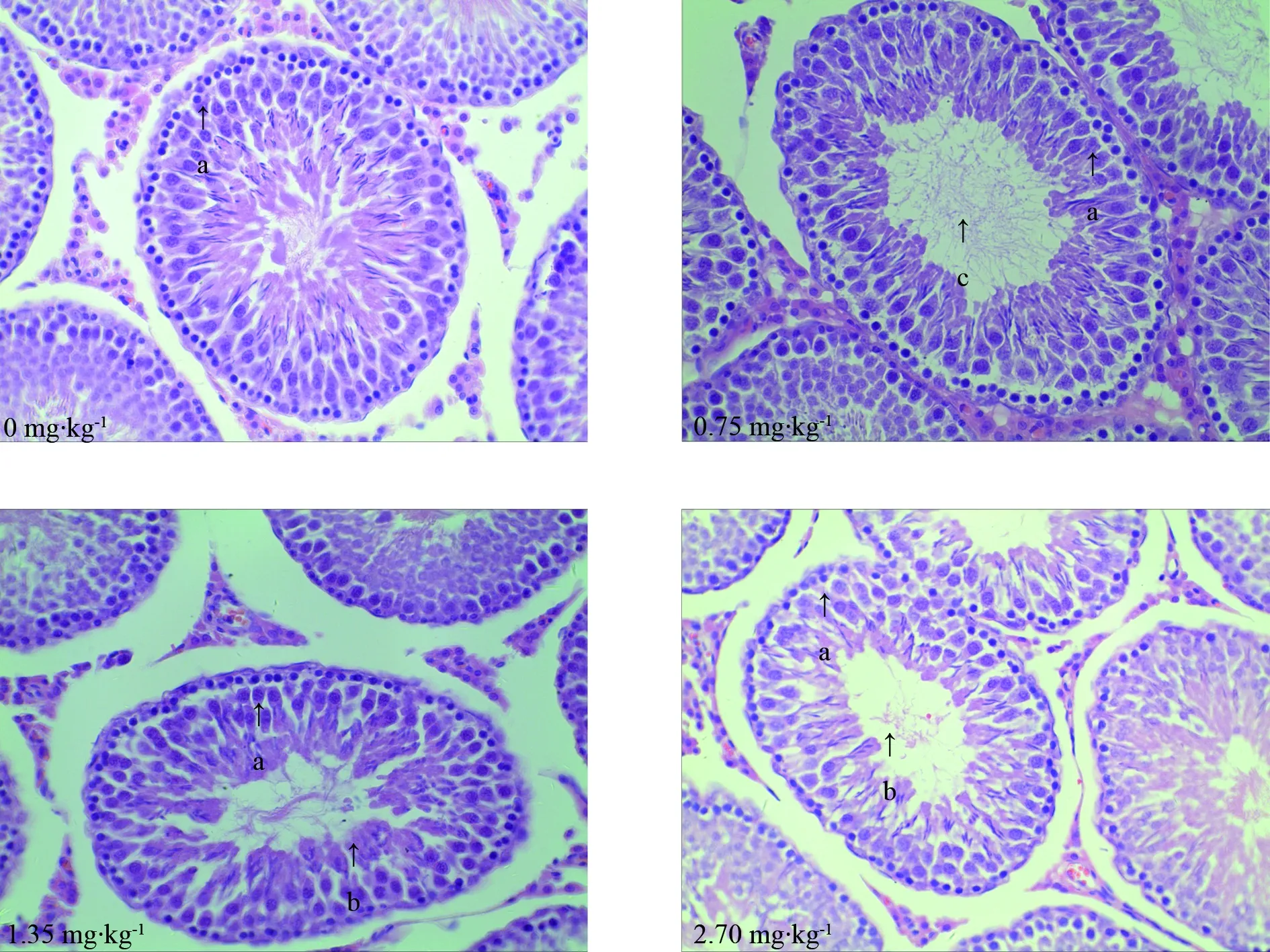
图2 围生期CPF暴露对8周雄性子鼠睾丸组织病理学的影响(HE 40×10) 注:a为精原细胞,b为脱落的精子细胞,c为精子。Fig. 2 The effect of perinatal CPF exposure on testicular histopathological of 8 week offspring male rat (HE 40×10)Note: a, spermatogonia; b, exfoliated sperm cell; c, sperm.
作用及其机制。
MDA是脂质过氧化作用的最终产物之一,具有强交联性,能与含游离氨基的蛋白质和核酸等交联,以干扰核酸、蛋白质和细胞的功能[12];其含量的多少可反映机体内脂质过氧化损伤的程度。本研究结果显示,CPF剂量组MDA含量升高,但与对照组比较差异无统计学意义,说明围生期暴露于CPF可导致8周子鼠睾丸组织的自由基增多,从而引起氧化损伤;但可能由于CPF的染毒剂量较低,并且是经母体染毒,所以MDA水平的变化不明显。
SOD和GSH-Px是机体广泛存在的抗氧化酶,SOD能清除超氧阴离子自由基,GSH-Px促进机体过氧化氢及脂质过氧化物的分解。而GST具有消除体内自由基和解毒的双重功能。雄性生精细胞膜上也存在多种抗氧化酶,并呈高水平表达[13],这些抗氧化酶可保证各级生精细胞在精子发生过程中的存活时间,消除细胞突变的潜在性[14],对生精细胞的分化与发育起着重要的抗氧化作用。如适量的SOD具有维持精子正常形态、活力和功能的作用[15];GSH-Px对精子的成熟、保持精子的完整性和受精能力方面具有重要作用[16],有研究报道,9 mg·kg-1的CPF可引起雄性大鼠睾丸组织脂质过氧化物(lipid peroxidation, LPO)水平增加1.79倍,SOD、GSH-Px和GST的活性分别下降27.75%、29.13%和11.52%[17]。本研究中与对照组比较,1.35、2.70 mg·kg-1剂量组睾丸GSH-Px和各剂量组睾丸T-SOD酶活性的下降均有统计学意义(P<0.05);而仅2.70 mg·kg-1剂量组睾丸GST酶活性的升高有统计学意义(P<0.05)。随染毒时间延长,体内产生的自由基和过氧化物不断积累,反过来可能影响SOD和GSH-Px活力,GSH-Px的巯基部位受到自由基的攻击,可能引起酶活性的下降。而GST是污染物在体内代谢相Ⅱ的重要酶之一,有研究表明,急性有机磷农药口服中毒患者血浆中GST酶活性有所升高[18]。本研究中GST的升高可能是由机体对CPF进行解毒过程的反馈调节引起的,其具体机制要有待于进一步研究。
本次研究显示CPF对体重影响不明显,与Suresh Joshi等[19]的报道一致。而以往关于CPF对雄性生殖器官脏器系数影响的研究尚未得出一致结论。刘相鑫[20]以2.7、5.4和12.8 mg·kg-1剂量的CPF对雄性大鼠连续染毒90 d,结果睾丸脏器系数的变化不明显, 而文一等[21]以7.35 mg·kg-1剂量CPF灌胃染毒8周后,雄性大鼠的睾丸脏器系数显著增加。在体重未变的情况下睾丸重量减轻,提示可能是睾丸内生殖细胞减少所致[22]。以往研究提示,CPF对实验动物体重和生殖器官脏器系数的影响可能与染毒途径、时间、剂量等有关。由此可以认为,本研究的染毒剂量水平不引起包括体重增长抑制、脏器系数改变等毒理学效应终点的变化。CPF可引起睾丸生精小管发生退行性变化、间质变宽、各级生精细胞减少及生精细胞脱落[23-24]。本研究中2.70 mg·kg-1CPF剂量组睾丸病理学检查表现出明显的生精细胞脱落增多,管腔中精液量减少。
WHO认为在21世纪影响人类生活和健康的主要疾病中,不孕不育症将成为仅次于肿瘤和心脑血管疾病的第三大疾病[25]。而环境污染是导致男性不育最主要的原因[26],我国是一个农业大国,农药是我国最大的有害环境因素之一。研究提示,有机磷农药对男性生殖内分泌系统有毒性作用,不仅引起精子质量下降,还可损伤精子的遗传物质[27-28]。CPF也具有一定的雄性生殖毒性,并且可能对雄性生殖系统产生潜在的远期毒性作用,甚至是终身的。因此有机磷农药CPF的雄性生殖毒性更应引起人们的重视。
通讯作者简介:戴红(1958-),女,生态学博士,教授,主要研究方向环境卫生学与毒理学。
肖瑞(1979-),女,博士研究生,教授,主要研究方向雄性不育机制。
[1]吉贵祥, 张涛, 范清华, 等. 某农药厂周边空气毒死蜱污染状况及健康风险评价[J]. 中国环境监测, 2014, 30(1): 6-9
Ji X G, Zhang T, Fan Q H, et al. Chlorpyrifos in the ambient air surrounding a pesticide factory and health risk assessment [J]. Environmental Monitoring in China, 2014, 30(1): 6-9 (in Chinese)
[3]许梅燕, 蔡胜茂, 高铭琪. 泉州地区蔬菜农药残留现状分析[J]. 福建农业科技, 2015(4): 14-16
Xu H Y, Cai S M, Gao M Q. Status of pesticide residues in vegetables of Quanzhou [J]. Fujian Agricultural Science and Technology, 2015(4): 14-16 (in Chinese)
[4]李艳芳, 叶渝霖, 徐匆, 等. 东莞市10种不同品牌绿茶中30种农药残留的检测[J]. 广东农业科学, 2015(3): 74-78
Li Y F, Ye Y L, Xu C, et al. Detection of 30 kinds of pesticide residues from 10 different brands of green tea from Dongguan market [J]. Guangdong Agricultural Sciences, 2015(3): 74-78 (in Chinese)
[5]郑立宏, 杨丹, 高晓勤. 有机磷农药对男性生育功能的影响[J]. 山东医药, 2014, 54(9): 23-24
Zheng L H, Yang D, Gao X Q. Influence of organophosphorus pesticide on male fertility [J]. Shandong Medical Journal, 2014, 54(9): 23-24 (in Chinese)
[6]Farag A T, Radwan A H, Sorour F, et al. Chlorpyrifos induced reproductive toxicity in male mice [J]. Reproductive Toxicology, 2010, 29(1): 80-85
[7]文一, 刘伟江, 赵康平, 等. 氧化乐果和毒死蜱混剂对大鼠雄性生殖功能的联合毒性[J]. 生态毒理学报, 2013, 8(6): 945-954
Wen Y, Liu W J, Zhao K P, et al. Combined reproductive toxicity effects of omethote and chlopyrifos on male rats [J]. Asian Journal of Ecotoxicology, 2013, 8(6): 945-954 (in Chinese)
[8]张国文, 汪佳蓉, 占春瑞, 等. 毒死蜱对DNA潜在损伤作用的研究[J]. 南昌大学学报, 2010, 32(1): 10-13
Zhang G W, Wang J R, Zhan C R, et al. Study of influences of chlorpyrifos on potential damage of DNA [J]. Journal of Nanchang University, 2010, 32(1): 10-13 (in Chinese)
[9]Dwivedi N, Bhutia Y D, Kumar V, et al. Effects of combined exposure to dichlorvos and monocrotophos on blood and brain biochemical variables in rats [J]. Human & Experimental Toxicology, 2010, 29(2): 121-129
[10]焦铭, 廖文莉, 孙雪, 等. 毒死蜱致小鼠肺细胞氧化损伤及维生素E的拮抗[J]. 环境与健康杂志, 2014, 31(2): 134-136
Jiao M, Liao W L, Sun X, et al. Oxidative damages induced bychlorpyrifos in lung cells of mice and antagonism of vitamin E [J]. Journal of Environment and Health, 2014, 31(2): 134-136 (in Chinese)
[11]Giordano G, Afsharinejad Z, Guizzetti M, et al. Organophosphorus insecticides chlorpyrifos and diazinon and oxidative stress in neuronal cells in a genetic model of glutathione deficiency [J]. Toxicology and Applied Pharmacology, 2007, 219(2-3): 181-189
[12]Doreswamy K, Shrilatha B, Rajeshkumar T, et al. Nickel-induced oxidative stress in testis of mice: Evidence of DNA damage and genotoxic effects [J]. Journal of Andrology, 2004, 25(6): 996-1003
[13]Rao A V, Shah Ca. Multiple glutathione S-transferase isoforms are present on male germ cell plasma membrane [J]. FEBS Letters, 2001, 507(2): 174-180
[14]Roveri A, Ursini F, Flohé L, et al. PHGPx and spermatogenesis [J]. BioFactors (Oxford, England), 2001, 14(1-4): 213-222
[15]朱林炜, 李丰隆, 何锦, 等. 稀释液中加SOD对猪精液常温保存效果的影响[J]. 中国畜牧杂志, 2015, 51(1): 24-27
Zhu L W, Li F L, He J, et al. Effect of SOD added in dilution on boar semen normal temperature preservation [J]. Chinese Journal of Animal Science, 2015, 51(1): 24-27 (in Chinese)
[16]Chabory E, Damon C, Lenoir A, et al. Epididymis seleno-independent glutathione peroxidase 5 maintains sperm DNA integrity in mice [J]. The Journal of Clinical Investigation, 2009, 119(7): 2074-2085
[17]Attia A A, ElMazoudy R H, El-Shenawy N S. Antioxidant role of propolis extract against oxidative damage of testicular tissue induced by insecticide chlorpyrifos in rats [J]. Pesticide Biochemistry and Physiology, 2012, 103(2): 87-93
[18]方伟钧, 李赵梅, 杨建新, 等. 急性有机磷农药口服中毒与自由基变化关系的初步探讨[J]. 中华急诊医学杂志, 2002, 11(4): 232-235
Fang W J, Li Z M, Yang J X, et al.Preliminary study on the relationship between acute organophosphorus pesticide poisoning through ingestion and changes of free radicals [J]. Journal of Emergenoy Medicine, 2002, 11(4): 232-235 (in Chinese)
[19]Joshi Suresh C, Mathur R, Gulati N. Testicular toxicity of chlorpyrifos (an organophosphate pesticide) in albino rat [J]. Toxicology and Industrial Health, 2007, 23(7): 439-444
[20]刘相鑫. 毒死蜱对雄性大鼠生殖毒性作用的研究[D]. 济南: 济南大学, 2010: 5-8
Liu X X. Study on the effects of chlorpyrifos on reproductive toxicology of male rats [D]. Jinan: University of Jinan, 2010: 5-8 (in Chinese)
[21]文一, 魏帅, 潘家荣. 毒死蜱对雄性大鼠生精功能的影响[J]. 农药, 2008, 47(8): 595-600
Wen Y, Wei S, Pan J R. Effect of chlorpyrifos on spermiogenesis function of male rats [J]. Agrochemicals, 2008, 47(8): 595-600 (in Chinese)
[22]Saumen K M, Anindita M. Testicular functions and serum titers of LH and testosterone in methyl parathion-fed roseringed parkeets [J]. Ecotoxicology and Environmental Safety, 2008, 71(10): 236-244
[23]Mathur N, Pandey G, Jain G C. Pesticides: A review of the male reproductive toxicity [J]. Journal of Herbal Medicine and Toxicology, 2010, 4(1): 1-8
[24]刘衍忠, 李兰波, 李相鑫, 等. 毒死蜱对大鼠生精功能和睾丸组织酶活力的影响[J]. 环境与健康杂志, 2011, 28(4): 311-313
Liu Y Z, Li L B, Li X X, et al. Effect of chlorpyrifos on spermatogenesis function enzymatic activity in male rats [J]. Journal of Environment and Health, 2011, 28(4): 311-313 (in Chinese)
[25]桑爱军, 俞承荣. 男性不育治疗指南[M]. 北京: 中国医药科技出版社, 2010: 序1
[26]李裕民, 韩云贤, 罗志彬. 男性不育与生活环境[J]. 中外医学研究, 2011, 9(32): 152-156
Li Y M, Han Y X, Luo Z B. Male infertility and living environment [J]. Chinese and Foreign Medical Research, 2011, 9(32): 152-156 (in Chinese)
[27]Perry M J. Effects of environmental and occupational pesticide exposure on human sperm: A systematic review [J]. Human Reproduction Update, 2008, 14(3): 233-242
[28]Zhang S Y, Ito Y, Yamanoshita O, et al. Permethrin may disrupt testosterone biosynthesis via mitochondrial membrane damage of Leydig cells in adult male mouse [J]. Endocrinology, 2007, 148(8): 3941-3949
◆
Perinatal Exposure to Chlorpyrifos Induced Testicular Oxidative Damage in 8 Week Offspring Male Rat
Xu Xiaoqian1, Zhang Min1,Wang Xuemei1, Fang Xin1, Li Hailing1, Dai Hong1,*, Xiao Rui1,#
Inner Mongolia Medical University, Hohhot 010010, China
23 June 2015accepted 31 August 2015
Chlorpyrifos is one of the largest used and saled organophosphorus pesticides throughout the world. To explore the testicular oxidative damage of 8 week offspring male rat induced by perinatal exposure to chlorpyrifos, the healthy pregnant Wistar female rats were exposed to chlorpyrifos of 0, 0.75, 1.35 and 2.70 mg·kg-1by gavage during GD 6—PND21 d. Until the offspring male rat reached the age of 8 week, histopathological changes of left testis were observed. We also detected the level of MDA and the activity of GST, GSH-Px, and T-SOD in right testis. The results showed that although no statistical significance were observed in body weight, the organ coefficient of testis and epididymis compared with control group, both of them showed a downward trend and of MDA showed an upward trend when the dose increased (P>0.05). The decrease in the activity of T-SOD of all dose groups, the increase of the activity of GSH-Px of 1.35 mg·kg-1and 2.70 mg·kg-1dose groups and the increase in activity of GST of 2.70 mg·kg-1dose group were statistically significant (P<0.05). The histopathological examination indicated that the testis of 2.70 mg·kg-1dose group had significant damage. It is found that the semen volume was reduced and exfoliated spermatogenic cell was increased. Chlorpyrifos impaired the balance of antioxidant system, thus induced lipid peroxidation damage to the testis of 8 week rat by maternal exposure during GD 6—PND21 d. It is proposed that chlorpyrifos had potential and long-term toxic effect to male reproductive system by perinatal exposure.
chlorpyrifos; rat; oxidative damage; testis; offspring; perinatal exposure
内蒙古医科大学博士课题启动基金(ykd12bq01)
徐肖倩(1986-),女,硕士,研究方向为环境毒理学,E-mail: xxq20100@163.com;
Corresponding author), E-mail: bennidai@aliyun.com;
# 共同通讯作者(Co-corresponding author),E-mail: 1426954814@qq.com
10.7524/AJE.1673-5897.20150623002
2015-06-23 录用日期:2015-08-31
1673-5897(2015)6-159-07
X171.5
A
徐肖倩, 张敏, 王学梅, 等. 围生期毒死蜱暴露致子代8周雄鼠睾丸组织的氧化损伤[J]. 生态毒理学报,2015, 10(6): 159-165
Xu X Q, Zhang M, Wang X M, et al. Perinatal exposure to chlorpyrifos induced testicular oxidative damage in 8 week offspring male rat [J]. Asian Journal of Ecotoxicology, 2015, 10(6): 159-165 (in Chinese)

