芹菜素对丙烯腈引起大鼠精子脂质过氧化和DNA损伤的影响
陈军义,赵乾龙,张洁,常锐霞,赵晓非,党瑜慧,李芝兰
兰州大学公共卫生学院,兰州 730000
芹菜素对丙烯腈引起大鼠精子脂质过氧化和DNA损伤的影响
陈军义,赵乾龙,张洁,常锐霞,赵晓非,党瑜慧,李芝兰*
兰州大学公共卫生学院,兰州 730000
分析芹菜素(apigenin, AP)对丙烯腈(acrylonitrile, ACN)引起的大鼠精子脂质过氧化和DNA损伤的影响,并探讨其可能的机制。将50只SPF级SD成年雄性大鼠随机分为阴性对照组(玉米油)、ACN组(50 mg·kg-1ACN)、低AP组(50 mg·kg-1ACN+234 mg·kg-1AP)、高AP组(50 mg·kg-1ACN+468 mg·kg-1AP)、N-乙酰半胱氨酸(N-acetylcysteine, NAC)组(50 mg·kg-1ACN+300 mg·kg-1NAC),以5 mL·(kg bw)-1灌胃染毒,1次·d-1,6 d·周-1,连续13周。检测大鼠精子活性氧(ROS)、丙二醛(MDA)含量、超氧化物歧化酶(SOD)活性以及精子DNA损伤情况。结果发现,ACN组、低AP组、高AP组、NAC组精子ROS、MDA含量显著升高,SOD活力显著降低,精子尾部DNA含量百分比、尾长、尾距、Olive尾距均显著增高于对照组(均P < 0.05);而低AP组、高AP组、NAC组精子ROS、MDA含量、SOD活性和精子DNA损伤情况与ACN组相比差异均无统计学意义(P > 0.05)。提示ACN可引起大鼠精子脂质过氧化和DNA损伤,而AP、NAC对其无干预作用。
芹菜素;丙烯腈;精子;大鼠;脂质过氧化;DNA损伤;彗星实验
芹菜素(apigenin, AP)为一种具有广泛生物学作用的黄酮类化合物,存在于蔬菜、水果、豆类和茶叶等中,其中芹菜中含量最高。其化学结构为4’,5,7-三羟基黄酮,特殊的结构决定了其抗氧化、抗肿瘤、降压、镇静等多种生物学作用。AP抗氧化作用的结构基础首先是4’、5、7位置的羟基可以结合自由基,其次是5、7位的羟基可以络合金属离子,且7位羟基具有很强的酸性,同时2、3位的双键起到稳定作用[1]。AP的抗氧化作用机制可能表现为对超氧阴离子及脂质过氧化物的清除,与铁和铜等金属离子螯合,抑制NO的生成,抑制细胞核内DNA的氧化损伤等方面[2-5]。有研究报道AP可显著降低雄性大鼠肝主要的抗氧化酶活性,234、468、936 mg·kg-1的AP在不同的脏器中可表现为促氧化/抗氧化作用,可能是在不同细胞内的代谢方式影响了其生物学作用[6-8],其中234、468 mg·kg-1的AP对大鼠睾丸组织中表现为抗氧化作用。
丙烯腈(acrylonitrile, ACN)又称乙烯基氰,是一种广泛应用于合成腈纶纤维、丁腈橡胶、合成树脂等的有机合成单体,也可用于食品包装及医用材料如高渗透性渗析管、义肢、胰岛移植膜等,是重要的环境污染物之一。目前,除职业性接触以外一般人群通过生活用品的潜在接触越来越引起关注。ACN毒性作用广泛,急性毒性主要表现为非特异性的中枢神经系统、胃肠道、肾上腺等症状,严重者可因呼吸衰竭而死亡;其作用机制主要表现为以下3个方面:一是代谢过程中产生的CN-直接作用于机体所致,二是ACN与组织蛋白结合而损伤其功能,三是组织中谷胱甘肽(GSH)的耗竭使组织受到脂质过氧化的损伤[9]。流行病学研究显示,ACN慢性接触可表现为头晕、头痛、失眠等神经系统症状,也可引起心率、血压、脉压等的升高,;接触组中眼病、呕吐及皮肤干燥的发生率也明显增高[10-11]。除一般毒性外,动物实验研究表明ACN具有潜在的致癌性,实验组大鼠脑癌、肺癌、胃癌的发生率显著增高[12],但流行病学资料显示ACN接触工人肺癌、脑肿瘤、前列腺癌发生率的升高无统计学意义,膀胱癌的发生率升高与ACN接触史无关[13]。由于缺乏强有力的证据,1999年国际癌症研究机构(IARC)将ACN的致癌性由2A降为2B类。目前,ACN的生殖毒性也引起了人们的关注。动物实验研究表明,ACN具有雄性生殖毒性[14],可引起动物睾丸脂质过氧酶活性的改变,打破氧化还原反应平衡,也可导致睾丸支持细胞、间质细胞损伤,改变生精细胞DNA含量及细胞周期[15],导致精子畸形率的升高[16],对小鼠精细胞DNA产生交联和断裂作用[17]。同时ACN可引起接触男工精子DNA链的断裂和性染色体非整倍体[18]。N-乙酰半胱氨酸(N-acetylcysteine, NAC)是一种抗氧化剂,对多种物质引起的氧化损伤和DNA损伤具有保护作用。因此本实验通过分析NAC和AP对ACN引起雄性大鼠精子脂质过氧化的影响,研究AP的抗氧化作用,为AP的开发利用提供参考依据。
1 材料与方法(Materials and methods)
1.1实验对象
SPF级成年健康雄性SD大鼠50只,体重250~300 g,由甘肃中医学院医学实验动物中心提供,动物合格证号:SCXK(甘)2011-0001。大鼠饲养于甘肃中医学院医学动物实验中心,实验室合格证号:SYXK(甘)2011-0001,大鼠自由饮水进食。
1.2主要试剂及仪器
ACN(分析纯,纯度>99%)购于天津四通化工厂;AP(纯度98.23%),购于陕西慧科植物有限公司;NAC(纯度≥99.9%),购于美国Amresco公司。活性氧(ROS)、丙二醛(MDA)、超氧化物歧化酶(SOD)试剂盒均购于南京建成生物工程研究所。主要仪器:流式细胞仪(美国Becton,Dichinson and Company公司,型号LSRFortessa);离心机(美国Beckman coulter公司,型号Microfuge 22R Centrifuge);723N分光光度计(上海精密科学仪器有限公司);酶标仪(美国BioTek公司,型号EONC);电泳仪(美国Bio-Rad公司,型号Power Basic);JA3003N电子秤(上海精密科学仪器有限公司);DK-600S型三用恒温水浴箱(上海精宏实验设备有限公司)。
1.3实验方法
大鼠适应性饲养1周后,按体重随机分为5组,每组10只:阴性对照组(玉米油)、ACN组(50 mg·kg-1ACN)、低AP组(50 mg·kg-1ACN+234 mg·kg-1AP)、高AP组(50 mg·kg-1ACN+468 mg·kg-1AP)、NAC组(50 mg·kg-1ACN+300 mg·kg-1NAC)。ACN和AP用玉米油配制成所需剂量,NAC用生理盐水配置成所需剂量,按5 mL·kg-1灌胃量灌胃染毒,1次·d-1,6 d·周-1,连续染毒13周;每隔3 d称重调整灌胃量。联合染毒组先分别灌胃AP、NAC,30 min后灌胃ACN。于灌胃后30 min内观察大鼠行为变化。末次染毒24 h后称量体重,每组随机选取6只大鼠用颈椎脱臼法处死,摘取左侧附睾,放入盛有3 mL的37 ℃的PBS液的离心管中,用眼科剪剪碎附睾,37 ℃水浴15 min让精子游出,200目尼龙筛网过滤制备精子悬液。
1.4精子MDA、SOD检测
调整精子浓度为106·mL-1的精子悬液,按试剂盒说明书进行。
1.5精子ROS检测
调整精子悬液精子浓度为106·mL-1,将490 μL精子悬液加入1:499(V:V)稀释的DCFH-DA荧光分子探针10 μL中,37 ℃孵育40 min,PBS液冲洗2次(2 000 r·min-1,4 min,4 ℃),流式细胞术检测其荧光强度(激发波长488 nm,发射波长526 nm),每个样本检测10 000个细胞,分析其ROS水平。
1.6精子单细胞凝胶电泳
首先将35 μL正常熔点琼脂糖溶液均匀铺于用体积分数为95%的乙醇浸泡过夜的磨砂载玻片并放置在4 ℃共10 min。然后在已铺好的底胶上加50 μL精子单细胞悬浮液,并迅速加100 μL低熔点琼脂糖溶液,混匀并迅速盖上盖玻片,4 ℃冷凝10 min。取掉盖玻片,加入裂解液后在4 ℃裂解1 h。裂解结束后浸于4 ℃去离子水中,4 ℃冰箱中静置5 min,将玻片转移至电泳槽中,缓缓注入4 ℃预冷的电泳缓冲液,液面没过玻片表面5 mm左右解旋20 min。在电流300 mA条件下避光电泳20 min后移至中和液中至没过玻片,4 ℃中和15 min,然后用5 μg·mL-1的碘化丙啶(PI)避光染色20 min。去离子水脱色15 min后荧光显微镜观察,绿光激发,观察倍数目镜10×,物镜40×,拍照保存。
1.7精子单细胞凝胶电泳图像分析
用彗星图像分析软件CASP(comet assay software project)对精子单细胞凝胶电泳图像进行分析,每个剂量组分析200个精子细胞。用尾部DNA含量百分比(tail DNA100%)、尾长(tail length)、尾距(tail moment)、Olive尾距(Olive tail moment)作为衡量精子DNA损伤的指标。
1.8统计学方法
2 结果(Results)
2.1AP对ACN引起大鼠行为及体重的影响
染毒前各剂量组大鼠体重差异无统计学意义(P > 0.05),染毒过程中各剂量组大鼠体重增长趋势大致相同,但各时间点体重差异均无统计学意义(P > 0.05),见图1。
实验过程中未出现大鼠死亡,ACN组大鼠从染毒第6周后出现流涎、躁动、易激惹等行为表现,其他各组均未见明显异常。

图1 染毒期间各剂量组大鼠体重变化情况 注:ACN、AP、NAC表示丙烯腈、芹菜素、N-乙酰半胱氨酸。Fig. 1 The weight changes of rats in all dosage groups during the period of exposure Note: ACN, AP, NAC stand for acrylonitrile, apigenin, and N-acetylcysteine.
2.2ACN对大鼠精子ROS、SOD、MDA的影响
由表1可知,ACN组大鼠精子ROS、MDA水平均显著升高,与对照组相比差异有统计学意义(P < 0.05);ACN组大鼠精子SOD低于对照组,差异有统计学意义(P < 0.05)。
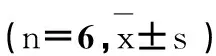
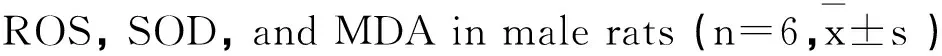

组别GroupROS/MFI#MDA/(nmol·mg-1prot)SOD/(U·mg-1prot)对照组Control454.33±260.327.65±2.1273.34±16.49ACN组ACN50mg·kg-11458.33±366.83*11.07±2.92*46.87±6.20*低AP组AP234mg·kg-11351.23±192.81*10.36±3.61*47.72±4.84*高AP组AP468mg·kg-11330.33±525.94*11.27±1.44*47.21±9.73*NAC组NAC300mg·kg-11371.67±565.06*10.11±2.14*54.48±5.30*
注:对照组相比,*P < 0.05;#MFI,平均荧光强度。
Note: Compared with control,*P < 0.05;#MFI, means fluorescence intensity.
2.3AP对ACN引起大鼠精子ROS、SOD、MDA改变的影响
由表1可见,低AP组、高AP组和NAC组大鼠精子ROS水平明显升高,与对照组相比差异有统计学意义(P < 0.05)。低AP组、高AP组和NAC组大鼠精子SOD均明显低于对照组,差异有统计学意义(P < 0.05),但低AP组、高AP组和NAC组大鼠精子SOD与ACN组相比差异无统计学意义(P > 0.05)。精子MDA含量在低AP组、高AP组和NAC组均明显高于对照组,差异有统计学意义(P < 0.05),但低AP组、高AP组和NAC组大鼠精子SOD与ACN组相比差异无统计学意义(P > 0.05)。低AP组、高AP组和NAC组大鼠精子ROS、MDA、SOD水平与ACN组相比差异均无统计学意义(P > 0.05)。
2.4AP对ACN引起大鼠精子DNA损伤的影响
如表2所示,ACN可导致大鼠精子彗星尾部DNA百分比含量、尾长、尾距、Olive尾距均增高,与对照组相比差异均有统计学意义(P < 0.05或P < 0.01)。低AP组、高AP组和NAC组大鼠精子彗星尾部DNA百分比含量、尾长、尾距、Olive尾距均增高,与对照组相比差异均有统计学意义(P < 0.05或P < 0.01),但与ACN组相比差异无统计学意义(P > 0.05)。
3 讨论(Discussion)
ROS是一类氧的代谢产物及其衍生物,其化学性质比氧更为活泼,主要包括超氧阴离子(·O2-)、过氧化氢(H2O2)、羟自由基(·OH)等。精子ROS的产生主要有3种方式:①精子质膜NADPH(还原型辅酶II)-氧化酶体系;②线粒体NADH(还原型辅酶I)依赖的氧化还原酶体系;③12-肉豆蔻酸盐-13-乙酸盐-phorbol酯(PMA)诱导精子生成ROS[19]。其中线粒体途径是精子ROS生成的主要途径。生理情况下,适量的ROS对维持精子正常的功能具有重要的意义,但精子缺乏胞质抗氧化酶系统,因此过量的ROS会对精子产生重要的影响,主要表现为精子质膜、精子线粒体和精子DNA的损伤。过量的ROS对精子质膜的影响主要表现为通过引发精子膜上的
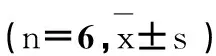
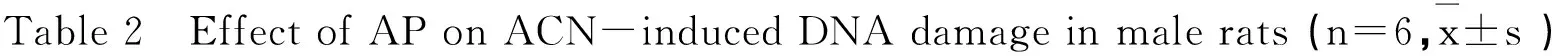
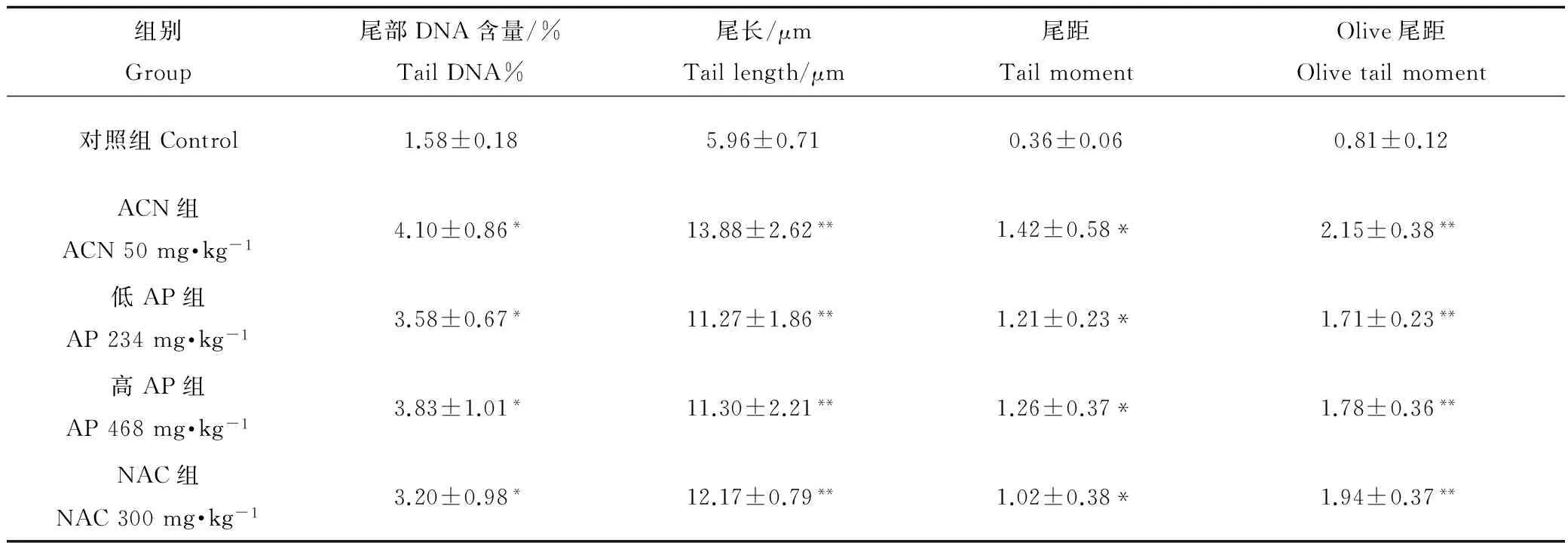
组别Group尾部DNA含量/%TailDNA%尾长/μmTaillength/μm尾距TailmomentOlive尾距Olivetailmoment对照组Control1.58±0.185.96±0.710.36±0.060.81±0.12ACN组ACN50mg·kg-14.10±0.86*13.88±2.62**1.42±0.58*2.15±0.38**低AP组AP234mg·kg-13.58±0.67*11.27±1.86**1.21±0.23*1.71±0.23**高AP组AP468mg·kg-13.83±1.01*11.30±2.21**1.26±0.37*1.78±0.36**NAC组NAC300mg·kg-13.20±0.98*12.17±0.79**1.02±0.38*1.94±0.37**
注:与对照组相比,*P<0.05,**P<0.01。
Note: Compard with control, *P < 0.05, **P < 0.01.
多聚不饱和脂肪酸的过氧化反应产生大量脂类过氧化物。MDA是不饱和脂肪酸代谢终产物之一,其生成量可间接反应精子膜的脂类过氧化程度。SOD是细胞中重要的抗氧化酶之一,在机体清除氧自由基的过程中起着关键作用。ROS可以直接攻击SOD生成过氧化氢,而高浓度的过氧化氢会破坏SOD的结构,使酶活性下降。
ACN能抑制抗氧化酶活性使机体抗氧化系统下降从而引起氧化应激,而ROS的增加是其可能的氧化应激机制[20]。ACN可引起大鼠睾丸组织SOD活性降低、MDA含量的增加。AP能够直接清除自由基,螯合过渡态金属离子Fe2+、Cu2+等以及抑制一氧化氮(NO)的生成,从而降低·OH的合成,最终使MDA的生成减少[2]。NAC是半胱氨酸的衍生物,是谷胱甘肽的前体,能合成具有生物活性的谷胱甘肽,具有抗氧化和清除自由基的作用[21]。有研究显示,15 nmol·L-1的NAC可显著提高5 ℃液态保存24 h后鸡精子活力、精子直线运动速度、曲线运动速度、平均路径速度等精子运动参数[22]。同时,给先天性不育症患者口服600 mg·d-1的NAC可显著提高精子总抗氧化能力[23]。因此本研究以NAC作为阳性对照,研究AP的抗氧化作用。结果显示,ACN组、低AP组、高AP组和NAC组大鼠精子ROS水平显著高于对照组,SOD活力显著降低,MDA含量显著升高。提示ACN可影响大鼠精子氧化还原平衡体系,而低AP组、高AP组和NAC组大鼠精子ROS水平、SOD活力与ACN组相比差异无统计学意义,提示在本实验条件下,300 mg·kg-1的NAC未能影响ACN造成的大鼠精子氧化损伤,而Esmat等[24]学者发现5.0 mmol·L-1的NAC对干预ACN引起的大鼠主神经胶质细胞的氧化损伤具有重要的作用,但Carrera 等[25]研究显示20 nmol·L-1的NAC不能抵抗ACN引起的大鼠神经胶质细胞的氧化损伤。本研究结果显示,234、468 mg·kg-1剂量的AP对50 mg·kg-1的ACN造成的大鼠精子氧化还原平衡的影响也没有干预作用。因此,在本实验条件下,NAC、AP均不能对ACN引起的大鼠精子ROS的产生、SOD活性的降低产生影响,未显示其抗氧化功效。
单细胞凝胶电泳技术(single cell gel eletrophoresis, SCGE)是一种快速检测单细胞DNA完整性的实验技术,因其细胞电泳形态似彗星,又称彗星实验(comet assay)。ACN进入体内可与DNA烷化共价结合,且其释放的CN-促进了ACN的毒性作用,同时由于氧自由基过多和抗氧化酶的平衡失调导致ROS过多,会造成精子DNA单链和双链的断裂[26-28]。本研究结果显示,ACN组大鼠精子彗星尾部DNA百分含量、尾长、尾距、Olive尾距均高于对照组,提示在本实验条件下ACN同样造成了大鼠精子DNA的损伤。抗氧化剂NAC对多种物质引起的DNA损伤具有一定的保护作用。赵珺等[29]体外实验研究发现低剂量的AP能有效清除·OH及其所引发的DNA损伤程度,或延迟其受损时间。实验结果因此表明AP对·OH有清除作用,从而能抑制·OH对DNA的氧化损伤。本实验结果显示,低AP组、高AP组、NAC组大鼠精子彗星尾部DNA百分含量、尾长、尾距、Olive尾距与ACN组相比差异均无统计学意义,提示在本实验条件下,未发现234、468 mg·kg-1AP和300 mg·kg-1NAC对ACN引起的大鼠精子DNA损伤有干预作用。
综上所述,在本实验条件下,50 mg·kg-1ACN可造成大鼠精子氧化还原平衡的破坏,精子ROS、MDA含量升高、SOD活性降低,且可引起大鼠精子DNA的损伤。234、468 mg·kg-1AP和300 mg·kg-1NAC对ACN引起的大鼠精子氧化损伤、DNA损伤无保护作用。
致谢:感谢兰州大学公共卫生学院王晓霞副教授在文章修改中给予的帮助。
通讯作者简介:李芝兰(1962-),女,硕士研究生导师,教授,兰州大学公共卫生学院儿少卫生与妇幼保健学研究所所长,研究方向为妇女劳动卫生与生殖健康。
[1]孙秀琴, 李荣华, 唐涛. 芹菜素抗氧化作用研究进展[J]. 中国现代医生, 2009, 47(27): 34-35
Sun X Q, Li R H, Tang T. Pregress in research on antioxidant effect of apigenin [J]. China Modern Doctor, 2009, 47(27): 34-35 (in Chinese)
[2]Topçu G, Ay M, Bilici A, et al. A new flavone from antioxidant extracts of Pistacia terebinthus [J]. Food Chemistry, 2007, 103(3): 816-822
[4]Liang Y C, Huang Y T, Tsai S H, et al. Suppression of inducible cyclooxygenase and inducible nitric oxide synthase by apigenin and related flavonoids in mouse macrophages [J]. Carcinogenesis, 1999, 20(10): 1945-1952
[5]Kanazawa K, Uehara M, Yanagitani H, et al. Bioavailable flavonoid to suppress the formation of 8-OHdG in HepG2 cells [J]. Archives of Biochemistry and Biophysics, 2006, 455(2): 197-203
[6]隋海霞, 徐海滨, 荫士安. 大剂量芹菜素对大鼠抗氧化酶活性及DNA损伤影响的研究[J]. 卫生研究, 2009, 38(1): 36-38
Sui H X, Xu H B, Yin S A. Effect of high dose apigenin on antioxidase activity and DNA damage in rats [J]. Journal of Hygiene Research, 2009, 38(1): 36-38 (in Chinese)
[7]Spencer J P, Abd-el-Mohsen M M, Rice-Evans C. Cellular uptake and metabolism of flavonoids and their metabolits: Implications for their bioactivity [J]. Archives of Biochemistry and Biophysics, 2004, 423(1): 148-161
[8]刘玲飞, 陈文材, 刘佳微, 等. 芹菜素处理雄性大鼠肝、脑、睾丸、肾和血清某些生化指标的变化[J]. 毒理学杂志, 2014, 28(3): 227-230
Liu L F, Chen W C, Liu J W, et al. Effect of apigenin onliver, brain, testis, kidney and serum biochemical indexes in male rats [J]. Journal of Toxicology, 2014, 28(3): 227-230 (in Chinese)
[9]陈亚, 李福轮, 马国燕, 等. 丙烯腈对小鼠精液运动参数的影响[J]. 生态毒理学报, 2010, 5(5): 711-717
Chen Y, Li F L, Ma G Y, et al. Effects ofacrylonitrile on sperm motility in male mice [J]. Asian Journal of Ecotoxicology, 2010, 5(5): 711-717 (in Chinese)
[10]Muto T, Sakurai H, Omae K, et al. Health profiles of workers exposed to acrylonitrile [J]. The Keio Journal of Medicine, 1992, 41(3): 154-160
[11]杨艳红, 赵振波, 陈巍, 等. 丙烯腈对作业人群健康影响的调查[J].深圳中西医结合杂志, 2003, 13(2): 122-124
Yang Y H, Zhao Z B, Chen W, et al. Investigation on healthy effect in acrylonitrile workers [J]. Shenzhen Journal of Integrated Traditional Chinese and Western Medicine, 2003, 13(2): 122-124 (in Chinese)
[12]Maltoni C, Ciliberti A, Cotti G, et al. Long-term carcinogenicity bioassays on acrylonitrile administered by inhalation and by ingestion to Sprague-Dawley rats [J]. Annals of the New York Academy of Sciences, 1988, 534(1): 179-202
[13]Collins J J, Acquavella J F. Review and meta-analysis of studies of acrylonitrile workers [J]. Scandinavian Journal of Work, Environment and Health, 1998, 24(s2): 71-80
[14]Tandon R, Saxena D K, Chandra S V, et al. Testicular effects of acrylonitrile in mice [J]. Toxicology Letters, 1988, 42(1): 55-63
[15]刘小宁, 肖卫, 王振全, 等. 丙烯腈对小鼠生精过程的影响[J]. 卫生研究, 2004, 33(3): 345-347
Liu X N, Xiao W, Wang Z Q, et al. Effect of acrylonitrile on the spermatogenesis in mice [J]. Jouranl of Hygiene Research, 2004, 33(3): 345-347 (in Chinese)
[16]薛红丽, 党瑜慧, 陈亚, 等. 丙烯腈对小鼠睾丸组织结构及精子质量的影响[J]. 毒理学杂志, 2014, 28(6): 454-456
Xue H L, Dang Y H, Chen Y, et al. Effect of acrylonitrile on the testicular tissue structure and sperm quality in mice [J]. Journal of Toxicology, 2014, 28(6): 454-456 (in Chinese)
[17]徐德祥, Shen Han-min, Ong Chun-nan. 单细胞电泳试验检测接触丙烯腈男工精子DNA双链断裂[J]. 疾病控制杂志, 1999, 19(3): 174-176
Xue D X, Shen Han-min, Ong Chun-nan. Detection of acrylonitrile-induced DNA double strand breakage in ACN-exposed workers’ sperm using single cell gel electrophoresis [J]. Chinese Journal of Disease Control and Prevention, 1999, 19(3): 174-176 (in Chinese)
[18]Xu D X, Zhu Q X, Zheng L K, et al. Exposure to acrylonitrile induced DNA strand breakage and sex chromosome aneuploidy in human spermatozoa [J]. Mutation Research, 2003, 537(1): 93-100
[19]Aitken R J, Fisher H M, Fulton N, et al. Reactive oxygen species generation by human spermatozoa is induced by exogenous NADPH and inhibited by the flavoprotein inhibitors diphenylene iodonium and quinacrine [J]. Molecular Reproduction and Development, 1997, 47(4): 468-482
[20]Zhang H, Kamendulis L M, Klaunig J E. Mechanisms for the induction of oxidative stress in syrian hamster embryo cells by acrylonitrile [J]. Toxicological Sciences: An Official Journal of the Society of Toxicology, 2002, 67(2): 247-255
[21]Gillissen A, Scharling B, Jaworska M, et al. Oxidant scavenger function of ambroxol in vitro: A comparison with N-acetyleysteine [J]. Research in Experimental Medicine, 1997, 196(6): 389-393
[23]Ciftci H, Verit A, Savas M, et al. Effects of N-acetylcysteine on semen parameters and oxidative/antioxidant status [J]. Urology, 2009, 74(1): 73-76
[24]Esmat A, El-Demerdash E, El-Mesallamy H, et al. Toxicity and oxidative stress of acrylonitrile in rat primary glial cells: Preventive effects of N-acetylcysteine [J]. Toxicology Letters, 2007, 171(3): 111-118
[25]Carrera M P, Antolín I, Martín V, et al. Antioxidants do not prevent acrylonitrile-induced toxicity [J]. Toxicology Letters, 2007, 169(3): 236-244
[26]Youn Y Y, Choe J C, Kim M S. Discovery of long-lived excited electronic states of vinylchloride, vinylbromide, vinyliodide and acrylonitrilecations [J]. Journal of the American for Mass Spectrometry, 2003, 14(2): 110-116
[27]Kamendulis L M, Jiang J, Xu Y, et al. Induction of oxidative stress and oxidative damage in rat glial cells by acrylonitrile [J]. Carcinogenesis, 1999, 20(8): 1555-1560
[28]芦冉. 3,4-二氯苯胺对雄性大鼠生殖系统的毒性效应[D]. 北京: 首都师范大学, 2008: 25-29
Lu R. The toxic effects of 3,4-dichloroaniline on the reproductive system of male rat [D]. Beijing: Capital Normal University, 2008: 25-29 (in Chinese)
[29]赵珺, 王丽, 李磊, 等. 芹菜素对自由基致DNA损伤的保护作用及机制[J]. 食品科学, 2011, 32(13): 1-4
Zhao J, Wang L, Li L, et al. Protective effect and mechanisms of apigenin against free radical-induced DNA damage [J]. Food Science, 2011, 32(13): 1-4 (in Chinese)
◆
Effect of Apigenin on Acrylontrile-Induced Lipid Peroxidation and DNA Damage in Sperm of Male Rats
Chen Junyi, Zhao Qianlong, Zhang Jie, Chang Ruixia, Zhao Xiaofei, Dang Yuhui, Li Zhilan*
School of Public Health, Lanzhou University, Lanzhou 730000, China
1 June 2015accepted 28 July 2015
In this study, the effect of apigenin (AP) on acrylontrile-(ACN) induced lipid peroxidation and DNA damage of sperm in male rats were examined and the possible mechanisms were discussed. 50 healthy adult male Sprague-Dawley rats were randomly divided into five groups: control group (corn oil), ACN group (50 mg·kg-1ACN), low-dose AP group (50 mg·kg-1ACN+234 mg·kg-1AP), high-dose AP group (50 mg·kg-1ACN+468 mg·kg-1AP) and NAC group (50 mg·kg-1ACN+300 mg·kg-1NAC). The rats were intragastrically administered daily with 5 mL·kg-1(boby weight) for 13 weeks, 6 days per week. The sperm samples were collected for the determination of the content of reactive oxygen species (ROS) and malondialdehyde (MDA), the activity of superoxide dismutase (SOD), and the DNA damage. The result showed in comparison with control group, the contents of ROS and MDA, the tail DNA%, tail length, tail moment and Olive tail moment were increased significantly in ACN group, low-dose AP group, high-dose AP group and NAC group, while the activity of SOD was decreased significantly in these groups (P < 0.05). In contrast, the difference among low-dose AP group, high-dose AP group, NAC group and ACN group had no statistical significance (P > 0.05). These data indicate that regardless the presence of AP and/or NAC, ACN could induce sperm lipid peroxidation and DNA damage in male rats.
apigenin; acrylontrile; rat; sperm; lipid peroxidation; DNA damage; comet assay
中央高校基本科研业务专项资金项目(lzujbky-2014-221)
陈军义(1987-),男,硕士,研究方向为妇女劳动卫生与生殖健康,E-mail: chenjy2013@lzu.edu.cn
Corresponding author), E-mail: lizhl@lzu.edu.cn
10.7524/AJE.1673-5897.20150601003
2015-06-01 录用日期:2015-07-28
1673-5897(2015)6-166-07
R114
A
陈军义,赵乾龙,张洁, 等. 芹菜素对丙烯腈引起大鼠精子脂质过氧化和DNA损伤的影响[J]. 生态毒理学报,2015, 10(6): 166-172
Chen J Y, Zhao Q L, Zhang J, et al. Effect of apigenin on acrylontrile-induced lipid peroxidation and DNA damage in sperm of male rats [J]. Asian Journal of Ecotoxicology, 2015, 10(6): 166-172 (in Chinese)

