也门铁的组织培养技术研究
齐安民,王家琼,李 楠,贺 涛,李 薇,崔大方
(1.华南农业大学 林学院,广东 广州 510642;2.重庆云阳县果品产业发展局,重庆 云阳 404500;3.重庆奉节县林业局,重庆 奉节 404600;4.华南农业大学 公共基础课实验教学中心,广东 广州 510642;5.广州南沙明珠湾区开发有限公司,广东 广州 511455)
也门铁的组织培养技术研究
齐安民1,2,王家琼1,3,李楠4,贺涛5,李薇1,崔大方1
(1.华南农业大学 林学院,广东 广州 510642;2.重庆云阳县果品产业发展局,重庆 云阳 404500;3.重庆奉节县林业局,重庆 奉节 404600;4.华南农业大学 公共基础课实验教学中心,广东 广州 510642;5.广州南沙明珠湾区开发有限公司,广东 广州 511455)
以4品种也门铁的茎段为外植体进行组织培养技术研究。结果表明,控制普通也门铁茎段褐化效果最理想的培养基为MS + 0.25 g·L-1VC+ 0.50 g·L-1Na2S2O3;诱导也门铁不定芽萌动的最佳培养基为MS + 3.0 mg·L-16-BA + 0.2 mg·L-1NAA + 0.1 mg·L-1KT;诱导也门铁不定芽增殖的最佳培养基,因品种不同而异,普通也门铁和金心也门铁为MS + 2.0 mg·L-16-BA + 1.0 mg·L-1NAA + 0.1 mg·L-1GA3,扭纹铁和金心扭纹铁为MS + 1.0 mg·L-16-BA + 0.5 mg·L-1NAA + 0.1 mg·L-1GA3;也门铁壮苗的最佳培养基为MS + 0.05 mg·L-16-BA + 0.05 mg·L-1NAA + l g·L-1AC;也门铁生根最优培养基为1/2MS + 0.5 mg·L-1IBA。
也门铁;组织培养;褐化
也门铁Dracaena fragrans,又名香龙血树、巴西铁、千年木等,是龙舌兰科Agavaceae龙血树属Dracaena常绿乔木,原产于几内亚,地栽植株有明显的主干和分枝,高可达20 m。也门铁雅气十足,深受人们喜爱,是布置宾馆、会议室、客厅等的优良观叶植物。花市上以普通也门铁、金心也门铁D. fragrans ‘Massangeana’、扭纹铁D. fragrans ‘Compacta’和金心扭纹铁D. fragrans ‘Janet-craig’四品种最为流行。
目前关于也门铁离体培养的报道鲜少,且均为经愈伤组织途径分化后再生繁殖。Vinterhalte[1]是利用组培技术获得也门铁愈伤组织和组培苗的先行者之一,随着也门铁在园林应用上的广泛流行,其离体培养的研究也在不断深入[2—4],王方正等[5]利用组培技术对也门铁进行了快速繁殖。易清等[6]以金心也门铁、金边也门铁和普通也门铁茎段为材料,对植物生长调节物质、基本培养条件等因素进行研究,建立了也门铁离体再生体系。总的来说,我国也门铁育苗基本采取离体培养方式,而在离体繁殖过程中,外植体褐化严重、增殖系数低及组培苗变异严重等问题相当普遍,使得也门铁生产成本大幅提升,极大地阻碍了该植物在我国的应用和发展[7—8]。本文对也门铁茎段组培褐化现象,及4个也门铁品种茎段不定芽诱导和增殖、壮苗及生根等培养条件进行研究,为建立稳定的离体繁殖技术体系,实现也门铁工厂化育苗奠定基础。
1 材料与方法
1.1材料
供试品种为普通也门铁Dracaena fragrans、金心也门铁D. fragrans ‘Massangeana’、扭纹铁D. fragrans ‘Compacta’、金心扭纹铁D. fragrans ‘Janet-craig’,均购于广州市岭南花卉市场。
1.2外植体与基本培养基的选择与处理
从各品种中选取生长健壮、无病虫害的优良母株,剪取所需嫩茎,用自来水冲洗约30 min后,置于75%酒精溶液浸泡30 s,再用0.1%氯化汞溶液封闭式振摇灭菌13 min,然后无菌水冲洗5~6次。切去与药液直接接触的伤口部分,再将茎段切成长2.0~2.5 cm小段,接种于培养基上进行培养。
普通也门铁防褐化培养基筛选、4品种也门铁不定芽诱导和增殖培养基均选用MS为基本培养基,生根培养基选用1/2MS为基本培养基,植物生长调节剂的用量因不同实验而异,培养基中均加入3%蔗糖,0.8%琼脂,pH=5.8。并将配制好的培养基在121 ℃条件下灭菌20 min。
1.3培养方法及培养条件
1.3.1不同抗氧化剂、吸附剂配比筛选以MS基本培养基为对照(CK),在MS基本培养基中分别做7种不同抗氧化剂、吸附剂处理(表1)。将处理好的普通也门铁茎段接种到设计好的培养基中,每处理5瓶,3次重复,培养温度25~28 ℃,光照强度1500 Lx,光照时间12 h·d-1。每天观察褐化情况,共观察6次,以平均值计算褐化率。
1.3.2茎段不定芽诱导培养基筛选以控制普通也门铁茎段褐化的最优培养基为茎段启动的基础培养基,通过正交试验筛选出适合4品种也门铁茎段不定芽诱导的植物生长调节剂浓度配比(表2)。将也门铁茎段接种到各培养基中,诱导腋芽。每种培养基接种30个材料,培养30 d后进行统计分析,从中选出较好的两种培养基进一步作对比实验。培养温度25~28 ℃;光照强度1500 Lx,光照时间12 h·d-1。
1.3.3不定芽增殖培养基筛选初代培养获得的外植体腋芽长至0.5~1.0 cm时,将不定芽由基部切下,并纵向分成3~4块,转入含不同植物生长调节剂配比的MS增殖培养基中,诱导不定芽增殖(表3)。每种培养基接种30个材料,培养30 d后进行统计分析,选出较好的两种培养基,进一步作对比实验。培养温度25~28 ℃;光照强度1500 Lx,光照时间12 h·d-1。
1.3.4不定芽壮苗培养当不定芽长至1.5 cm高时,将丛生不定芽分割成小块,转入加不同植物生长调节剂和活性炭配比的MS壮苗培养基中(表4),培养20 d后观测并记录芽苗生长情况,统计平均苗高。每处理接种5瓶,每瓶接种10个芽,重复5次。
1.3.5生根培养壮苗培养后高为3 cm左右的芽分割,移至1/2MS + IBA (0、0.5、1.0、2.0 mg·L-1)培养基中,培养20 d后调查试管苗生根率、平均生根量和根长等。
1.3.6炼苗与移栽选择根长5 cm左右、根系发达的组培苗,在温室内打开瓶口注入10 mL无菌水,炼苗5~6 d,期间注意保持室内湿度。经炼苗的幼苗从培养基中取出,自来水洗净根部培养基,分别移栽至不同基质中(体积比为椰糠:珍珠岩=1:1;花卉有机土:泥土=1:1;蛭石:河沙=1:1)。基质保持湿润且无积水,放置在遮阴处20 d左右进行驯化,促进新根的发生,观察记录生长状况。
2 结果与分析
2.1不同抗氧化剂和吸附剂配比对普通也门铁茎段组培褐化的控制效果
由表1可见,无论在何种培养基中,普通也门铁茎段随着培养时间的延长,褐化率均呈上升趋势。但在不同处理条件下,褐化程度均低于对照,在单独添加一种抗氧化剂或吸附剂的条件下,对防治褐化有一定效果,但效果并不理想,6 d后的褐化率均在50%以上。在添加不同配比的抗氧化剂和吸附剂的培养基中防褐化效果更好,褐化率低于40%,其中以MS + VC0.25 g·L-1+ Na2S2O30.50 g·L-1的处理效果最好,在6 d内褐化率15.1%;其次为MS + AC 0.25 g·L-1+ VC0.50 g·L-1,褐化率控制在30.1%。此外,通过实验发现,接种前对外植体用自来水冲洗过夜,再用45 ℃温水浸泡15 min,接种后经过2~3 d暗处理,对抑制褐化有一定效果。
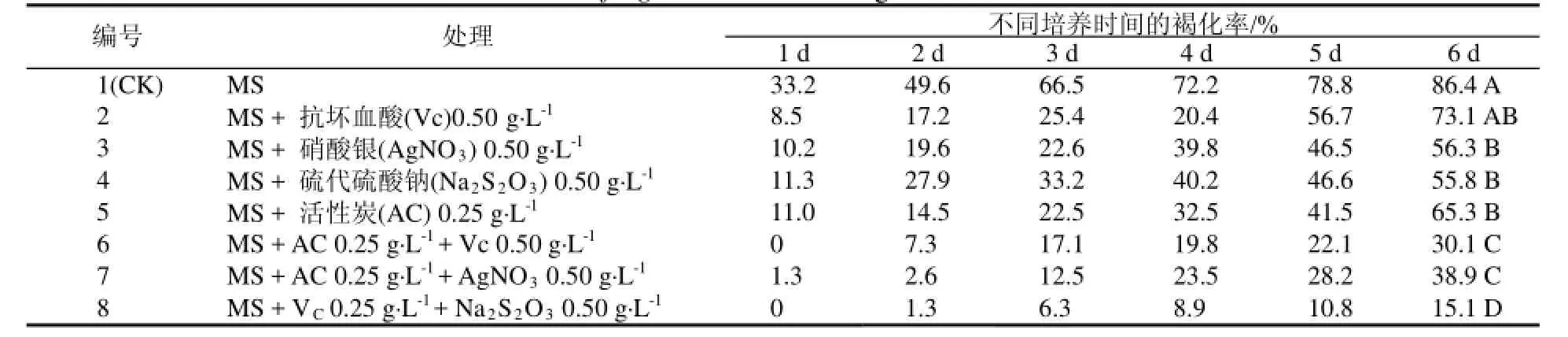
表1 不同抗氧化剂和吸附剂配比对普通也门铁茎段组培褐化的影响Table 1 Ratio of the Dracaena fragrans stem browning in different antioxidants and adsorbent
2.2不同植物生长调节剂浓度配比对也门铁茎段不定芽诱导率的影响
将也门铁茎段在诱导培养基上培养10 d左右,茎段两端膨大增生,15 d时腋芽萌动,20 d时在腋芽周围有肉眼可见的不定芽,30 d后腋芽生长至0.5 cm左右,统计诱导率(图1: A, B)。
从表2可以看出,三种植物生长调节剂中,以6-BA对4品种也门铁茎段不定芽诱导影响最大,随着其浓度增加,也门铁不定芽的诱导率也增加。在相同植物生长调节剂浓度配比的条件下,不同品种也门铁之间的茎段诱导率有较大差异,扭纹铁茎段诱导率要明显高于普通也门铁和金心也门铁。总体上,普通也门铁茎段不定芽诱导的最佳培养基为15和16号,金心也门铁为16号,扭纹铁为12和16号,金心扭纹铁为12和16号。因此,可以16号作为4品种也门铁茎段不定芽诱导的通用培养基,即MS + 3.0 mg·L-16-BA + 0.2 mg·L-1NAA + 0.1 mg·L-1KT。
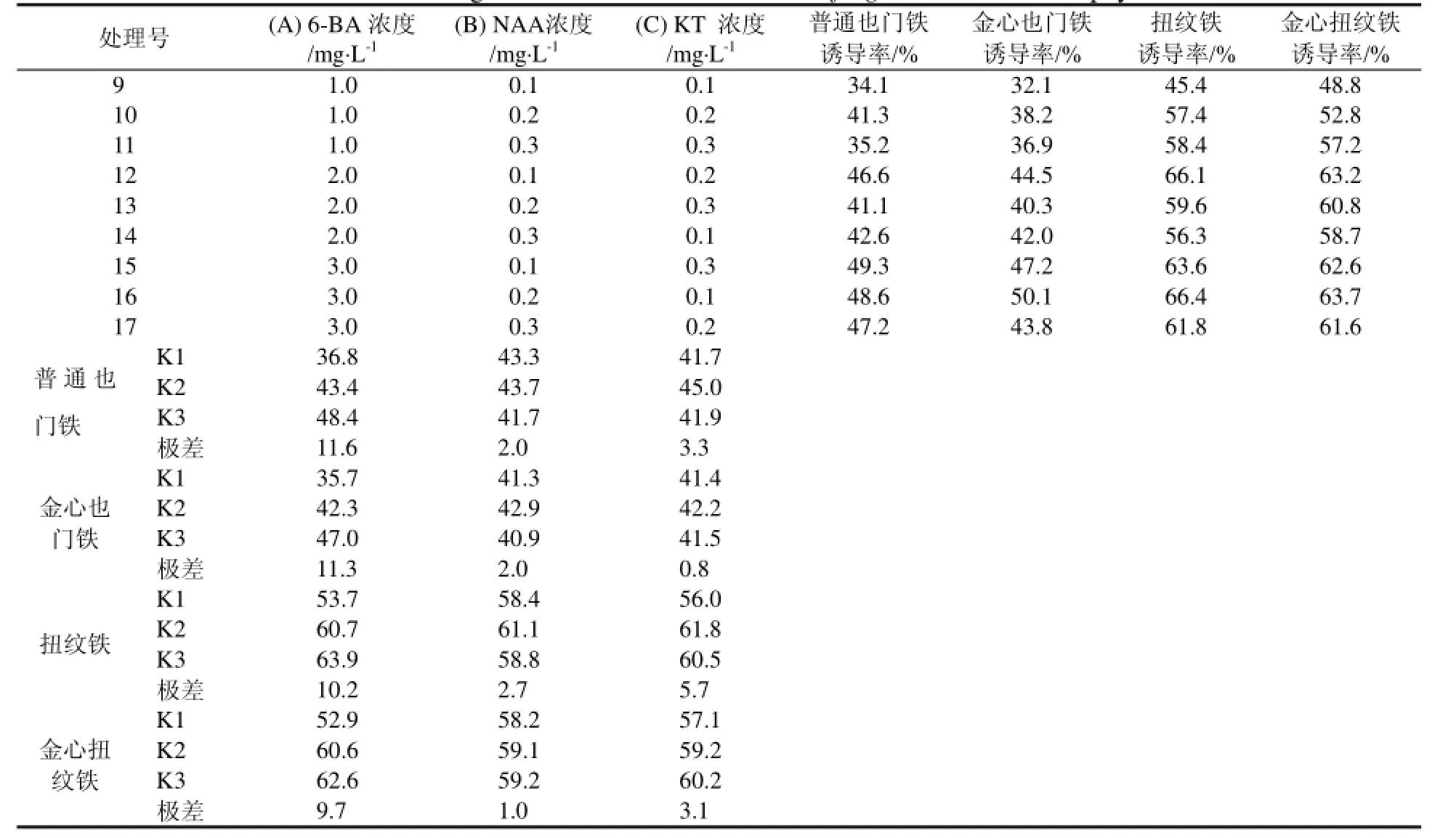
表2 不同植物生长调节剂浓度配比对4品种也门铁茎段不定芽诱导率的影响Table 2 The stem stirring rate of 4 cultivars of Dracaena fragrans with different phytohormone
2.3不同植物生长调节剂浓度配比对也门铁不定芽增殖率的影响
将也门铁诱导芽培养于增殖培养基上,10 d左右切口处会出现少量愈伤组织,15 d开始出现不定芽,20 d时可见许多簇生状不定芽,30 d后簇生不定芽生长至0.5 cm左右,统计增殖率(图1: C)。从表3可以看出,在也门铁不定芽增殖中,6-BA对4品种也门铁不定芽的增殖影响最大,当6-BA浓度为4.0 mg·L-1时,不定芽增殖率最低。在相同植物生长调节剂浓度配比的培养基中,不同品种也门铁之间的不定芽增殖率也有较大差异,扭纹铁不定芽增殖率要明显高于也门铁。总体分析,普通也门铁和金心也门铁茎段不定芽增殖的最佳培养基为23号,扭纹铁和金心扭纹铁为18号。因此,生产上可以23号作为普通也门铁和金心也门铁茎段不定芽增殖的通用培养基,即MS + 2.0 mg·L-16-BA + 1.0 mg·L-1NAA + 0.1 mg·L-1GA3;以18号作为扭纹铁和金心扭纹铁茎段不定芽增殖的通用培养基,即MS + 1.0 mg·L-16-BA + 0.5 mg·L-1NAA + 0.1 mg·L-1GA3。

表3 不同植物生长调节剂浓度配比对也门铁不定芽增殖率的影响Table 3 The cluster multiplication rate of 4 cultivars of Dracaena fragrans with different phytohormone
2.4 壮苗培养
增殖培养中得到的芽高通常在1.5 cm以内,这些芽体较小,生根后移栽成活率很低,因此对不定芽进行壮苗培养十分关键。将4品种也门铁的丛生芽块分割成3~5个不定芽小块,转入不同组合植物生长调节剂的壮苗培养基中培养20 d,芽苗可生长至3 cm左右。实验中发现,4品种也门铁在同一植物生长调节剂组合的培养基中长势表现一致,品种间不存在明显差异。表4为普通也门铁数据,在不同植物生长调节剂浓度配比条件下,普通也门铁株高有所不同,其中在培养基MS + 0.05 mg·L-16-BA + 0.05 mg·L-1NAA + l g·L-1AC中芽高度和粗度均增加1.5倍以上,明显优于其他培养基。在同一植物生长调节剂浓度组合下,活性炭促进壮苗的作用明显,添加活性炭时叶呈深绿色,挺拔健壮,否则生长较慢且苗细弱,叶不展开。6-BA浓度为 0.1 mg·L-1时,茎基部产生愈伤组织,出现再分化现象,严重影响苗生长。因此在壮苗培养基中,AC是壮苗的关键因子之一,6-BA浓度应控制在0.1 mg·L-1以内。
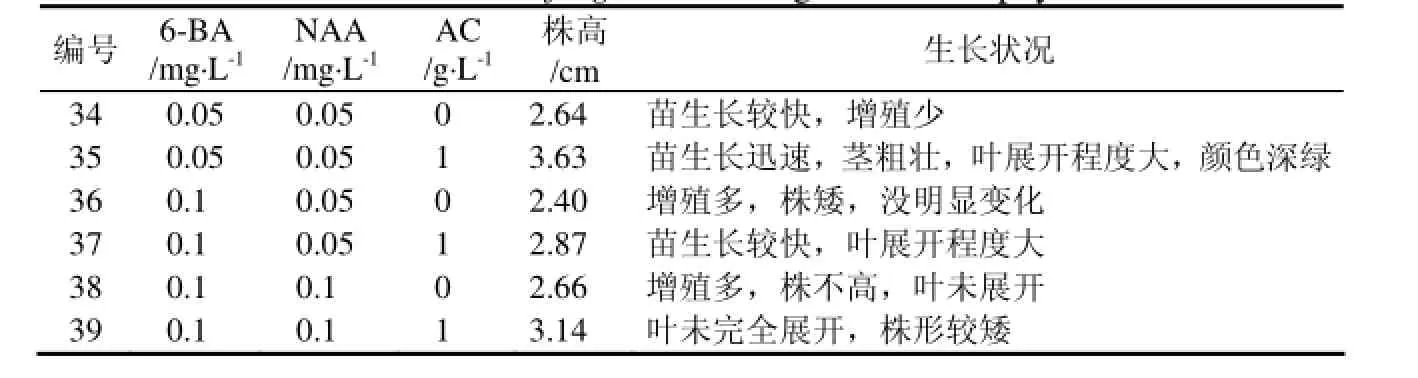
表4 植物生长调节剂及活性炭对普通也门铁壮苗的影响Table 4 Effect of the Dracaena fragrans seedling in different phytohormone and AC
2.5IBA浓度对普通也门铁组培苗生根的影响
当也门铁苗高3 cm时,将丛生状的幼苗从基部分割成单苗,移至生根培养基(图1: D)。7 d后,在IBA浓度为0.5、1.0 mg·L-1的培养基中,幼苗先出现白色新根(图1: E, F)。总体而言,在添加IBA的培养基,也门铁生根较容易,效果理想。20 d后四种培养基中根长势不一,有的根长达5 cm,有的根仅呈突起状。从表5可见,IBA是影响生根的重要因子。

表5 IBA对普通也门铁的生根影响Table 5 Effects of IBA on the Dracaena fragrans rooting culture
2.6炼苗与移栽
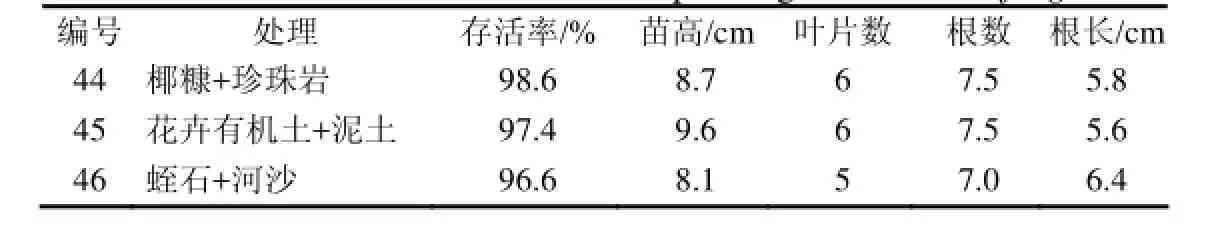
表6 普通也门铁的炼苗与移栽Table 6 The acclimatization and transplanting of Dracaena fragrans
由表6可见,也门铁幼苗在三种移栽基质中生长良好,幼苗存活率较高,均能达到96%以上(图1: G, H, I)。从经济角度考虑,以45号最佳,即花卉有机土+泥土更有利于组培苗移栽及后期管理。

图1 也门铁组织培养及移栽苗Fig. 1 Tissue culture and transplanting seedlings of Dracaena fragrans
3 讨论
外植体褐化主要是因为外植体组织被切割后导致细胞受害,酚氧化酶和酚类物质流出,与氧气聚合发生反应,形成褐色醌类物质,并逐渐扩散到培养基中,导致外植体变褐而死亡的现象[9—10]。抗氧化剂能清除因外植体机械损伤而渗出的酚类物质和已被酚酶氧化的醌类物质,减轻褐化的危害[11]。本研究利用该原理预防也门铁愈伤褐化,并取得良好效果。研究发现,在培养基中加入Na2S2O3、VC抗氧化剂和AC吸附剂后,对降低褐化率都有明显效果,其中以添加合适配比抗氧化剂和吸附剂后的效果最为明显,即MS + VC0.25 g·L-1+ Na2S2O30.50 g·L-1。
在4品种也门铁的不定芽诱导和增殖培养中,植物生长调节剂起着决定性作用。有研究认为,GA3是植物试管苗增殖阶段的关键因素[12—13],但本实验发现,6-BA对也门铁不定芽诱导和增殖的影响最重要,且添加合适配比的不同植物生长调节剂的效果优于单一植物生长调节剂,这与柯碧英等[8]和刘和平等[14]的研究一致。本研究的也门铁茎段不定芽诱导以MS + 3.0 mg·L-16-BA + 0.2 mg·L-1NAA + 0.1 mg·L-1KT培养基为最佳;增殖培养的最佳培养基因品种不同而异,普通也门铁和金心也门铁为MS + 2.0 mg·L-16-BA + 1.0 mg·L-1NAA + 0.1 mg·L-1GA3;扭纹铁和金心扭纹铁为MS + 1.0 mg·L-16-BA + 0.5 mg·L-1NAA + 0.1 mg·L-1GA3。
在组织培养过程中,发现 4品种也门铁的生长规律基本一致,尤其是金心也门铁和普通也门铁之间相当接近,这与易清等[6]的研究结果基本一致。同时,研究还表明,在也门铁组织培养过程中加入合适的植物生长调节剂、吸附剂、抗氧化剂等物质,是建立高效再生体系的必要条件。
[1] Vinterhalte D V. In vitro propagation of green-foliaged Dracaena fragrans Ker[J]. Plant Cell, Tissue and Organ Culture, 1989,17: 13—19.
[2] 颜昌敏. 植物组织培养手册[M]. 上海: 科学技术出版社, 1990.
[3] Lu W L. Direct regeneration of inflorescence from callus in Dracaena fragrans cv. massangeana hort[J]. Acta Botanica Sinica, 2002,44 (1): 113—116.
[4] Lu W L. Control of in vitro regeneration of individual reproductive and vegetative organs in Dracaena fragrans cv. massangeana Hort—Regularities of the direct regeneration of individual organs in vitro[J]. Acta Botanica Sinica, 2003,45 (12): 1453—1464.
[5] 王方正,蒋雄辉,郑健临,陈春满 胡事君. 也门铁的组织培养与快速繁殖[J]. 植物生理学通讯, 2006,42(3): 481.
[6] 易清,何业华,刘颂颂,吕长平,刘和平,林顺权,朱剑云,叶永昌 . 3个也门铁品种高效离体繁殖体系的建立[J]. 湖南农业大学学报, 2007,33(4): 440—446.
[7] 李学东,常青,陆文. 花叶千年木花序梗愈伤组织直接再生花芽的初步研究[J]. 植物学报, 1999,41(6): 672—674.
[8] 柯碧英,张华通,林晓萍,何旭君. 金心也门铁组培快速繁殖技术研究[J]. 广东农业科学, 2009(7): 75—77.
[9] Asmus B, Hamme H. Enzymatic browning of vegetables, Calibration and analysis of variance by mutiway methods[J]. Chemometrics Intelligent Laboratory Systems, 1996,34: 85.
[10] 黄丹莹,江贵波. 植物组织培养褐变产生的因素及对策[J]. 广西轻工业, 2006(5): 31—32.
[11] 吕颖颖,李博,江大龙,李凤海,马永光,朱敏,吕香玲,胡海军,王宏伟. 影响玉米幼胚组织培养褐化因素的研究[J]. 种子, 2014,33(1): 65—67.
[12] 李萍,成仿云,张颖星. 防褐剂对牡丹组培褐化发生、组培苗生长和增殖的作用[J]. 北京林业大学学报, 2008,30(2): 71—76.
[13] Lee B K, Ke J A, Kim Y S. Studies on the thidazuron treatment of anther culture in albiflora[J]. Journal of the Korean Society for Horticultural Science, 1992,33(5): 384—395.
[14] 刘和平,林剑波. 激素对也门铁叶片愈伤组织的诱导效果[J]. 安徽农业科学, 2011,39(5): 2546—2547.
Tissue Culture Technique of Dracaena fragrans
QI An-min1,2, WANG Jia-qiong1,3, LI Nan4, HE Tao5, LI Wei1, CUI Da-fang1
(1.College of Forestry, South China Agricultural University, Guangzhou 510642, Guangdong China; 2.Yunyang Fruit Industry Development Council, Yunyang 404500, Chongqing China; 3.Fengjie Forestry Bureau, Fengjie 404600, Chongqing China; 4. Center of Experimental Teaching for common Basic Courses, South China Agricultural University, Guangzhou 510642, Guangdong China; 5.Nansha Pearl Bay Development Co. Ltd., Guangzhou 511455, Guangdong China)
The tissue culture techniques of four cultivars of Dracaena fragrans used stem section as the explant were analyzed. A series of important conclusions can be made: 1) The optimal medium for controlling tissue browning of D. fragrans: MS + 0.25 g·L-1VC+ 0.50 g·L-1Na2S2O3; 2) The optimal medium for inducing the D. fragrans stem stirring: MS+ 3.0 mg·L-16-BA + 0.2 mg·L-1NAA + 0.1 mg·L-1KT; 3) The optimal proliferation medium of D. fragrans, depends on the cultivars of D. fragrans. The optimal medium for D. fragrans and D. fragrans ‘Massangeana’: MS + 2.0 m g·L-16-BA + 1.0 mg·L-1NAA + 0.1 mg·L-1GA3; The optimal medium for D. fragrans ‘Compacta’ and D. fragrans ‘Janet-craig’: MS + 1.0 m g·L-16-BA + 0.5 mg·L-1NAA + 0.1 mg·L-1GA3; 4) Under the condition of MS + 0.05 mg·L-16-BA + 0.05 mg·L-1NAA + l g·L-1AC was the most efficient the Dracaena fragrans seedling medium; 5) 1/2MS + 0.5 mg·L-1IBA was the most efficient rooting medium.
Dracaena fragrans; tissue culture; callus browning
10.3969/j.issn.1009-7791.2015.01.005
Q943.1
A
1009-7791(2015)01-0023-06
2014-11-26
齐安民,硕士,从事生物技术与园艺植物资源研究。E-mail: anminq@163.com
注:崔大方为通讯作者。E-mail: cuidf@scau.edu.cn

