喜马拉雅紫茉莉根水浸提液对五种植物的化感作用研究
马世尧,刘胜利,陈玉珍,卢存福,兰小中
(1.北京林业大学 生物科学与技术学院,北京 100083;2.西藏大学农牧学院 食品科学学院,西藏 林芝 860000)
喜马拉雅紫茉莉根水浸提液对五种植物的化感作用研究
马世尧1,刘胜利1,陈玉珍1,卢存福1,兰小中2
(1.北京林业大学 生物科学与技术学院,北京 100083;2.西藏大学农牧学院 食品科学学院,西藏 林芝 860000)
以采自西藏林芝地区的藏药植物喜马拉雅紫茉莉为试材,探讨其根部不同浓度(0.0125、0.025、0.05、0.1 g·mL-1)水浸提液对莴苣、绿豆、小麦、萝卜、油菜等5种植物的化感效应。结果表明,随着浸提液浓度的增加,受试植物的种子萌发及幼苗生长均受到不同程度的抑制,植株体内丙二醛含量持续升高,抗氧化酶活性及叶绿素含量逐渐下降,受试植物不同部位对浸提液敏感程度为地下部分>地上部分。另外,5种植物对浸提液敏感程度为莴苣>绿豆>小麦>萝卜>油菜。
喜马拉雅紫茉莉;化感作用;种子萌发;幼苗生长;抗氧化酶
喜马拉雅紫茉莉Mirabilis himalaica系紫茉莉科Nyctaginaceae紫茉莉属Mirabilis植物,又名东亚紫茉莉,主要分布于我国西藏林芝等地区,生长在海拔300 m左右的草丛和山地间[1]。喜马拉雅紫茉莉是一种传统藏药,其主要药用部位为根,具有温肾排石、益肾滋补、生肌利尿等功效[2]。目前,对于该种植物的研究主要集中在化学成分鉴定、抗毒性药理实验以及质量评估等方面,关于喜马拉雅紫茉莉化感作用的研究也仅见兰小中等[6]研究其种子对小麦和绿豆的化感抑制作用,但对于喜马拉雅紫茉莉主要入药部位根的化感作用研究尚无报道。
化感作用是指植物通过根系分泌、空气挥发等方式,将自身代谢合成的化学物质作用于邻近的植物或微生物,进而对它们的生长发育产生的有益或有害的作用[7—9]。近年来研究发现,大多数药用植物都易于发生化感作用,国内外许多学者也对药用植物的化感作用进行了相关研究和报道。游佩进等[10]研究表明,三七连作土壤对三七、莴苣有化感作用;Yan等[11]发现狼毒根中所含一种黄酮类植物毒素严重抑制了拟南芥幼苗生长;银福军等[12]报道黄连不同部位水浸液具有自毒作用;Haq等[13]研究发现,桑叶水提取物抑制狗牙草生长,促进小麦生长;雷锋杰等[14]报道了人参根系分泌物对4种药用植物大黄、水飞蓟、牛蒡和白花草木犀的化感作用。上述这些研究从不同角度对药用植物在生态环境中所发挥的化感作用及相关机制进行了一定程度的阐述。
本研究在前人研究的基础上,分析了不同浓度喜马拉雅紫茉莉根部水浸提液对小麦、绿豆、莴苣、油菜、萝卜等5种植物的化感作用,并利用化感抑制指数(IR)综合评价喜马拉雅紫茉莉根部水浸提液对这5种植物的化感作用效应的差异,为探究高海拔藏区药用植物的化感作用机制,以及该藏药植物在生产中的实际应用提供科学依据。
1 材料与方法
1.1材料
喜马拉雅紫茉莉釆自海拔3000 m左右的西藏林芝地区。5种受体植物种子分别为购自北京京研益农科技发展中心的萝卜品种‘京脆1号’、油菜品种‘春油4号’和莴苣品种‘特选雁翎笋’,小麦和绿豆为北京林业大学陈玉珍副教授馈赠。
1.2方法
1.2.1喜马拉雅紫茉莉根部水浸提液制备将喜马拉雅紫茉莉的根洗净干燥后,用超高速万能粉碎机粉碎,粉末过100目筛,称取100 g干燥粉末于试剂瓶中,加入1 L重蒸水,置于摇床震荡提取24 h, 温度设置为室温22 ℃,将转速调高至200 r·min-1,以保证充分浸提。将粗提液经两层纱布过滤后,再用两层滤纸过滤,将过滤后的浸提液过0.22 μm滤膜除菌,配制成浓度为0.1 g·mL-1浸提液母液,参考前人研究结果[6]和自然生长环境,用无菌蒸馏水将母液配制成浓度为0.0125、0.025、0.05、0.1 g·mL-1的处理液,4 ℃冰箱保存备用。
1.2.2种子萌发实验选取饱满、状态一致的种子,用70%酒精浸泡1 min,2%次氯酸钠溶液消毒3 min,然后用灭菌蒸馏水清洗3次,每次1 min,吹干备用。每个铺有双层滤纸的培养皿(Φ= 100 mm)装入50粒已消毒种子,分别加入0.0125、0.025、0.05、0.1 g·mL-1浸提液10 mL,以蒸馏水为对照,每处理重复3次。种子于恒温培养箱25 ℃暗培养5 d,第3 d在每个培养皿中加入5 mL处理液或蒸馏水。每隔12 h统计一次种子发芽数(以芽突破种皮为发芽标准),记录数据。
1.2.3幼苗生长实验取胚根刚突破种皮且较为一致的种子 30粒,均匀摆放在铺有滤纸的培养皿(Φ= 100 mm)中, 加入10 mL不同浓度水浸提液(对照组为蒸馏水),每处理3次重复,第4 d时在每个培养皿中加入5 mL处理液或蒸馏水。第8 d时,每培养皿随机选取10粒种子测定其胚根、胚芽长度及鲜重,每处理计算三次重复的平均值。
1.2.4生理生化指标测定超氧化物歧化酶(SOD)活性测定采用氮蓝四唑(NBT)光化还原法[15],过氧化物酶(POD)活性测定采用愈创木酚法[16],过氧化氢酶(CAT)活性测定采取过氧化氢还原法[16],丙二醛(MDA)含量测定采用硫代巴比妥酸(TBA)比色法[17],叶绿素含量测定采用95%乙醇提取比色法[18]。
1.2.5数据处理种子发芽率:发芽率(%) = (发芽终止时所有发芽的种子数/总种子数)×100%; 化感作用抑制率(Inhibitory rate,IR):IR(%) = (Ti - T0) ÷ T0 × 100%,Ti为测试项目的处理值,T0为对照值。IR>0表明是促进作用,IR<0表明是抑制作用。IR绝对值越大,表明其化感作用(促进或抑制作用)越大。化感综合效应(synthesis effect, SE)是供体对同一受体所有测试项目的化感作用抑制率百分率的算术平均值[19]。种子萌发和幼苗生长实验数据用Excel 软件统计处理后,再用SPSS软件进行处理分析,利用单因素方差分析和最小显著差数法(least significant difference, LSD)多重比较分析种子发芽势和发芽率的差异。
2 结果与分析
2.1不同浓度水浸提液对种子萌发的影响
由表 1可知,不同浓度的喜马拉雅紫茉莉根部水浸提液对小麦、绿豆、油菜、莴苣、萝卜的种子萌发产生化感抑制作用。随着浸提液浓度的增加,5种植物种子的发芽率均呈逐渐下降趋势,但不同种植物对水浸提液的化感作用敏感程度并不相同。莴苣和萝卜为较敏感的植物,在0.025 g·mL-1(低浓度)浸提液处理下,两者发芽率受化感作用的抑制率分别达到-36.03%和-67.70%,而小麦、绿豆和油菜的发芽率下降程度相对较小;浸提液浓度为0.05 g·mL-1(中浓度)时,与对照相比,对小麦、莴苣、油菜和萝卜这4种植物发芽率的化感抑制作用均已达到极显著水平,分别为-8.05%、-40.44%、-33.3%、-95.1%,而绿豆的发芽率与对照相比,只下降了2%,变化不显著;当浓度增加至0.1 g·mL-1(高浓度)时,浸提液对这5种植物发芽率的抑制作用均达到极显著水平,莴苣和萝卜的发芽率仅为1%左右,对小麦、绿豆、莴苣、油菜和萝卜的化感抑制率分别为-55.00%、-8.00%、-99.27%、-70.10%、-98.00%。据此可知,这5种受试植物种子受浸提液化感作用影响的大小顺序依次为莴苣>萝卜>油菜>小麦>绿豆。从种子发芽趋势可以看出,喜马拉雅紫茉莉根的水浸提液对受试植物种子萌发的影响也表现在延缓其种子萌发的时间上,其中以莴苣和油菜的种子表现得较为明显。随着浸提液浓度的不断升高,莴苣和萝卜种子由原来的12 h开始发芽延缓到24 h甚至于最迟36 h才开始发芽,而这一现象在小麦、绿豆、油菜种子中并未出现。
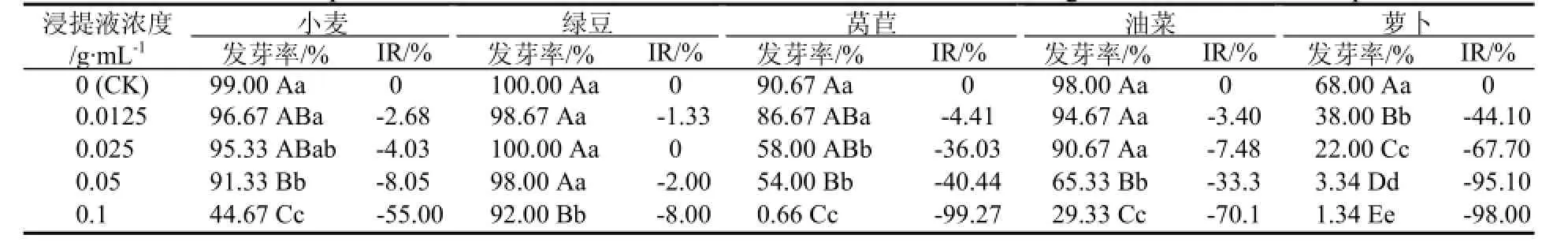
表1 喜马拉雅紫茉莉根水浸提液对5种植物种子发芽率的影响Table 1 Allelopathic effects of Mirabilis himalaica root extracts on the seed germination rate of five plants
2.2不同浓度水浸提液对幼苗生长的影响
2.2.1苗高与根长由表2可以看出,随着浓度的增加,浸提液对5种受试植物幼苗根长的化感作用主要表现为不同程度的抑制作用。这5种受试植物的根长在浸提液浓度为0.0125 g·mL-1(低浓度)时,受化感作用抑制的程度就已经达到显著或极显著水平,对小麦、绿豆、莴苣、油菜和萝卜的化感抑制率分别为-31.02%、-66.26%、-47.93%、-8.20%、-40.69%。随着浸提液浓度的升高,化感抑制程度也随之明显增高,当浸提液浓度增加到0.1 g·mL-1时,5种受试植物幼苗的根长均受到极大的抑制作用,此时的化感抑制率依次达到-95.11%、-93.92%、-85.90%、-87.70%和-94.75%。在对幼苗苗高的化感作用方面所表现出来的规律并不相同。对于油菜而言,随着浸提液处理浓度的升高,其苗高呈现出先增高后降低的趋势,即浸提液对油菜幼苗苗高的影响表现为低浓度促进而高浓度抑制的规律。对于其他 4种植物幼苗苗高均表现出较为明显的化感抑制作用。从整体上看,抑制作用大致随着浸提液浓度的升高而增强,至高浓度0.1 g·mL-1时,对小麦、绿豆、莴苣和萝卜的抑制率依次为-63.98%、-84.14%、-72.38%、-65.58%,与对照相比均达极显著水平。通过化感抑制率的比较可发现,地下部分根的敏感程度要强于地上部分,受化感作用的抑制强度也更高。
2.2.2鲜重由表2可知,喜马拉雅紫茉莉根的水浸提液对5种受试植物地上部分生物量的化感作用,除油菜外整体上表现为抑制作用。在油菜中,低浓度浸提液对其鲜重有促进作用,而在高浓度时为抑制作用,且促进与抑制的程度均达极显著水平。在另外4种植物中,随着浸提液浓度的增加,幼苗鲜重下降逐渐增强,在浓度为0.0125 g·mL-1时,小麦和绿豆受抑制程度已达显著或极显著水平,化感抑制率分别为-22.67%和-19.00%,对莴苣和萝卜影响不显著;当浓度为 0.05 g·mL-1时,对小麦、绿豆、莴苣的抑制作用均达极显著水平;当浓度增加至0.1 g·mL-1时,浸提液对这4种植物鲜重的抑制程度均达到极显著水平,此时化感抑制率为小麦-51.47%、绿豆-44.83%、莴苣-72.07%、萝卜-22.25%。
总体来看,不同浓度的喜马拉雅紫茉莉根水浸提液对5种受试植物幼苗的综合效应主要表现为抑制作用。对油菜幼苗苗高和鲜重特异性的表现为在0.0125~0.05 g·mL-1浓度时促进,而在0.1 g·mL-1高浓度时显著抑制。从植物的部位来看,对根部的化感作用抑制率能达到-85%以上,而对地上部的化感作用抑制率则大致在-60%~-85%之间,对地上部分生物量的抑制率在-30%~-60%之间(表2)。研究表明,受试植物不同部位受化感作用的敏感程度为地下部分>地上部分。不同植物种类对浸提液敏感程度大小依次为莴苣>绿豆>小麦>萝卜>油菜,这种差异可能由植物种间差异导致,也可能与喜马拉雅紫茉莉根的水浸提液中化感物质的选择性和专一性有关[20]。
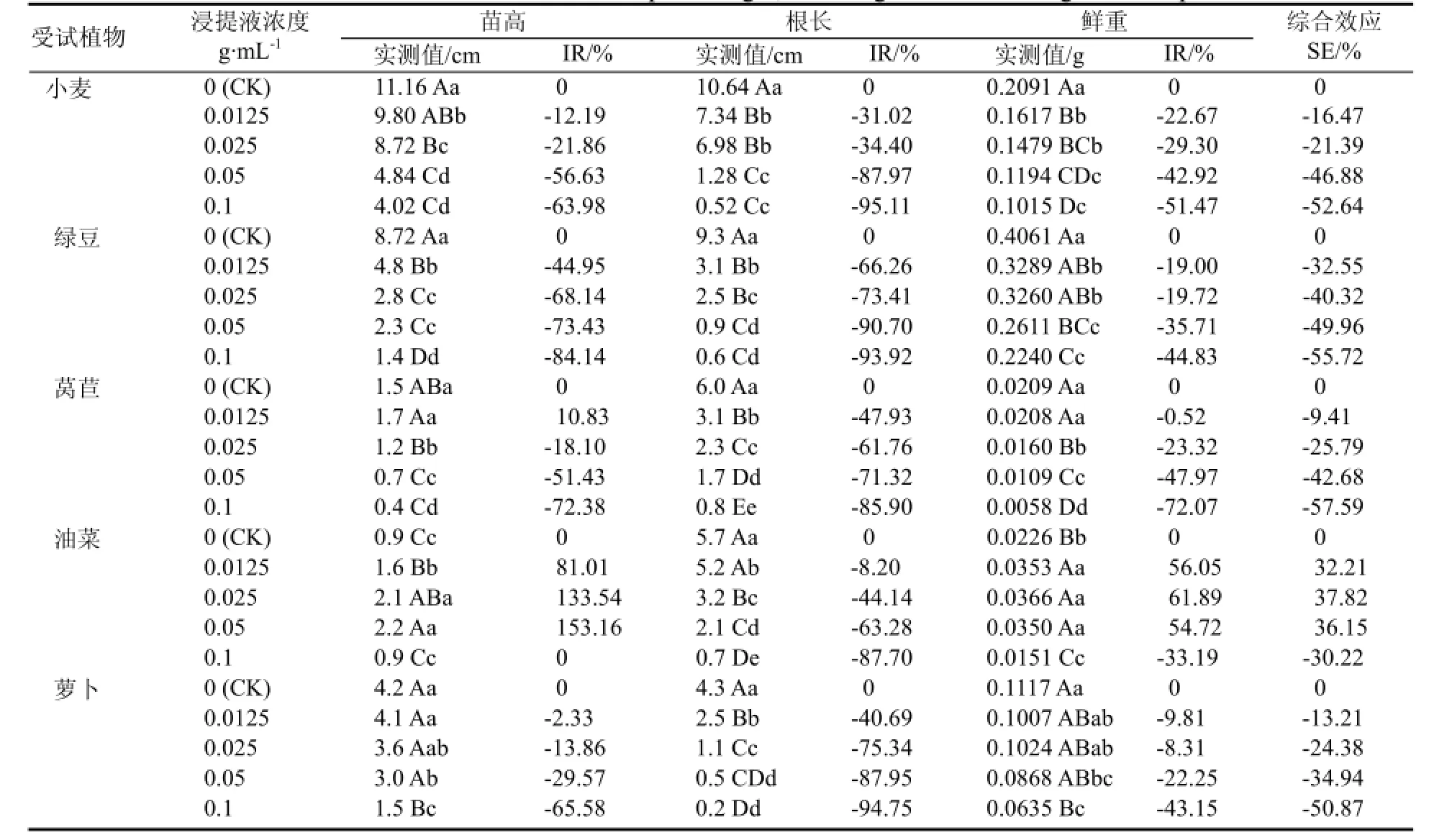
表2 不同浓度水浸提液对5种受试植物苗高、根长和鲜重的影响Table 2 Effects of water extracts on the plant height, root length and fresh weight of five plants
2.3不同浓度水浸提液对幼苗酶活性的影响
由图 1可以看出,随着浸提液浓度的升高,小麦、绿豆、萝卜的SOD、POD、CAT酶活性均呈先增高后降低的趋势。在油菜中,随着浸提液浓度的升高,其SOD酶活性呈先增高后降低的趋势,而POD 和CAT酶活性呈逐渐下降的趋势,说明经浸提液处理后,受试植物的抗氧化酶系统发生了变化,在低浓度(0.0125~0.025 g·mL-1)时,酶活性提高以抵御氧离子自由基等带给细胞的伤害,而当浸提液浓度增至0.1 g·mL-1时,受试植物细胞遭受严重损伤,抗氧化酶系统遭到破坏,导致酶活性的降低。对于莴苣这一敏感性较强的植物,其SOD、POD、CAT酶活性均呈现逐渐降低的趋势。
2.4不同浓度水浸提液对幼苗丙二醛(MDA)含量的影响
如图1所示,随着浸提液浓度的升高,5种受试植物体内膜脂过氧化产物丙二醛含量均呈现逐渐升高的趋势。丙二醛含量大幅度提高,表明受试植物细胞膜受损情况严重,膜过氧化产物大量增加,细胞内正常的酶保护系统亦遭受一定程度的破坏。
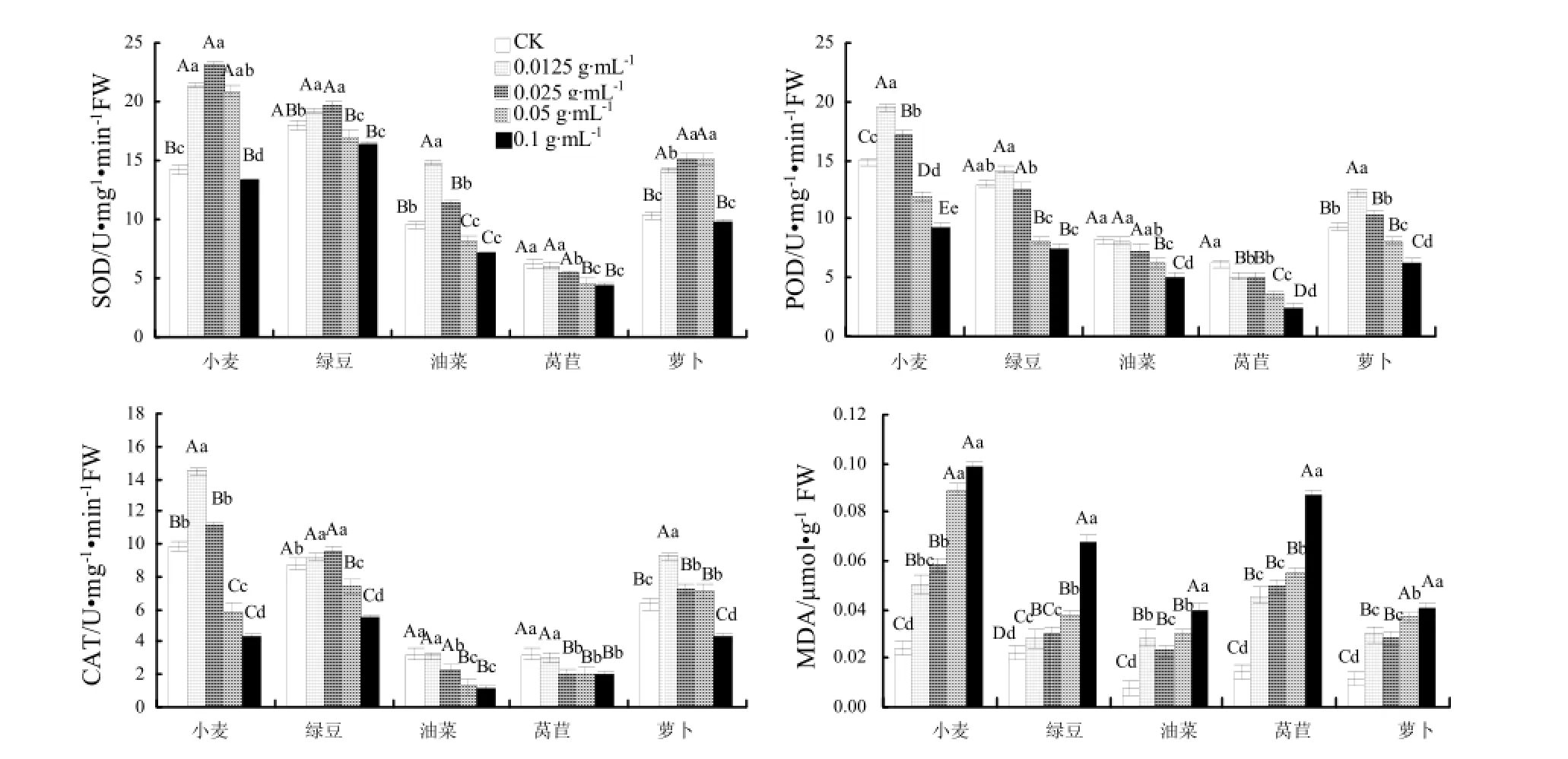
图1 不同浓度水浸提液对SOD、POD、CAT酶活性和MDA含量的影响Fig. 1 Effects of water extracts on activity of SOD, POD, CAT and content of malondialdehyde (MDA) of five plants
2.5不同浓度水浸提液对幼苗叶绿素含量的影响
喜马拉雅紫茉莉根的水浸提液显著降低了受试植物莴苣、油菜和萝卜幼苗的叶绿素含量(图2)。而小麦和绿豆幼苗中叶绿素含量随着浸提液浓度的升高,呈现先升高后降低的趋势。在低浓度浸提液处理下,绿豆幼苗叶绿素含量显著升高,而在0.1 g·mL-1高浓度处理下,叶绿素含量开始显著降低,表明低浓度浸提液对绿豆幼苗叶绿素含量的提高有一定的促进作用。叶绿素是植物进行光合作用的关键色素,其含量降低将严重制约植物光合速率,喜马拉雅紫茉莉根的水浸提液可能通过抑制叶绿素合成来降低其含量,从而影响受试植物的光合作用和生长发育。
3 讨论
植物间的化感作用广泛存在于自然生态系统中,对其深入研究有利于指导森林重建与培育、农作物种植、除草剂与杀虫剂研制、抵御生物入侵等[21—28],因此受到科学家广泛重视,并逐步形成新的学科和研究领域。大量研究表明,化感作用普遍存在于药用植物中,这与药用植物自身体内化学成分的特殊性有关,也与其生长环境密切相关[29]。喜马拉雅紫茉莉是一种传统藏药,具有重要的药用价值,其根部含有大量的次生代谢物质,而植物中的化感物质绝大部分为次生代谢物质。化感作用的研究方法主要分为实验室研究和田间试验两类[30],本文采用实验室研究方法,研究喜马拉雅紫茉莉根水浸提液对5种植物的化感抑制效应。结果表明,喜马拉雅紫茉莉根的水浸提液可以明显降低受试种子的萌发率,而且对受试植物幼苗生长也起到一定的抑制作用。这种化感抑制作用的强弱与浸提液浓度呈一定程度的正比关系,这一规律也在多种化感植物中被证实,一般在高浓度下表现为强烈抑制作用,在低浓度下作用不显著或起促进作用[31]。不同种植物对喜马拉雅紫茉莉根浸提液的化感抑制效应敏感程度并不相同,这可能是种属间的差异性导致的,尤其当浸提液浓度增加至0.1 g·mL-1时,对小麦、绿豆、莴苣、油菜和萝卜的发芽率及幼苗根长、苗高、鲜重的化感抑制率,与对照相比差异达到极显著水平,这与兰小中等[6]用喜马拉雅紫茉莉种子浸提液对小麦和绿豆的化感抑制结果基本吻合。这是因为同种植物中次生代谢物质种类相同,因而化感作用具有相似性,但植物不同器官中化感物质含量不同,根的水浸提液对小麦发芽率的抑制要强于种子浸提液[12]。
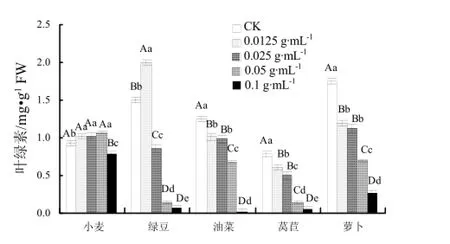
图2 不同浓度水浸提液对叶绿素含量的影响Fig. 2 Effects of water extracts of Mirabilis himalaica on content of chlorophyll of five plants
化感作用下植物细胞内原有自由基的产生和清除平衡被打破,导致自由基积累和膜脂过氧化,使膜系统结构受到损伤,细胞正常生理功能受到影响或破坏,这是化感作用造成细胞伤害的重要原因之一[32]。刘成等[33]研究芦苇叶水浸提液对入侵植物加拿大一枝黄花的化感效应时发现,低浓度芦苇叶水浸提液处理时, POD和SOD酶活性随处理时间延长持续上升,当浓度继续升高二者则均呈先升高后降低之势,CAT酶活性和MDA含量随浸提液浓度升高而上升。本研究中,随着浸提液浓度的升高,5种受试植物体内MDA含量急剧升高,SOD、POD和CAT等抗氧化酶活性表现为先增高后降低或持续降低的趋势。这表明受试植物经喜马拉雅紫茉莉根水浸提液处理后,细胞膜脂过氧化产物MDA积累,导致细胞膜系统和抗氧化酶系统破坏,进而降低抗氧化酶活性,影响细胞清除自由基的能力,使细胞丧失抵御浸提液伤害的能力。韩志军等[34]在研究花椒叶浸提液对大豆种子萌发和幼苗生长的化感作用时也发现类似结果。
逆境胁迫往往会导致植物光合色素的降解从而抑制光合作用的进行,植物化感作用的相关研究也有类似报道。用浓度为5.0%和10.0%的芦苇叶浸提液处理加拿大一枝黄花时,叶绿素含量显著下降并随着处理时间的延长下降幅度增大[33]。随着喜马拉雅紫茉莉根浸提液浓度的升高,本实验5种受试植物叶片叶绿素含量均有不同程度的下降,表明喜马拉雅紫茉莉的化感作用可降低受试植物叶片中的叶绿素含量,从而减弱或抑制其光合作用,并通过抑制这一重要生命活动来影响植物的生长发育。
[1] 侯宽韶. 中国种子植物科属词典(修订本)[M]. 北京: 科学出版社, 1982.
[2] 卫生部药典委员会. 中华人民共和国卫生部药品标准.藏药[S]. 北京: 中华人民共和国卫生部, 1995: 104.
[3] Linghu L, Fan H, Hu Y, Zou Y, Yang P, Lan X, Liao Z, Chen M. Mirabijalone E: a novel rotenoid from Mirabilis himalaica inhibited A549 cell growth in vitro and in vivo[J]. Journal of Ethnopharmacology, 2014,155(1): 326—333.
[4] 郭其强,权红,兰小中,李连强,李慧娥. 药用植物喜马拉雅紫茉莉光合特性及影响因子分析[J]. 中国中药杂志,2014,39(14): 2769—2773.
[5] Zhang G L, Xing Q Y, Zhang M Z. Glycolipids from Mirabilis himalaica[J]. Phytochemistry, 1997,45: 1213—1215.
[6] 辛福梅,臧建成,兰小中. 喜马拉雅紫茉莉种子化感作用初探[J]. 中国园艺文摘, 2012,28(11): 22—24.
[7] Rice E L. Allelopathy[M]. Orlando, FL: Academice Press,1984.
[8] 邹妍琳,胡益杰,刘爽,令狐浪,兰小中,廖志华,陈敏. 喜马拉雅紫茉莉正丁醇提取物的化学成分[J]. 西北农业学报,2014,23(5): 202—206.
[9] Kong C H. Rice allelopathy[J]. Allelopathy Journal, 2008,22(2): 261—273.
[10] 游佩进,王文全,张媛,张红瑞,庞玉新,崔秀明. 三七连作土壤对三七、莴苣的化感作用[J]. 西北农业学报, 2009,18(1):139—142.
[11] Yan Z Q, Guo H R, Yang J Y, Liu Q, Jin H, Xu R, Cui H, Qin B. Phytotoxic flavonoids from roots of Stellera chamaejasme L. (Thymelaeaceae)[J]. Phytochemistry, 2014,106: 61—68.
[12] 银福军,瞿显友,曾纬,舒抒. 黄连不同部位水浸液自毒作用研究[J]. 中药材, 2009,32(3): 329—330.
[13] Haq R A, Hussain M, Cheema Z A, Mushtaq M N, Farooq M. Mulberry leaf water extract inhibits bermudagrass and promotes wheat growth[J]. Weed Biology and Management, 2010,10(4): 234—240.
[14] 雷锋杰,张爱华,方斯文,张连学. 人参根系分泌物对4种药用植物的化感作用研究[J]. 中国农学通报, 2010,26(19):140—144.
[15] Giannopolitis C N, Ries S K. Superoxide dismutases: I. Occurrence in higher plants[J]. Plant Physiology, 1977,59(2):309—314.
[16] 章家恩. 生态学常用实验研究方法与技术[M]. 上海: 化学工业出版社, 2007.
[17] 李合生. 植物生理生化实验原理和技术[M]. 北京: 高等教育出版社, 2000.
[18] 张宪政,苏正淑. 几种测定植物叶绿素含量的方法比较[J]. 植物生理学通讯, 1989(5): 77—78.
[19] 郭忠录,蔡崇法,郑珉娇. 紫穗槐茎叶水浸液对大豆和蚕豆的化感作用[J]. 华中农业大学学报, 2010,29(4): 452—456.
[20] 孔垂华,胡飞,陈雄辉,陈益培,黄寿山. 作物化感品种资源的评价利用[J]. 中国农业科学, 2002,35(9): 1159—1164.
[21] Duke S O. Allelopathy: Current status of research and future of the discipline: A Commentary[J]. Allelopathy Journal,2010,25(1): 17—29.
[22] Meiners S J, Kong C H, Ladwig L M. Developing an ecological context for allelopathy[J]. Plant Ecology,2012,213(12): 1861—1867.
[23] Blanco J A. The representation of allelopathy in ecosystem-level forest models[J]. Ecological Modelling, 2007,209(2-4): 65—77.
[24] Khanh T D, Xuan T D, Chung I M. Rice allelopathy and the possibility for weed management[J]. Annals of Applied Biology, 2007,151(3): 325—339.
[25] Ozcatalbas O, Brumfield R. Allelopathy as an agricultural innovation and improving allelopathy extension[J]. Journal of Food Agriculture & Environment, 2010,8(2): 908—913.
[26] Peng S L, Chen Z Q, Wen J. Is allelopathy a driving force in forest succession?[J]. Allelopathy Journal, 2004,14(2): 197—204.
[27] Macias F A, Molinillo J M G, Varela R M.Allelopathy-a natural alternative for weed control[J]. Pest Management Science, 2007,63(4): 327—348.
[28] Farooq M, Bajwa A A, Cheema S A. Application of Allelopathy in Crop Production[J]. International Journal of Agriculture and Biology, 2013,15(6): 1367—1378.
[29] 苏文华,张光飞,李秀华,欧晓昆. 植物药材次生代谢产物的积累与环境的关系[J]. 中草药, 2005(9): 139—142.
[30] Callaway R M. Experimental designs for the study of allelopathy[J]. Plant and Soil, 2003,256(1): 1—11.
[31] 胡远彬,陈俊,肖天昊,呼天明,许岳飞. 劲直黄芪水浸提液化感作用研究[J]. 草业学报, 2013,22(6): 136—142.
[32] 李键,刘奕,洪滔,林勇明,吴承祯,洪伟. 2种化感成分对木麻黄幼苗小枝活性氧含量和保护酶活性的影响[J]. 植物资源与环境学报, 2013,22(2): 30—38.
[33] 刘成,陈晓德,吴明,贺丽,叶小齐,范庭兴. 芦苇叶片化感作用对加拿大一枝黄花生长及生理生化特性的影响[J]. 草业学报, 2014,23(3): 182—190.
[34] 韩志军,陈静,郑寒,马建华,吴瑜,冯鹏真,周建平. 花椒叶浸提液对大豆种子萌发和幼苗生长的化感作用[J]. 应用与环境生物学报, 2011,17(4): 585—588.
Allelopathy of Water Extracts from Root of Mirabilis himalaica on Five Speices of Plants
MA Shi-yao1, LIU Sheng-li1, CHEN Yu-zhen1, LU Cun-fu1, LAN Xiao-zhong2
(1.College of Biological Sciences and Biotechnology, Beijing Forestry University, Beijing 100083, China; 2.College of Food Science, Agricultural and Animal Husbandry College of Tibet University, Linzhi 860000, Tibet China)
To investigate the allelopathic effects of Mirabilis himalaica root, which was picked from Tibet Nyingchi region, on crop and vegetable plants, different concentrations (0.0125, 0.025,0.05, 0.1 g·mL-1) of water extracts were used as treatment solutions to asses their effects on seed germination and seedling growth of five plant species (wheat, mung beans, lettuce, rape, and radish). The results showed that with the increase of the concentration of aqueous extract, the seed germination and seedling growth of the five plants were inhibited. Accordingly, antioxidant enzyme activity and chlorophyll content decreased, while the content of malondialdehyde was significantly increased. Allelopathic effects indicated that the underground part was more sensitive to the M. himalaica root water extracts than the aboveground part of the five plants. The results also conformed that allelopathic effects were species-specific and concentration- dependent. The sensitivity order was as follows: lettuce> mung beans> wheat> radish> rape.
Mirabilis himalaica; allelopathy; seed germination; seedling growth; antioxidant enzyme
10.3969/j.issn.1009-7791.2015.01.006
Q948
A
1009-7791(2015)01-0029-07
2015-01-14
国家科技支撑项目(2011BAI13B06)资助
马世尧,硕士研究生,从事植物化感作用研究。E-mail: xiaomashiyao@163.com
注:卢存福为通讯作者。E-mail: lucunfu@bjfu.edu.cn

