分子探针:提速癌症诊断的新工具
贺晓鹏
结构可控先进功能材料及其制备教育部重点实验室,华东理工大学化学与分子工程学院,上海 200237
*论著——精准医疗*
分子探针:提速癌症诊断的新工具
贺晓鹏
结构可控先进功能材料及其制备教育部重点实验室,华东理工大学化学与分子工程学院,上海 200237
癌症的快速、准确血液诊断是国际生命健康领域亟待解决的科学问题。然而,现有临床诊断技术存在操作流程繁复、技术要求高、耗时长且成本昂贵等缺陷。发展可用于快速捕捉血液癌标志物的简易、经济型诊断新工具逐渐成为国内外学术研究热点。分子探针具备构建简易、响应快、成本低的优势,其传统应用领域为环境检测与细胞、活体标记等。近年来,灵敏探测血液癌标志物的分子探针创制,形成了一个多学科交叉的新兴领域。该文简要综述了相关领域研究团队对此类分子探针的构筑策略,并结合相关癌标志物的“快速检测”实例展现了探针的医学潜能,旨在为分子探针的多元化发展提供新的研究思路,期待通过独特化学技术与临床医学的有机结合,实现对癌症血液诊断的提速和低成本化。
癌症;血液标志物;分子探针;分子诊断;荧光
长期以来,癌症严重威胁着人类的生命健康。由于人类对癌症的发生、发展及复发机制尚未有系统性认识,而传统的临床手术、放化疗法和近年兴起的免疫治疗技术尚需完善,癌症仍是全球致死率最高的人类重大疾病之一[1]。癌症的早期诊断与治疗可显著提高患者的生存期,但受临床癌标志物特异性不高,尤其是现有癌检测手段技术繁复、耗时长、原材料昂贵等局限,癌的精准、快速诊断仍是生命科学领域亟待解决的关键科学问题。因此,开发简易、高效的癌症诊断工具,对于癌患者的术前化验、术中判断和术后监控具有重要意义。
癌细胞所分泌特异标志物的血液化验是目前大规模体检的首选技术,它不但可规避磁共振与活检等手段所带来的辐射、肌体创伤与高成本,还可为癌症的早期诊断提供高通量的普筛平台。然而,现有临床化验技术(如酶联免疫吸附测定、免疫发光、聚合酶链式反应等)具有一定的局限性,操作繁复(反复的孵育、封闭、扩增与洗涤步骤),耗时长且价格昂贵(需联用多种成本较高的抗体、基因序列等生化试剂)。于是,发展可更高效、快速捕捉血液标志物的经济型诊断工具,是当前学术界的研究热点。
区别于传统生化手段对待测物的标记需求,分子探针(即可用于研究与其余分子或结构相互作用的原子与分子)往往可“自带”一种“关开信号”,可经由与待测物的共价或非共价作用产生一种“免标记”(即无需对待测物进行标记)的信号改变,从而实现对待测物的定量分析。这一检测原理具备操作便捷、响应快、成本低等优势。分子探针的传统应用领域为环境检测与细胞、体内(荧光)标记等[2]。随着上述临床诊断学问题的日益凸显,构建可用于灵敏、快速捕捉血液癌标志物的分子探针,逐渐成为了一个独特的交叉学科研究方向,为传统的分子探针领域注入了新的活力。这一新兴方向涉及化学、化工与材料学家对分子探针的设计加工,同时涵盖生物与医学家对探针的临床实践与优化指导,通过多学科协同创新为人类的生命健康谋求福祉。
基于上述学科背景,该文从分子设计、合成与材料复合组装等方法学层面简要综述相关领域科研团队对癌标志物分子探针的构筑策略,并结合其相关临床样品“快速检测”实例展现此类探针的医学价值,期待通过独特分子工程技术与临床医学导向的有机结合,实现对血液癌标志物临床诊断的提速。
1 分子探针构建及血清癌标志物检测
1.1 分子探针构建策略概要
分子探针的组成主要包含一类可与待测物(生物小分子或大分子)产生特异相互作用的识别基团和一类可经由识别产生信号的报告基团。探针的作用模式可以是共价的化学反应,也可以是非共价的结合作用(图1):当识别基团与报告基团偶联后,后者的信号被关闭,随后经探针与标志物的快速结合打断关闭机制,报告基团的信号被“开启”。此外,还可通过分子组装手段获得材料复合型分子探针(图2):经由信号基团与一种特殊材料基底的组装形成复合探针材料,随后通过与标志物的识别产生信号。
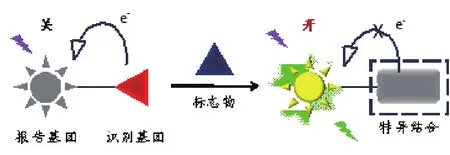
图1 小分子探针的标志物检测原理Fig. 1 Detection mechanism of small-molecule probes for biomarkers
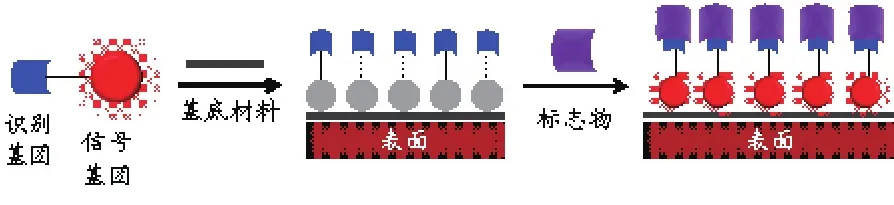
图2 材料复合分子探针的标志物检测原理Fig. 2 Detection mechanism of material-based molecular probes for biomarkers
1.2 小分子探针
α-酮戊二酸(α-KG)是体内代谢途径中重要的氮素运载体之一,与急性髓样白血病密切相关[3]。基于酮与肼的高反应活性,合成了含肼识别基团的荧光分子探针,通过分子内电荷转移机制淬灭荧光。当α-KG与肼反应后,探针的荧光被选择性开启,进一步应用微流池体系[4]与脂质体包裹策略[5]实现了对血清中α-KG的快速定量(10-20 min;图3a)。芳香胺N-乙酰转移酶2(NAT2)主要分布于肝脏与结肠,其功能紊乱与多种癌症相关[6]。为了屏蔽生物背景光,发展了一种可在近红外波段(>780 nm)发射荧光的分子探针,并引入芳香胺基团,通过电子转移机制淬灭荧光。当NAT2对探针的芳香胺位点进行乙酰化修饰后,探针荧光在短时内显著增强(图3a),应用这一探针初步实现了对肝组织匀浆中NAT2的荧光检测,将进一步验证其临床血液检测能力[7]。此外,还发展了一种稀土元素(Tb3+)配位的芳香胺衍生物,当发生NAT2催化的乙酰化作用后,探针可产生100倍的发光增强,且荧光寿命达到1 ms以上[8]。
除上述基于化学反应的分子探针,拓展了基于分子折叠的探针原型。环氧化酶-2(COX-2)的表达量可随癌症的进程而显著提升,但在正常组织内极少表达[9]。将一种可与COX-2高亲和力结合的抑制剂分子与荧光团通过长柔性链连接,构建了可在水环境中产生疏水折叠,并通过电子转移机制淬灭荧光的分子探针(图3b)。COX-2与抑制剂的结合可选择性快速展开分子折叠(30 min),产生强荧光发射。此类分子探针被应用于癌细胞与正常细胞的区分[10],以及癌组织、炎症组织和正常组织的荧光辨别[11],为荧光指导手术提供了新的方法,同时为癌患的COX-2血液检测提供了便捷工具。核酸是重要的生命信息分子,许多核酸物质也被认为是有效的肿瘤标志物。基于这一背景,设计合成了以多肽为核酸受体,含有双芘基团的堆叠为激基缔合物的折叠分子探针,通过与胞内核酸的结合,缔合物折叠被打开,产生单个芘基的荧光[12]。进一步构建了一种光致变色型折叠探针,当探针折叠时无法通过光照对其进行结构调控,而与核酸结合后探针不但荧光发生增强,且光致变色性能被激活,为核酸标志物的检测提供了多元化的信号输出[13]。
聚集诱导发光(AIE)是指将弱荧光的分子通过聚集诱导荧光增强[14]。利用这一机制,将可靶向识别癌细胞标志物蛋白(如溶酶体蛋白跨膜β4等)的多肽与可发射红光的AIE信号基团偶联,实现了对癌细胞表面跨膜受体标志物的靶向、短时检测(图3c)[15,16]。应用相同原理,构建了一种酶剪切型AIE探针,通过碱性磷酸酶对探针磷酸化部位的剪切游离AIE基团,从而实现聚集发光,探针还被验证可在血清中高灵敏检测上述标志物[17]。此外,利用超分子组装和多信号标记策略,实现了对肺癌潜在标志物神经激肽-1受体(NK1R)的血清检测。设计了一种磁/光两性的超分子多肽探针(图3d),当探针与NK1R识别后可从二维结构解聚成一维结构,从而释放荧光与磁性的双重信号[18]。利用荧光信号实现了对肺癌细胞表面NK1R的选择性标记,并进一步利用磁信号迅速地将肺癌患者的血清样本从正常人群中分离出来(2 min),为肺癌的诊断试剂发展提供了新的思路。

图3 小分子癌标志物探针工作原理示意图Fig. 3 Detection mechanism of small-molecule probes for cancer biomarkers
1.3 材料复合探针与器件
癌细胞通常会表达及分泌一些特殊的糖蛋白与糖蛋白受体,可作为癌症诊断的标志物。针对肝癌细胞表面脱唾液酸糖蛋白受体(ASGPr),设计构建了一系列荧光开启型与电化学活性探针体系。石墨烯是一种单原子厚度的碳材料,其独特的光电性能吸引了学术界广泛的研究兴趣[19]。利用石墨烯的荧光淬灭与分子富集效应,将糖荧光分子与石墨烯通过π-堆叠、静电作用等有序自组装,简易构筑了糖铺层分布,且荧光淬灭的石墨烯复合探针,应用此类探针实现了对于高表达ASGPr肝癌细胞的靶向特异性、短时荧光“关开”标记(30 min;图2)[20]。进一步发现可利用糖与ASGPr识别后的内吞效应,构建具备细胞靶向性的糖分子探针,用于细胞内容物的选择性探测[21,22]。还拓展应用此类荧光复合材料,实现了对阿尔茨海默症鼠脑切片的快速“免清洗”标记,标记时间(30 min)比传统免疫荧光标记技术降低24倍,标记成本降低1000倍[23]。同样,基于石墨烯与硫磺素的复合材料,实现了对鼠脑脊髓液中老年斑的荧光标记与光热治疗,即利用石墨烯的近红外光吸收性质,实现了此类材料对老年斑沉淀的降解[24]。
此外,构建了电活性基团标记的糖分子探针,并与一种石墨烯覆盖的自制丝网印刷电极复合,通过简便的电化学技术实现了对高表达ASGPr肝癌活细胞的灵敏捕捉[25,26]。值得注意的是,此类电化学器件仅需一台可携式电化学工作站联用一台个人笔记本电脑即可完成对癌细胞的检测,为癌症的家庭式小型化检测仪器发展提供了研发思路。端粒酶可通过对DNA复制的修复增加细胞分裂次数,且在绝大多数癌细胞中表达,是一种潜在的癌标志物。构建了一种基于卟啉与石墨烯的复合电极,并实现了对低至十个癌细胞中端粒酶的定量[27]。此外,通过荧光“关开”的方法实现了对端粒酶的检测,分别利用多孔硅纳米颗粒[28]与纳米金颗粒[29]为核心材料并负载荧光标记的核酸片段,得到荧光关闭的信号,随后通过端粒酶对核酸片段的催化延长(增加荧光团与核心材料的间距)恢复被淬灭的荧光。近期探索研究中,制备了糖分子层覆盖的金纳米颗粒,并应用颗粒与凝集素之间的识别效应,构建了一种糖基金颗粒与凝集素聚合的超分子结构,进一步通过凝集素与肝癌糖蛋白类标志物甲胎蛋白异质体(AFP-L3)的竞争结合解聚超分子体系,通过聚合—解聚过程的吸收光信号变化实现了肝癌患者血清的快速诊断(5 min),并实现了肝癌与肝炎病患和正常人血清的准确区分(未发表成果)。修饰的金纳米颗粒还可被用于监控肺癌病人所呼出的气体癌标志物,为癌症的快速、简易诊断提供了独特见解[30]。
2 结论与展望
随着临床需求的日益增长,发展可快速、准确对癌症进行血液诊断的经济型工具是当今多学科交叉的研究热点。血液诊断的优势在于规避影像学与组织活检等技术对于人体的创伤,并可高通量地对大规模样品进行筛查。然而现有技术存在操作繁、耗时长、成本高等显著缺陷,且国外技术垄断严重,于是发展我国自主知识产权的高效癌症诊断工具迫在眉睫。该文简要综述了相关领域科研团队近年来在发展癌标志物分子探针领域的研究进展。从小分子、超分子与材料复合探针等层面阐述了探针构建策略,进一步结合对癌标志物的检测实例展示了分子探针的快速检测性能。
分子探针的主要优势在于构建简易(合成与材料复合成本均低于现有生化试剂),免标记(无需对待测品反复免疫标记),尤其是响应快(最快几分钟内即可获得信号),有望成为新一代的疾病诊断工具,实现快速和低成本的癌症诊断。当然,目前所发展的分子探针原型仍有待系统性的临床实验验证,作者对分子探针的未来发展方向作如下展望:
(1)实现分子探针体系的标准化制备,有利于导向我国自主知识产权诊断试剂盒的研发;
(2)紧密与医学结合,进行临床的“多中心、大样本和双盲”血液化验,充分验证探针的医学价值;
(3)合理设立对照组,实现对于癌症的精准、快速诊断。
致谢 感谢田禾教授对于本文的提议与审核
(References)
[1] Siegel R, Ma J, Zou Z, Jemal A. Cancer statistics[J]. Ca: A Cancer Journal for Clinicians, 2014, 64:9-29.
[2] Kim H N, Guo Z, Zhu W, et al. Recent progress on polymer-based fluorescent and colorimetric chemosensors[J]. Chemical Society Reviews, 2011, 40:79-93.
[3] Ward P S, Patel J, Wise D R, et al. The common feature of leukemia-associated IDH1 and IDH2 mutations is a neomorphic enzyme activity converting α-ketoglutarate to 2-hydroxyglutarate[J]. Cancer Cell, 2010, 17:225-234.
[4] Jin P, Jiao C, Guo Z, et al. Rational design of a turnon fluorescent sensor for α-ketoglutaric acid in a microfluidic chip[J]. Chemical Science, 2014, 5:4012-4016.
[5] He Y, Guo Z, Jin P, et al. Optimizing the chemical recognition process at a fluorescent chemosensor for α-ketoglutarate[J]. Industrial & Engineering Chemistry Research, 2015, 54:2886-2893.
[6] Walker K, Ginsberg G, Hattis D, et al. Genetic polymorphism in N-acetyltransferase (NAT): population distribution of NAT1 and NAT2 activity[J]. Journal of Toxicology and Environmental Health, Part B, 2009,12:440-472.
[7] Wang X, Cui L, Zhou N, et al. A highly selective and sensitive near-infrared fluorescence probe for arylamine N-acetyltransferase 2 in vitro and in vivo[J]. Chemical Science, 2013, 4:2936-2940.
[8] Terai T, Kikuchi K, Urano Y, et al. A long-lived luminescent probe to selectively detect arylamine N-acetyltransferase (NAT) activity of cells[J]. Chemical Communications, 2012, 48:2234-2236.
[9] Tucker O N, Dannenberg A J, Yang E K, et al. Cyclooxygenase-2 expression is up-regulated in human pancreatic cancer[J]. Cancer Research, 1999, 59:987-990.
[10] Zhang H, Fan J, Wang J, et al. An off-on COX-2-specific fluorescent probe: targeting the Golgi apparatus of cancer cells[J]. Journal of the American Chemical Society.,2013,135:11663-11669.
[11] Zhang H, Fan J, Wang J, et al. Fluorescence discrimination of cancer from inflammation by molecular response to COX-2 enzymes[J]. Journal of the American Chemical Society,2013, 135:17469-17475.
[12] Wu J, Zou Y, Li C, et al. A molecular beacon for the ratiometric sensing of nucleic acids. Journal of the American Chemical Society[J]. 2012, 134:1958-1961.
[13] Liu K, Wen Y, Shi T, et al. DNA gated photochromism and fluorescent switch in a thiazole orange modified diarylethene[J]. Chemical Communications, 2014,50:9141-9144.
[14] Ding D, Li K, Liu B, et al. Bioprobes based on AIE fluorogens[J]. Accounts of Chemical Research, 2013,46:2441-2453.
[15] Huang Y, Hu F, Zhao R, et al. Tetraphenylethylene conjugated with a specific peptide as a fluorescence turnon bioprobe for the highly specific detection and tracing of tumor markers in live cancer cells[J]. Chemistry an European Journal, 2014, 20:158-164.
[16] Hu F, Huang Y, Zhang G, et al. Targeted bioimaging and photodynamic therapy of cancer cells with an activatable red fluorescent bioprobe. Analytical Chemistry, 2014,86:7987-7995.
[17] Liang J, Kwok RTK, Shi H, et al. Fluorescent light-up probe with aggregation-induced emission characteristics for alkaline phosphatase sensing and activity study[J]. ACS Applied Materials and Interfaces, 2013, 5:8784-8789.
[18] Wu J, Zou R, Wang Q, et al. A peptide probe for thedetection of neurokinin-1 receptor by disaggregation enhanced fluorescence and magnetic resonance signals[J]. Scientific Reports, 2014, 4:6487.
[19] Novoselov K S, Geim A K, Morozov S V, et al. Electric field effect in atomically thin carbon films[J]. Science,2004, 306:666-669.
[20] Zhang H L, Wei X L, Zang Y, Fluorogenic probing of specific recognitions between sugar ligands and glycoprotein receptors on cancer cells by an economic graphene nanocomposite[J]. Advanced Materials, 2013,25:4097-4101.
[21] Li K B, Zang Y, Wang H, et al. Hepatoma-selective imaging of heavy metal ions using a ‘clicked’galactosylrhodamine probe[J]. Chemical Communications,2014, 50:11735-11737.
[22] Shi D T, Zhou D, Zang Y, et al. Selective fluorogenic imaging of hepatocellular H2S by a galactosyl azidonaphthalimide probe[J]. Chemical Communications,2015, 51:3653-3655.
[23] He X P, Deng Q, Cai L, et al. Fluorogenic resveratrolconfined graphene oxide for economic and rapid detection of Alzheimer’s disease[J]. ACS Applied Materials and Interfaces, 2014, 6:5379-5382.
[24] Li M, Yang X, Ren J, et al. Using graphene oxide high near-infrared absorbance for photothermal treatment of Alzheimer’s disease[J]. Advanced Materials, 2012, 24:1722-1728.
[25] Li Z, Deng S S, Zang Y, et al. Capturing intercellular sugar-mediated ligand-receptor recognitions via a simple yet highly biospecific interfacial system[J]. Scientific Reports, 2013, 3:2293.
[26] He X P, Zhu B W, Zang Y, et al. Dynamic tracking of pathogenic receptor expression of live cells using pyrenyl glycoanthraquinone-decorated graphene electrodes[J]. Chemical Science, 2015, 6:1996-2001.
[27] Wu L, Wang J, Feng L, et al. Label-free ultrasensitive detection of human telomerase activity using porphyrinfunctionalized graphene and electrochemiluminescence technique[J]. Advanced Materials, 2012, 24:2447-2452.
[28] Qian R, Ding L, Ju H. Switchable fluorescent imaging of intracellular telomerase activity using telomeraseresponsive mesoporous silica nanoparticle[J]. Journal of the American Chemical Society[J]. 2013, 135:13282-13285.
[29] Qian R, Ding L, Yan L, et al. A robust probe for lighting up intracellular telomerase via primer extension to open a nicked molecular beacon[J]. Journal of the American Chemical Society[J]. 2014, 136:8205-8208.
[30] Peng G, Tisch U, Adams O, et al. Diagnosing lung cancer in exhaled breath using gold nanoparticles[J]. Nature Nanotechnology, 2009, 4:669-673.
《糖尿病新世界》杂志稿约

《糖尿病新世界》是国家卫生和计划生育委员会主管,全国卫生产业企业管理协会主办的专业性学术期刊,中国核心数据期刊(遴选)数据库收录期刊、中国期刊全文数据库收录期刊、中文科技期刊数据库收录期刊。国内统一刊号:CN 11-5019/R;国际刊号:ISSN 1672-4062,邮发代号82-120,定价10元。
本刊服务于医学创新研究、医疗事业改革和广大医疗工作者。坚持“创造性、科学性、指导性、实用性”的办刊方针,贯彻党和国家的卫生方针政策,贯彻理论、实践与交流相结合的方针。本刊长期面向全国征集医学学术论文,在本刊发表的论文可获得国家级继续教育学分。
【办刊宗旨】
本刊坚持“传播我国糖尿病医疗的重大成果,促进中外糖尿病领域的技术交流”为办刊宗旨,为有效提高我国糖尿病的诊治水平打造一个良好的传播和交流平台。
【主要栏目】
论著、医药论坛、卫生经济、医院管理、科研专栏、临床应用、护理天地、指南解读、病例报告、专题笔谈。
【读者对象】
医疗卫生科研院所、医学院校、医疗机构、药品企业、医疗卫生管理部门、社团组织和医药相关行业的科研、临床、医护、教育、管理人员为主要服务对象。
联系电话:010-65060551
投稿邮箱:bianjibu@tnbxsj.com
网 站:www.tnbxsj.com
Molecular probes: new-generation tools for the accelerated diagnosis of cancer
HE Xiaopeng
Key Laboratory for Advanced Materials & Institute of Fine Chemicals, School of Chemistry and Molecular Engineering, East China University of Science and Technology, Shanghai 20023
The rapid yet accurate diagnosis of cancer is a critical issue that poses a great challenge worldwide in the field of life science. However, current clinical biochemical techniques have flaws in terms of complicated conducting procedures, high technical requirement, long detection time and high cost. The development of simpler and more economic tools for the fast blood tests of cancer biomarkers has become a major focus of the academy. Molecular probes have merits in sensing applications owing to their conciseness in construction, fast response and low cost. Their conventional application areas involve environmental analysis and cellular/in vivo imaging. In recent years, the development of molecular probes suitable for probing cancer biomarkers has become a vividly new multidisciplinary research field. Here we summarize the construction strategies of these probes and highlight their diagnostic efficiency for cancer biomarkers. This article aims at spurring the diversification of simple and effective molecular probes for the detection cancer biomarkers, accelerating the progress of cancer blood tests by the combination of chemical techniques with medicinal science.
cancer; blood biomarker; molecular probe; molecular diagnosis; fluorescence
R730.58
A
10.11966/j.issn.2095-994X.2015.01.03.04
2015-07-30;
2015-10-01
国家重点基础研究发展计划(973计划)项目(2013CB733700)
贺晓鹏,副研究员,研究方向为医学导向的化学糖生物学,电子信箱:xphe@ecust.edu.cn
引用格式:贺晓鹏.分子探针:提速癌症诊断的新工具[J].世界复合医学,2015,1(3):207-211

