硅锰复合物的制备及其对铜的吸附性能
孙玉凤,张敬瑶,牛士冲,张维维,王 涛,李治学
(沈阳理工大学环境与化学工程学院,辽宁沈阳110159)
引 言
随着各种金属矿的开采、工业废水的排放、土壤中农药和化肥的大量使用及工业污泥的堆肥利用,使土壤中含铜量超出了原来浓度的几倍甚至几十倍,远远超出了土壤环境的承载力,严重影响到生态系统的稳定和环境的安全性及人类的健康[1-4]。
根据我国农业主管部门对全国污灌区开展的调查显示,在约140万公顷农田的污水灌区中,遭受重金属污染的农田污水灌溉区面积约占64.8%,其中轻度污染的农田面积占46.7%,中度污染的占9.7%,严重污染的占8.4%。所以,如何防治重金属对土壤的污染已经成为了我们急需解决的重要课题[5-6]。
锰氧化物是一种二维层状结构的纳米金属氧化物,具有独特的孔道或层状结构,比表面积大、表面活性强、电荷零点低、负电荷量高和对重金属元素有很强的吸附固定能力[7]。硅对植物来说是一种有益元素,对许多植物的正常生长起到了不可忽视的作用,有研究证明硅可以抑制植物对重金属的吸收,提高植物对毒害的耐受力[8-9]。也有研究者将含硅物质施于铜污染的土壤中,用于对土壤的修复作用[10-11]。本研究利用硅胶和锰氧化物两者各自优异的特性,制备成硅锰复合物,并模拟研究对土壤中重金属铜的吸附性能。
1 实验部分
1.1 仪器与试剂
TAS-990AFG原子吸收分光光度计(北京普析通用仪器有限责任公司);雷磁PHS-3C型PH计(上海精密科学仪器有限公司);SHA-C数显水浴恒温振荡器(上海江星仪器有限公司);101-2AB型电热鼓风干燥箱;BS-224S电子天平(北京赛多利斯仪器系统有限公司);TDL-40B飞鸽牌离心机(上海安亭科学仪器厂)。
硅胶(国药集团上海化学试剂有限公司);硫酸铜、硫酸、氢氧化钠、硫酸锰和无水乙醇等为市售分析纯试剂。
1.2 供试土壤及理化性状
供试土壤采自辽宁省沈阳市新民,为种植水稻多年的水田土壤,每年3~4月份采土,采样深度为0~20cm,采集来的土壤在阴凉无污染处自然风干,风干后去除其中的杂质,研磨后过250μm筛网,装入广口瓶中备用。
土壤基本理化性状采用常规方法测定。土壤中有机质的测定采用GB9834-88方法;土壤pH的测定采用NY/T1121.2-2006方法;土壤有效硅采用0.025mol/L柠檬酸作浸提剂,硅钼蓝比色法测定;土壤中的铜采用盐酸-硝酸-氢氟酸-高氯酸全分解,原子吸收分光光度法测定[12]。土壤基本理化性质如表1所示。
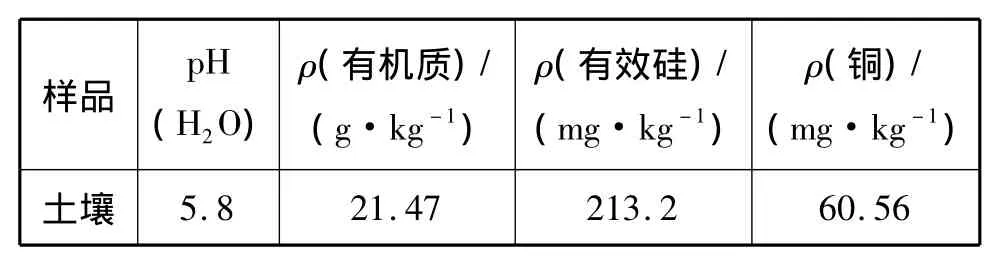
表1 供试土壤的基本理化性状
1.3 吸附剂硅锰复合物的制备
称取1.5g的硅胶,放入200mL 1mol/L的硫酸溶液中,在40℃的恒温水浴锅中平衡4h,取出后用去离子水洗涤至中性,放入烘干箱内,在80℃下烘干8h,取出后的硅胶即为活化的硅胶。配制1000mL 8%的硫酸锰溶液,将活化后的硅胶放入溶液中,搅拌2h,在25℃恒温水浴锅重平衡48h,弃去溶液,用蒸馏水洗涤至滤液无SO42-(用 0.2mol/L氯化钡溶液检验滤液)。将剩余硅胶放入烘箱中,在80℃下烘干4h,最后在马弗炉350℃烘烤2h,即得到硅锰复合物。
1.4 硅锰复合物对铜的吸附实验
配制一系列浓度为0.000~0.050mmol/L铜标准溶液,用原子吸收分光光度计分别测定其吸光度,绘制浓度与吸光度之间的变化关系曲线,即标准曲线。
准确称取1.0000g土壤试样和一定量的硅锰复合物,加入到某一初始浓度CuSO4·5H2O溶液的100mL的离心试管中,定容至25mL。在设定温度下于恒温振荡器中振荡吸附,振荡一定时间后,用离心机以4000r/min离心分离10min,取上清液,用原子吸收分光光度计测定溶液中Cu2+的吸光度,根据标准曲线计算出吸附前后的浓度,然后计算Cu2+的吸附量(Qe)和去除率(η)。公式如下:

式中:Qe为吸附量,mmol/g;c0为溶液的初始浓度,mmol/L;ce为吸附后的溶液浓度,mmol/L;V为溶液体积,L;m为土壤的质量,g。
2 结果与讨论
2.1 硅锰复合物的红外表征
红外光谱分析采用Spectrum GX型傅里叶变换红外光谱仪(美国Perkin-Elmer公司)测定。测定方法采用溴化钾压片法。测量范围4000~400cm-1。扫描的硅锰复合物红外谱图如图1所示。
在图1中,3453cm-1为硅胶中羟基的伸缩振动吸收峰,1638cm-1为H-O-H的弯曲振动,这是由于硅胶吸收水分引起的,1095cm-1为Si-O-Si键的伸缩振动吸收峰,806cm-1和 464cm-1分别为 Si-O-Si键对称伸缩和弯曲振动引起的强吸收峰。可以发现,Si-O-Si键的伸缩振动吸收峰由1092cm-1(硅胶)变为1095cm-1(硅锰复合物),吸收峰波数升高了3cm-1,吸收峰波数升高说明Si-O键的强度下降,这可能是由于在制备吸附剂过程中硅胶与二氧化锰结合形成了Si-O-Mn新化学键,同时削弱了Si-O键和Mn-O键。实验时有利于铜离子在吸附剂表面的吸附,提高了吸附活性,说明吸附剂有效成分二氧化锰与硅胶载体之间确实是以化学键的形式相连,不是简单的机械混合。
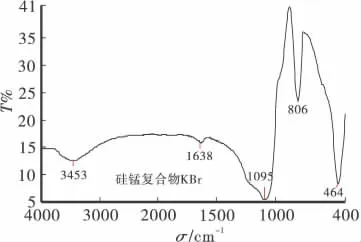
图1 硅锰复合物的红外谱图
2.2 硅锰复合物对铜的吸附性能
2.2.1 吸附剂用量对吸附性能的影响
按实验1.4方法所述,准确称取1.0000g土壤和不同质量(0.03、0.05、0.10、0.15 和 0.20g)的硅锰复合物,在 Cu2+浓度为0.8mmol/L、θ为25℃、pH为5.5及振荡2h的条件下,考察硅锰复合物的用量对溶液中Cu2+吸附效果的影响,如图2所示。
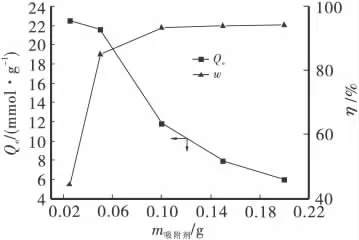
图2 吸附剂用量对铜吸附效果的影响
随着硅锰复合物用量的增多,Cu2+的吸附量增大,平衡时Cu2+浓度降低。当硅锰复合物减少用量时,吸附剂没有足够的吸附点位吸附Cu2+而使其吸附率下降,而硅锰复合物用量增加到一定数量时,铜基本全被吸附,故平衡时Cu2+浓度变化不大。当硅锰复合物用质量为0.05g时,铜的平衡吸附量和去除率均符合要求,铜的吸附量和去除率分别能达到21.59mg/g和85%。为保证实验中有满意的吸附效果及较少的吸附剂用量,硅锰复合物的质量确定为0.05g。
2.2.2 溶液pH对吸附性能的影响
按实验1.4方法所述,图3为0.05g吸附剂加入到铜浓度为0.8mmol/L、θ为25℃、不同pH条件下(0.1mol/L的 H2SO4和 NaOH溶液调节),铜的吸附性能影响。
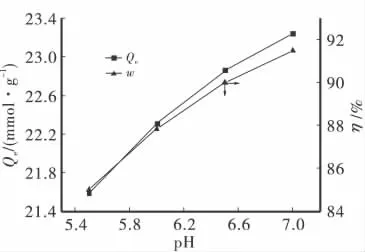
图3 pH对铜吸附效果的影响
如图3所示,铜溶液的 pH为5.5~7.0范围内,随着pH增大,铜的平衡吸附量和去除率逐渐上升,表明pH越高越有利于吸附剂对铜的吸附。因为当pH大于5.7以后,Cu2+易发生水解而使吸附量升高。因此,在pH为7.0左右时,吸附量及去除率较pH为5.5时上升很多,最大吸附容量及去除率分别达到了23.241mmol/g及91.5%。考虑到Cu2+的水解问题,为了研究的需要,把pH的最佳值定为5.5。因此pH是影响铜在土壤中环境行为的关键因素,在碱性土壤溶液中更有利于硅锰复合物对铜的吸附。
2.2.3 吸附时间及温度对吸附量的影响
准确称取1.0000g土壤试样及0.05g硅锰复合物若干份,分别放入Cu2+浓度为0.8mmol/L溶液中,每间隔20min取一次样,测定平衡溶液中Cu2+的吸附量,并在25、35和45℃下分别进行实验,结果如图4所示。
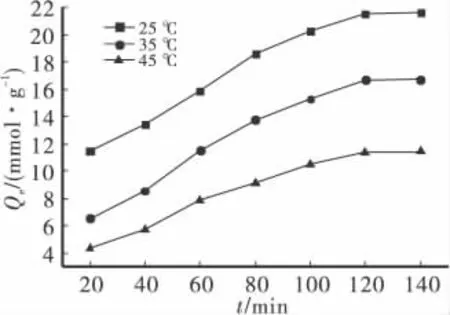
图4 吸附时间对铜吸附效果的影响
由图4可知,在相同的温度下,伴随着吸附反应时间的增多,Cu2+吸附量也在不同程度的增加。在吸附反应刚开始时,平衡溶液中Cu2+的浓度降得较快,后期基本不变。这可能是由于吸附首先发生在硅锰复合物的外层,吸附的点位比较多,外扩散阻力不大,在吸附剂表面电荷的作用下,离子自由移动速度较快。当吸附剂表面负离子吸附反应完成后,Cu2+需要迁移、扩散到吸附剂内部活性位上才能被吸附,但阻力较大,同时还受到外层离子电荷的排斥作用,这时吸附反应的速度降低了很多。当吸附到达2h以后,Cu2+的吸附速度逐渐降了下来,吸附反应基本完成。当吸附的时间相同时,随着吸附温度的升高,吸附量下降,可以认为硅锰复合物对Cu2+的吸附为放热过程,是物理吸附与化学吸附并存的吸附过程[13]。在25℃时,吸附速率高于其它两个温度的反应速率,易于达到吸附平衡。
2.2.4 硅锰复合物对铜的吸附等温线
配制不同浓度的Cu2+溶液,调节pH为5.5,分别取0.05g吸附剂于各溶液中,吸附t为2h的条件下,考察硅锰复合物对铜的吸附情况,如图5所示。
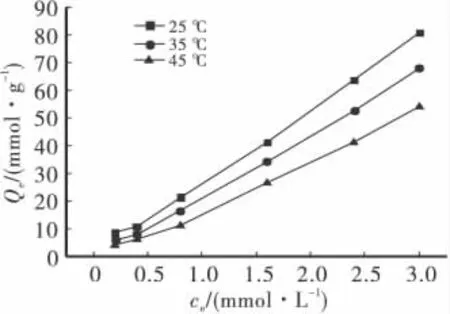
图5 硅锰复合物对铜的吸附等温线
Langmuir方程表达式:

式中ce为平衡时的吸附浓度,mmol/L;Qe为吸附量mmol/g;Qm为单层饱和吸附量mmol/g;b为吸附平衡常数,L/mmol。
Freundlich方程线性化表达式:

式中:K和n是相关常数。
Temkin方程线性化表达式:

式中:K1和K2是相关常数。
由图4可知,在三种不同温度下,随着Cu2+初始浓度的增大,吸附量都随之增大,θ为25℃时吸附量最高,45℃时吸附最低,说明温度升高不利于吸附反应的发生,此吸附反应是放热过程。用Langmuir、Freundlich和Temkin模型对实验数据进行拟合,结果列于表1。由表1可以看出,三种温度下,三种方程的相关系数在0.93130~0.99997之间,均达到显著水平;其中以Freundlich方程效果最佳。
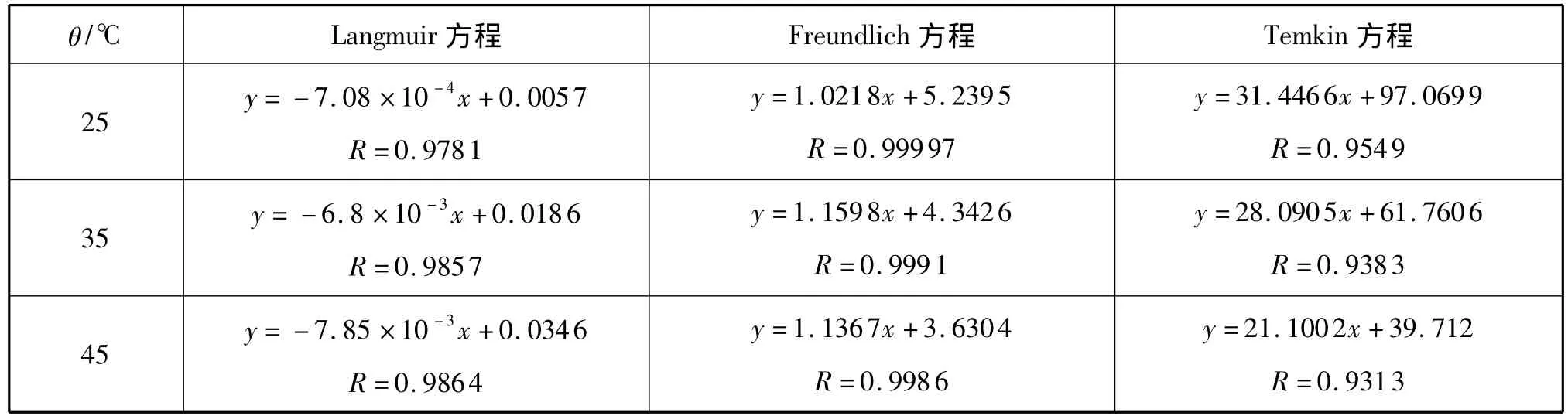
表2 硅锰复合物对铜的等温吸附方程参数
3 结论
1)硅锰复合物对土壤溶液中Cu2+吸附的最佳工艺条件为:0.05g硅锰复合物,Cu2+浓度为0.8mmol/L,θ为25℃,pH 为 5.5,吸附 t为2h。
2)硅锰复合物对Cu2+的吸附反应为放热反应,吸附过程中物理吸附与化学吸附并存,吸附量随着温度的升高而降低,吸附模型符合Freundlich吸附等温线。
[1]Brun L A,Mailiet J,Hinsinger P,et al.Evaluation of copper availability to plants in copper contaminated vineyard soils[J].Environmental pollution,2001,111:293-302.
[2]Yruela.Copper in plants[J].Brazilian Journal of Plant Physiology,2005,17:145-156.
[3]刘军,谢吉民,初亚飞,等.土壤中铜污染研究进展[J].安徽农业科学,2008,36(17):7422-7423.
[4]陈怀满.环境土壤学[M].北京:科学出版社,2005:5-6.
[5]张伟红.重金属离子吸附材料与应用研究〔D〕.山东:山东大学硕士学位论文,2009:5-12.
[6]王秀丽,徐建民,谢正苗,等.重金属铜和锌污染对土壤环境质量生物学指标的影响[J].浙江大学学报,(农业与生命科学版),2002,28(2):190-194.
[7]Fu G,Allen H E,Cowan C E.Adsorption of cadmium and eoPPer by manganese dioxide[J].soil Sei,1991,152:72-81.
[8]Wang L J,Wang Y H.Silicon induced cadmium tolerance of rice seedlings[J].Journal of plant nutrition,2000,23(10):1397-1406.
[9]杨超光,豆虎,梁永超,等。硅对土壤外源镉活性和玉米吸收镉的影响[J].中国农业科学,2005,38(1):116-121.
[10]张毓平.硅酸钙对土壤Cd、Pb、Cu、Zn复合污染修复效应初探〔D〕.广州:中山大学硕士学位论文,2010:7-9.
[11]李艳利,王厚鑫,张玉龙,等.外源硅对土壤镉吸附特性的影响[J].生态环境,2007,16(2):446-448.
[12]鲍士旦.土壤农化分析[M].第3版.北京:农业出版社,2000:128-132.
[13]李瑞延,王金,郭腊梅,等.Cu2+与硅酸表面硅羟基的反应及其平衡常数[J].无机化学学报,1996,12(3):50-54.

