Nrf2/Keap1-ARE通路与心肌缺血再灌注损伤
丁士骜(综述) 梅举(审校)
Nrf2/Keap1-ARE通路与心肌缺血再灌注损伤
丁士骜(综述) 梅举(审校)
心肌缺血再灌注损伤(myocardial ischemia reperfusion injury,MIRI)是指心肌组织缺血后再恢复灌注,缺血心肌的损害不仅没有好转反而出现反常增加的现象[1]。MIRI是临床医生面临的一大难题[2-4]。由于心外科手术需要无血、相对静止的环境,在体外循环、心脏停跳下进行,而体外循环心脏停跳下手术则需要阻断心脏供血,注入停跳液促使心脏停跳,心脏上操作完成后再恢复心脏血供,促使心脏复跳,因此体外循环下心脏停跳过程就是一个缺血再灌注损伤的过程。在经历体外循环后的心脏病患者术后恢复过程及远期疗效很大程度与缺血再灌注损伤相关,所以MIRI的研究具有重要的意义。但MIRI损伤的病理生理机制是复杂的,到目前为止都还不完全清楚,亦缺乏有效的治疗策略[5]。
氧化应激是指机体组织或细胞内氧自由基增多或清除能力降低,导致活性氧(reactive oxygen species,ROS)在细胞内蓄积而引发的氧化损伤过程[6]。氧化应激长期以来被认为是开始MIRI损伤的一个关键因素,与MIRI的发生密切相关。虽然动物研究表明,氧化应激参与MIRI损伤过程,但是在人类的研究还比较少见,使用抗氧化剂的临床干预研究的效果也没有明确的结论[7]。
氧化应激反应和转录因子-核因子相关因子2(Nrf2)密切相关[8]。Nrf2/Keap1-ARE通路是目前为止发现的最为重要的内源性抗氧化应激通路,在心血管系统中的分布非常广泛,诱导激活后可上调内源性抗氧化系统,从而减轻心肌的氧化损伤[9]。同时Nrf2是氧化应激的感受器,在参与细胞调节抗氧化应激中发挥关键作用,是抗氧化应激的重要转录因子[10]。本文就Nrf2/Keap1-ARE通路与心肌缺血再灌注损伤的相关研究进展作一综述。
1 Nrf2与Keap1结构与功能
1.1 Nrf2结构与功能 Nrf2是CNC-bZIP(cap‘n’collar subfamily of basic leucinezipper)即CNC亮氨酸拉链转录激活因子家族成员中活力最强的转录调节因子,几乎在各种细胞内都可表达。它可与DNA的NF-E2区结合[11]。NF-E2区包含抗氧化反应原件ARE序列(GTGACTCAGCA),含有6个不同的功能区,分别被命名为Neh 1~6[12]。其中Neh1结构中有一个亮氨酸拉链结构(bZIP),它与小Maf蛋白(包括MafG、MafK、MafF)形成异二聚体结构,是Nrf2识别抗氧化应答元件(ARE)上DNA碱基序列并与之结合的重要前提,也是启动目标基因转录的重要基础[13]。Neh2区是Nrf2与胞浆蛋白Keap1结合区,同时Neh2区对亲电子试剂、抗氧化剂具有高度敏感性[14]。Nrf2与抗氧化应答元件ARE协同调节重要的抗氧化基因Ⅱ相解毒酶基因,Ⅱ相解毒酶包括血红素氧合酶(HO-1)、谷胱甘肽转移酶(GST)、过氧化氢酶(CAT)、超氧化物歧化酶(SOD)、NAD(P)H醌类氧化酶等,它们通过多种协同作用构成细胞内的抗氧化防御系统,共同清除ROS,维持细胞内氧化还原电位平衡[15]。
1.2 Keap1结构与功能 Keap1是一个与胞浆肌动蛋白结合的多肽,富含半胱氨酸残基,其624个氨基酸中具有25个半胱氨酸,且这些半胱氨酸序列在人类、大鼠和小鼠的基因组中高度保守,共含5个区[11]。其中DGR区是Keap1与Nrf2中Neh2的结合位点,同时也是Keap1与胞浆内肌动蛋白的结合区位。BTB′POZ区是与肌动蛋白和转录因子中锌指结构域相互作用,能够介导Keap1二聚体化并且与Keap1-Nrf2的结合有关[16]。干预区域(IVR)含有25个半胱氨酸,在IVR的半胱氨酸残基会引起DGR或Keap1分子的构象发生变化,导致Nrf2从Keap1解离,并且这种富含的半胱氨酸基团很可能作为氧化应激的主要传感器分子[17]。
2 Nrf2′Keap1的激活及调节机制
如图1所示,在生理状态下,内生Nrf2消除是相当快的,绝大部分Nrf2在细胞质中以非活性状态和Keapl相结合,通过泛素化方式降解。常态下Keap1在胞质中锚定于肌动蛋白,促使胞质内的Nrf2持续泛素化并被蛋白降解,抑制Nrf2从胞质转移到核内[18]。ROS使Keap1和Nrf2磷酸化,导致丝裂原活化蛋白激酶(MAPK,ERK,p38)、蛋白激酶C(PKC)、磷脂酰肌醇激酶3(PI3K)和其他蛋白质激活,Keap1从Kaep1-Nrf2复合物中解离,Nrf2的活性增加,有转录活性的Nrf2易位到细胞核内,与Maf蛋白形成杂化二聚体[19],然后与ARE启动子部位结合,启动Nrf2下游靶基因即过氧化氢酶(CAT)、超氧化物歧化酶(SOD)、谷胱甘肽硫转移酶(GST)、醌氧化还原酶(NQO1)、血红素加氧酶(HMOX1)等的表达,而这些蛋白可以抑制氧化应激损伤,故Keap1对Nrf2功能起负性调控作用[20]。目前发现真核细胞内几乎所有的抗氧化蛋白均受到Nrf2的调控。近年来国外研究表明,Nrf2表达水平异常或其转录活性受损与心肌缺血再灌注损伤的发生密切相关[7]。
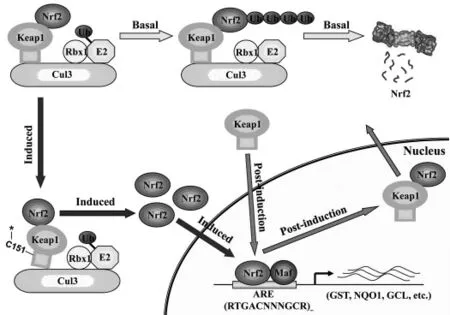
图1 Nrf2-Keap1-ARE信号通路调节机制示意图
3 氧化应激与心肌缺血再灌注损伤
以往的研究发现,心肌组织血流供应的减少和血流再灌注是导致组织缺血损伤的主要影响因素。典型的例子就是心脏体外循环手术。因此,尽快恢复血流供应是缺血后的首要临床目标。然而,缺血区域血流的快速恢复又导致损伤程度的增加,原因就是在缺血初期有氧化应激的损伤[21]。
心肌组织在缺血时特别容易损伤,因为心肌细胞在正常血流灌注时氧的摄入在80%左右,所以当动脉血流严重匮乏时,心肌细胞再也无法显著提高氧的摄入,导致缺血后心肌的损伤较其他组织更为严重[5]。当血流恢复时,大量的炎症反应会显著提高氧化应激,超过原有的抗氧化防御系统的防御能力,心肌细胞损伤或死亡,最后影响心功能[22]。而目前的研究发现,真核细胞内几乎所有的抗氧化蛋白均受到Nrf2的调控,这样的氧化应激过程使Nrf2成为保护心肌免受缺血再灌注损伤的最佳候选靶点[23]。
在H9c2细胞模型中,模拟缺血再灌注(10小时缺氧,16小时复氧)导致细胞内ROS水平明显增加。在相同条件下,使用Ⅱ相抗氧化酶诱导剂D3T处理大鼠心肌细胞,细胞内的ROS水平明显减少。在这些细胞中Nrf2 mRNA和蛋白表达增加,这表明Nrf2可能缺血再灌注后细胞内ROS的水平控制非常重要。相反,单纯阻塞大鼠心脏左冠状动脉前降支30分钟后Nrf2核蛋白的表达减少。这些实验表明Nrf2具有启动抗氧化防御系统应对再灌注引起的氧化应激损伤的作用[24]。
Nrf2的快速激活已被证实能够减少心肌缺血再灌注的损伤。国内外对于Nrf2通路保护心肌细胞的实验已有一些报道。Mukherjee等[19]在西兰花中提取莱菔硫烷等硫氧化还原蛋白,建立心肌缺血再灌注模型后,灌胃给予莱菔硫烷后能减少心肌梗死面积,同时发现心肌细胞中HO-1(已知的Nrf2应答基因)的表达水平明显增高,这说明莱菔硫烷能诱导心肌细胞Nrf2应答基因的表达。Calvert等[25]用H2S在心脏缺血再灌注前进行预处理,建立模型后发现心肌梗死面积、肌钙蛋白I和氧化应激的水平均出现不同程度的下降,试验中不仅仅是Nrf2的早期激活增加,心肌细胞中的HO-1和氧化还原蛋白(TRX1)的水平也增加,说明在心肌缺血损伤的抗氧化应激机制中,Nrf2的作用非常显著。张扬等建立体外Langendorff灌流模型,利用较高浓度的4-HNE处理心肌细胞,结果显示4-HNE能够诱导Nrf2的表达并转移到细胞核内,并增强谷氨酰半胱氨酸连接酶γ(GCL)的表达,使得GSH的表达与对照组比较有显著提高。而体内实验中,予以4 mg/ kg的4-HNE静脉注射实验小鼠,结果显示小鼠心肌细胞的GSH水平明显升高,左心功能恢复更加迅速;相比而言,Nrf2基因敲除小鼠中未观察到这种4-HNE的心肌保护作用[26]。另外,Sussan等[27]的实验证实三萜CDDO咪唑能通过增强Nrf2的表达起到心肌保护的作用。邓超等[28]的研究证实α-硫辛酸通过Nrf2通路对心肌缺血再灌注损伤起到保护作用。我国的传统中药在心肌缺血再灌注损伤的保护方面潜力很大,崔振国等[5]在大鼠心脏H9c2细胞和人类胚胎干细胞来源的心肌细胞(hESC-CMs)中建立心肌缺氧复氧模型,予以黄芩素处理,证明了黄芩素可有效减轻再灌注后的氧化应激,提高了大鼠心肌对抗I/R损伤的能力,两种细胞内的Nrf2和HO-1的表达增加,同时黄芩素可破坏Nrf2与Keap1形成复合体,Nrf2的核转位增加,然而Nrf2的干扰小RNA(siRNA)转染可以阻止黄芩素的保护作用。这些研究的实验结果均得出相似的实验结论,Nrf2的诱导物在发挥心肌保护的过程中,不仅仅诱导增强Nrf2的表达与转位到核内,同时还能增强与Nrf2相关产物如HO-1、GSH、TRX等的表达。
4 Nrf2与心肌缺血再灌注损伤临床研究展望
心肌缺血再灌注损伤的研究已经进行了几十年,各种干预措施也已被证明能降低动物心肌梗死面积;然而,这些干预措施却不能很好地应用于人类。Nrf2的诱导剂如莱菔硫烷、硫化氢、三萜CDDO咪唑和CO对心肌有保护作用,还有我国的传统中药,在动物模型中均证明有心肌保护的作用,但是他们都缺乏临床应用的安全数据,可能临床疗效并不确定,结果也难以控制[29]。Kappos等[30]将口服的细胞保护剂——延胡索酸成功应用于银屑病或多发性硬化症患者的Ⅱ期临床试验,证实了口服延胡索酸及其衍生物(FADs)在抗氧化应激的治疗中是确实有效的,也是安全的,且此类FADs亦是人体内已有的物质,参与体内三羧酸循环,副作用小,这为我们研究此类药物在其他疾病中的作用提供了强有力的依据,例如评估FADs在急性冠脉综合征和实行心脏手术后引起的心肌损伤的保护作用。Ashrafian等[31]研究发现敲除延胡索酸水化酶基因的小鼠比野生型小鼠更不易遭受心肌缺血再灌注的损伤,同样,外界给予正常小鼠延胡索酸亦能起到心肌保护作用,但是敲除Nrf2基因后,延胡索酸的保护作用的减弱具有统计学差异,肯定了延胡索酸通过Nrf2-ARE通路的心肌保护作用。所以,FADs是安全可靠的心肌保护的物质,在延胡索酸类似物中探寻更加安全高效的心肌保护药物具有重要的临床意义,值得我们进一步研究,同时Nrf2/ ARE信号通路的激活亦有望成为心肌缺血再灌注损伤治疗的新靶点。
[1] Rodrigo R,Prieto JC,Castillo R.Cardioprotection against ischaemia/reperfusion by vitamins C and E plus n-3 fatty acids:molecularmechanisms and potential clinical applications.Clin Sci(Lond),2013,124:1-15.
[2]张苗苗,于海奕,高炜.心肌缺血后适应的保护作用及机制研究进展.中国心血管病研究,2012,10:704-707.
[3]唐丽敏,贺永贵,张义东,等.心肌缺血/再灌注损伤发生机制及其保护研究进展.中国煤炭工业医学杂志,2013,17:159-162.
[4]陈辉,刘国华,裴莉.动态心电图结合CT血管造影对无痛性心肌缺血的诊断价值.中国医药,2012,7:805-806.
[5]Cui G,Chui WLS,Li RA,et al.Cytoprotection of Baicalein Against Oxidative Stress-induced Cardiomyocytes Injury Through the Nrf2/Keap1 Pathway.J Cardiovasc Pharmacol,2015,65:39-46.
[6]de Vries DK,Kortekaas KA,Tsikas D,et al.Oxidative damage in clinical ischemiareperfusion injury a reappraisal.Antioxid Redox Signal,2013,19:535-545.
[7]Gurusamy N,Goswami S,Malik G,et al.Oxidative injury induces selective rather than global inhibition of proteasomal activity.JMol Cell Cardiol,2008,44:419-428.
[8] Braunersreuther V,Jaquet V.Reactive Oxygen Species in Myocardial Reperfusion Injury From Physiopathology to Therapeutic Approaches.Curr Pharm Biotechnol,2012,13:97-114.
[9]Chan K,Lu R,Chang JC,et al.NRF2,a member of the NFE2 family of transcription factors,is not essential for murine erythropoiesis,growth,and development.Proc Natl Acad Sci USA,1996,93:13943-13948.
[10]Hayes JD,Dinkova-Kostova AT.The Nrf2 regulatory network provides an interface between redox and intermediary metabolism.Trends Biochem Sci,2014,39:199-218.
[11] Hayes JD,McMahon M.NRF2 and KEAP1 mutations:permanent activation of an adaptive response in cancer.Trends Biochem Sci,2009,34:176-188.
[12]Moi P,Chan K,Asunis I,et al.Isolation of NF-E2-related factor 2(Nrf2), a NF-E2-like basic leucine zippertranscriptional activator that binds to the tandem NF-E2/AP1 repeat of the beta-globin locus control region.Proc Natl Acad Sci USA,1994,91:9926-9930.
[13]Motohashi H,Katsuoka F,Engel JD,et al.Small Maf proteins serve as transcriptional cofactors for keratinocyte differentiation in the Keap1-Nrf2 regulatory pathway.Proc Natl Acad Sci USA,2004,101:6379-6384.
[14]Dayalan NS,Kostov RV,Dinkova-Kostova AT.Transcription factors Hsf1 and Nrf2 engage in crosstalk for cytoprotection. Trends Pharmacol Sci,2015,36:6-14.
[15]Cai C,Teng L,Vu D,et al.The heme oxygenase 1 inducer(CoPP) protects human cardiac stem cells against apoptosis through activation of the extracellular signal-regulated kinase(ERK)/NRF2 signaling pathway and cytokine release.J Biol Chem,2012,287:33720-33732.
[16] Motohashi H, Yamamoto M.Nrf2-Keap1 defines a physiologically important stress response mechanism.Trends Mol Med,2004,10:549-557.
[17] Le LS,Paradis S,Rahmouni H,et al.Translation of TRO40303 from myocardial infarction models to demonstration of safety and tolerance in a randomized Phase I trial.J Transl Med,2014,12:38-45.
[18]Stein AB,Bolli R,Dawn B,et al.Carbon monoxide induces a late preconditioning-mimetic cardioprotective and antiapoptotic milieu in the myocardium.J Mol Cell Cardiol,2012,52:228-236.
[19]Mukherjee S,Gangopadhyay H,Das DK,et al.Broccoli:a unique vegetable that protects mammalian hearts through the redox cycling of the thioredoxin superfamily.J Agric Food Chem,2008,56:609-617.
[20]Filep JG.Glucocorticoid protection againstmyocardial ischemiareperfusion injury:central role for the PGD2-Nrf2 pathway. Hypertension,2014,63:22-23.
[21]Gurusamy N,Malik G,Gorbunov NV,et al.Redox activation of Ref-1 potentiates cell survival following myocardial ischemia reperfusion injury.Free Radic Biol Med,2007,43:397-407.
[22]Gundewar S,Calvert JW,Jha S,et al.Activation of AMP-activated protein kinase by metformin improves left ventricular function and survival in heart failure.Circ Res,2009,104:403-411.
[23]Wang XY,Dong WP,Bi SH,et al.Protective effects of osthole againstmyocardial ischemia/reperfusion injury in rats.Int JMol Med,2013,32:365-372.
[24]Yu J,Zhao Y,Li B,et al.17beta-estradiol regulates the expression of antioxidant enzymes in myocardial cells by increasing Nrf2 translocation.JBiochem Mol Toxicol,2012,26:264-269.
[25]Calvert JW,Jha S,Gundewar S,et al.Hydrogen sulfide mediates cardioprotection through Nrf2 signaling.Circ Res,2009,105:365-374.
[26]Zhang Y,Sano M,Shinmura K,et al.4-hydroxy-2-nonenal protects against cardiac ischemia-reperfusion injury via the Nrf2-dependent pathway.J Mol Cell Cardiol,2010,49:576-586.
[27]Sussan TE1,Rangasamy T,Blake DJ,et al.Targeting Nrf2 with the triterpenoid CDDO-imidazolide attenuates cigarette smoke-induced emphysema and cardiac dysfunction in mice. Proc Natl Acad Sci USA,2009,106:250-255.
[28]Deng C,Sun Z,Tong G,et al.alpha-Lipoic acid reduces infarct size and preserves cardiac function in rat myocardial ischemia/reperfusion injury through activation of PI3K/Akt/Nrf2 pathway.PLoSOne,2013,8:e58371-58377.
[29]Meili-Butz S,Niermann T,Fasler-Kan E,et al.Dimethyl fumarate,a small molecule drug for psoriasis,inhibits Nuclear Factor-kappaB and reducesmyocardial infarct size in rats.Eur J Pharmacol,2008,586:251-258.
[30]Kappos L,Gold R,Miller DH,et al.Efficacy and safety of oral fumarate in patients with relapsing-remitting multiple sclerosis:a multicentre,randomised,double-blind,placebocontrolled phaseⅡb study.Lancet,2008,372:1463-1472.
[31]Ashrafian H,Czibik G,Bellahcene M,et al.Fumarate is cardioprotective via activation of the Nrf2 antioxidant pathway. Cell Metab,2012,15:361-371.
The Nrf2/Keap1-ARE pathway and m yocardial ischem ia reperfusion injury
Nrf2/Keap1-ARE通路; 氧化应激; 心肌缺血再灌注损伤
The Nrf2/Keap1-ARE pathway; Oxidative stress; Myocardial ischemia reperfusion injury
上海市科委资助项目(项目编号:13XD1403200)
作者单位:200092 上海市,上海交通大学医学院附属新华医院心胸外科
梅举,E-mail:ju-mei63@126.com
10.3969/j.issn.1672-5301.2015.05.001
R654.2
A
1672-5301(2015)05-0385-04
2015-02-13)

