超声波协同Fenton氧化法预处理HMX生产废水的实验研究
李 萌,康 超,邹高兴,罗志龙,董海燕
(1.西安近代化学研究所,陕西 西安 710065;2.甘肃银光化学工业集团有限公司,甘肃 白银 730900)
引 言
目前,国内奥克托今(HMX)生产主要采用醋酐法,生产过程中产生的废水量大、且不易被自然降解。A.SHARMA等[1]研究发现,火炸药废水中所携带的污染物多具有急性毒性,很难直接被一般生物所降解,需将废水COD值降至2000mg/L以下方可进行生物法处理。因此在处理HMX生产废水的实际操作中,存在工艺复杂、流程长、费用高等缺陷,且很难完全降解。
Fenton氧化法具有工艺流程简单、时间短、降解效率高等优点。与超声波联用,不但可以提高H2O2的活性,而且可以通过与水的反应减少H2O2的投放量,改善Fenton试剂在使用时因H2O2使用量较大而导致成本偏高的问题。研究表明[2-4],超声波与Fenton联用,不仅可以将废水中的含能材料成分充分降解,而且可以有效降低废水中的COD值。尹娟娟等[3]使用该方法处理HMX模拟废水的研究中发现,当处理时间大于80min以上时,COD去除率可达51%,HMX的去除率可达90%以上。
本研究采用超声波与Fenton试剂协同氧化法对实际HMX生产废水进行处理,分析了实际废水的pH值、超声波频率、功率、H2O2和Fe2+投料量等因素对HMX生产废水COD去除率的影响,为HMX生产废水的处理提供参考。
1 实 验
1.1 试剂与仪器
HMX生产废水,取自某厂HMX生产线,COD值为9 415mg/L,pH 值为3.93;FeSO4·7H2O,分析纯;双氧水(30%),分析纯;浓硫酸(98%)分析纯;NaOH,分析纯;均购自成都科龙化工试剂厂。
舒美KQ-200VDE型超声波反应装置,昆山市超声仪器有限公司;雷磁PHJ-5型pH计,上海仪电科学仪器股份有限公司;Mettler Toledo ME204E型电子天平,梅特勒-托利多仪器(上海)有限公司。
1.2 实验方法
量取100mL废水置于250mL三口烧瓶中,调节废水pH值到预定值;精确称取一定量FeSO4·7H2O固体置于废水中;将三口烧瓶置于水浴中加热并开启搅拌;当温度到达设定好的初始温度时,开启超声波发生装置;量取一定量双氧水,缓慢加入三口烧瓶后,维持反应90min;取样过滤沉淀后,检测COD值并计算COD去除率。
2 结果与讨论
2.1 工艺条件的确定
通过对HMX生产废水pH值、初始温度、H2O2和Fe2+投料量、超声波功率和频率等6个因素进行正交实验,得到这些因素对COD去除率的影响顺序为:初始温度>pH>H2O2投料量>超声波功率>Fe2+投料量>超声波频率。其中反应的初始温度以及HMX生产废水的pH值对COD去除率的影响较大,而超声波频率对反应的影响较小。根据正交实验结果制定单因素实验初始条件为:H2O2投料量为0.265mol,Fe2+投料量为0.021mol,HMX废水pH值为3,温度为40℃,超声波频率为45Hz,超声波功率为5kW/m3,反应时间为60min。
2.2 初始温度对COD去除率的影响
在不同初始温度条件下,对100mL HMX生产废水进行处理,得到COD去除率与初始温度的关系曲线,结果见图1。

图1 初始温度与COD去除率的关系曲线Fig.1 Relationship curve of initial temperature with COD removal rate
由图1可看出,当初始温度从20℃上升至30℃时,COD去除率提高30%;反应初始温度从30℃上升至40℃时,COD去除率提高趋势放缓;当初始温度上升至50℃时,COD去除率达到最高。这是因为,随着温度的升高,反应速率加快。超过30℃后,副反应增加,H2O2未被催化生成活性物质OH·之前,在热的作用下快速分解成H2O和O2,从而降低了参与降解反应的H2O2数量。因此,较适宜的降解温度为30℃。
2.3 pH值对COD去除率的影响
用H2SO4和NaOH将HMX生产废水的pH值分别调节至1~5,在初始温度为30℃的条件下对100mL HMX生产废水进行处理,得到COD去除率与pH值的关系曲线,见图2。

图2 pH值与COD去除率的关系曲线Fig.2 Relationship curve of pH value with COD removal rate
由图2可看出,当pH值为3时,COD去除率最高。当pH值大于3时,COD去除率逐渐降低。根据 Yangang Li等[5]的研究结果:Fe2++H2O2→Fe3++OH-+OH·,体系中存在过多的OH-抑制了活性物质OH·的生成,并引导双氧水向着OH-+H2O2→H2O+O2的方向进行,导致双氧水被过度消耗,使得降解效率变低;同时过多的OH-也可快速地与Fe3+生成沉淀,消耗溶液中的催化剂。而当pH值小于3时,去除率下降更为迅速。根据Kaidar Ayoub等[6]的研究结果:Fe3++HO2·→Fe2++O2+H+进行分析,体系中存在过多的H+导致Fe3+被还原成Fe2+这一关键步骤被阻碍,部分Fe2+被氧化后,无法被重新还原,导致催化剂失活,影响降解的效果。因此根据实验结果认为,当HMX废水pH值为3时,处理效果最好。
2.4 H2O2投料量对COD去除率的影响
在HMX生产废水的pH值为3、水浴温度30℃、FeSO4·7H2O投料量为0.021mol、超声波频率45kHz、超声波功率为5kW/m3条件下,研究了H2O2投料量对COD去除率的影响,得到H2O2投料量与COD去除率的关系曲线,结果见图3。

图3 H2O2投料量与COD去除率的关系曲线Fig.3 Relationship of H2O2dosage with COD removal rate
由图3可以看出,随着H2O2投料量的不断增加,COD去除率线性增加。当COD去除率超过80%时,COD去除率的增加趋势变缓。这是因为当系统内存在足量的铁盐时,Fe2+/Fe3+的氧化/还原比例一定,随着H2O2的增加,COD去除率线性增加;当H2O2过多时,由于反应速率r还原<r氧化,部分H2O2将Fe2+氧化成Fe3+后,Fe3+无法及时被还原成Fe2+,致使剩余的H2O2无法及时获得Fe2+,仅依靠超声波促进H2O2的分解后,直接参与废水中有机物的降解,从而造成处理效率下降。在此实验中,当H2O2投料量超过0.235mol后,COD去除率增加的趋势开始放缓。分析认为,H2O2投料量越大,COD去除率越高,但是受Fe2+存在量的影响,H2O2与Fe2+的投料量之间存在最佳比例。
2.5 超声波功率对COD去除率的影响
在HMX生产废水pH值为3、水浴30℃、H2O2投料量为0.235mol、FeSO4·7H2O投料量为0.021mol、超声波频率45kHz条件下,研究了超声波功率对COD去除率的影响,得到超声波功率与COD去除率的关系曲线,结果见图4。

图4 超声波功率与COD去除率的关系曲线Fig.4 Relationship of power of ultrosonic with COD removal rate
由图4可以看出,当超声波功率从0增至5kW/m3时,COD去除率呈线性增加。原因可能是:随着超声波功率的增强,空化气泡的数量增加,同时气泡所携带的能量增加;当空化泡崩溃时,在气泡边界层产生的瞬时高温、高压不仅为化学反应时的物质交换提供了便利,而且逐渐增加的能量可以协助生成越来越多的HO·,为有机物的降解提供了原动力[7-11]。
2.6 Fe2+投料量对COD去除率的影响
在HMX生产废水的pH值为3、水浴温度30℃、H2O2投料量为0.235mol、超声波频率45kHz、超声波功率为5kW/m3条件下,研究了Fe2+投料量对COD去除率的影响,得到Fe2+投料量与COD去除率的关系曲线,结果见图5。
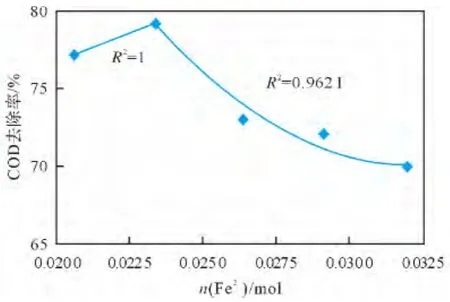
图5 Fe2+投料量与COD去除率的关系曲线Fig.5 Relationship of Fe2+dosage with COD removal rate
由图5可以看出,随着Fe2+投料量的增加,COD去除率增加,当Fe2+的投料量接近0.023mol时,COD去除率达到最大值,此后随着Fe2+投料量继续增加,COD去除率迅速下降。
实验发现:当系统内Fe2+较少时,反应结束后,系统内仅有少量沉淀或无沉淀;Fe2+投料量逐渐增加,尤其当COD去除率达到最大值后,继续增加Fe2+投料量,沉淀量明显增加。这是因为当Fe2+投料量不足时,铁元素都参与Fe2+↔Fe3+的相互转化,随着铁含量的增加,催化生成的HO·增加;当Fe2+投料量超过0.023mol后,Fe3+被还原成Fe2+的过程远比Fe2+被氧化成Fe3+的过程复杂,导致反应速率r还原<r氧化[12-13]。体系中 Fe2+优先与 H2O2反应生成Fe3+,由于过多的Fe2+与 H2O2进行反应,消耗了大量H2O2,致使Fe3+无法全部与H2O2进行还原反应,而与OH-生成Fe(OH)3沉淀;由于H2O2的过度消耗,导致可参与降解反应的H2O2大量减少,COD去除率快速下降。在本实验中,当Fe2+的投料量为0.023mol时,Fenton试剂才能高效地发挥作用。
2.7 超声波频率对COD去除率的影响
在HMX生产废水pH值为3、水浴温度30℃、H2O2投料量为0.235mol、FeSO4·7H2O投料量为0.023mol、超声波功率为5kW/m3条件下,研究了超声波频率对COD去除率的影响,得到超声波频率与COD去除率的关系曲线,结果见图6。

图6 超声波频率与COD去除率的关系曲线Fig.6 Effect of frequency of ultrosonic with COD removal rate
由图6可以看出,超声波频率为45kHz时,效果明显优于Fenton试剂单独作用或使用80kHz超声波协同作用。超声波在废水中产生空化效应,为体系提供能量并促进降解,同时促进H2O+超声波→HO·+H+反应,因此,其结果优于Fenton试剂和超声波两者单独作用效果的叠加,即所谓的协同效应。当提高超声波频率时,空化泡从生成至崩溃所经历的时间缩短。在过高频率的超声波作用下,正压相无法拥有充裕的时间实现内破裂,导致空化泡崩溃不充分。此结果很可能导致空化泡边缘无法产生足够的压强和温度促进反应;相反,大量空化泡的存在屏蔽了物质之间的接触,加之不断升高的系统温度可导致双氧水的分解(2H2O2→2H2O+O2↑)加速,使得降解效果下降[14-15]。因此采用超声波频率为45kHz时,降解效果最佳。
2.8 Fenton法和超声波/Fenton法处理结果比较
将Fenton法与超声波/Fenton法进行比较,Fenton法条件为:HMX生产废水的pH值为3,30℃水浴处理60min;超声波/Fenton法条件为:超声波频率为45kHz,超声波功率为5kW/m3,比较结果见图7。

图7 Fenton法和超声波/Fenton法处理结果比较Fig.7 Comparison with Fenton and US/Fenton
由图7可以看出,开始超声波/Fenton法处理效果明显比无超声波作用时强。但是随着H2O2含量的增加,Fe2+/Fe3+的含量逐渐不足,两种方法的降解效果因受体系中铁元素相对保有量的限制,差别不断缩小。当H2O2过量后,虽然COD去除率还在持续升高,但增速明显放缓,并且两种方法的处理效果几乎相同。这说明H2O2投料量不足时超声波协同效应的优势明显,协助系统产生更多的HO·;但是随着H2O2投料量的增加,生成的HO·更多,导致超声波协同效应的优势逐渐降低;当H2O2过量后,由于废水中有机物已所剩不多,根据化学反应平衡理论,降解效果受废水中有机物浓度的限制。虽然不断增加的H2O2投料量推动了降解反应的进行,但是不断降低的有机物浓度限制了反应的进程。
3 结 论
(1)Fenton法能够有效降解HMX生产废水,施加超声波后,可加强其降解效率。
(2)超声波协同Fenton法处理100mL HMX生产废水的最佳工艺为:超声波频率45kHz,功率5kW/m3,H2O2与Fe2+的投料量分别为0.235mol和0.023mol,即n(H2O2)∶n(Fe2+)=10∶1,此时COD去除率达到80%以上。
(3)在H2O2投料量较少时,超声波协同效应的优势明显,H2O2与Fe2+摩尔比越低,超声波协同效应越显著。当H2O2与Fe2+摩尔比高于10∶1时,超声波的协同效应几乎消失。因此在实际应用过程中,可适当提高Fe2+的投料量或者加强超声波功率来提高处理能力。
[1] Sharma A,Sundaram S T,Zhang Y Z,et al.Biodegradation of nitrate esters II.Degradation of nitrocellu lose by a fungus isolated from a double-base propellant[J].Journal of Applied Polymer Science,1995,55:1847-1854.
[2] 许金花,汪晓军,利用Fenton氧化处理TNT炸药废水[J].火炸药学报,2007,30(6):44-47.XU Jin-hua, WANG Xiao-jun.Treatment of Wastewater Containing TNT by Fenton Oxidation[J].Chinese Journal of Explosives and Propellants,2007,30(6):44-47.
[3] 尹娟娟,袁凤英,宋伟冬,等,超声助Fenton试剂处理HMX炸药废水 [J].火炸药学报,2009,32(1):55-58.YIN Juan-juan,YUAN Feng-ying,SONG Wei-dong,et al.Treatment of HMX wastewater with US/Fenton technology[J].Chinese Journal of Explosives and Propellants,2009,32(1):55-58.
[4] 焦纬洲,郭亮,刘文丽,等,Fenton氧化法降解HMX废水中有机物的氧化反应动力学 [J].火炸药学报,2014,37(2):53-56.JIAO Wei-zhou,GUO Liang,LIU Wen-li,et al.Oxidation reaction kinetics of degrading organic matter in HMX wasterwater by Fenton oxidation method[J].Chinese Journal of Explosives and Propellants,2014,37(2):53-56.
[5] LI Yan-gang,Hsieh Wen-Pin,Mahmdov Rovshan,et al.Combined ultrasound and Fenton (US-Fenton)process for the treatment of ammunition wastewater[J].Journal of Hazardous Materials,2013:244-245:403-411.
[6] Ayoub Kaidar,van Hullebuschb Eric D,Cassirc Michel,et al.Application of advanced oxidation processes for TNT removal:A review[J].Journal of Hazardous Materials,2010,178 :10-28.
[7] Sun H H,Sun S P,Sun J Y,et al.Degradation of azo dye Acid black 1using low concentration iron of Fenton process facilitated by ultrasonic irradiation[J].Ultrason Sonochem,2007,14:761-766.
[8] Kim I K,Huang C P,Chiu P C,Sonochemical decomposition of dibenzothiophene in aqueous solution [J].Water Res,2011,35:4370-4378.
[9] Kyung-Duk Zoh,Michael K.Stenstrom.Fenton oxidation of hexahydro-1,3,5-trinitro-1,3,5-triazine(RDX)and octahydro-1,3,5,7-tetranitro-1,3,5,7-tetrazocine(HMX)[J].Water Research,2002,36:1331-1341.
[10]李廷盛,尹其光.超声化学[M].北京:科学出版社,1995:32-34.LI Ting-sheng,YIN Qi-guang.Ultrasound Chemistry[M].Beijing:Science Press,1995:32-34.
[11]Kojima Y,Koda S,Nomura H,Effect of ultrasonic frequency on polymerization of styrene under ultrasonic[J].Ultrasonic Sonochemistry,2011(8):75-79.
[12]Pignatello J.Dark and photo assisted Fe3+-catalyzed degradation of chlorophenoxy herbicides by hydrogen peroxide[J].Environment Science and Technology,1992,26:944-951.
[13]Walling C,El-Taliawi G M,Johnson R.A Fenton's reagent IV:structure and reactivity relations in the reaction of hydroxyl radicals and the redox reactions of radicals.[J].Journal of American Chemical Society 1974,96:133-139.
[14]Kim I K,Huang C P.Sonochemical degradation of polycyclic aromatic sulfurhydrocarbons(PASHs)in aqueous solutions exemplified by benzothiophene [J].Chinese Institute of Engineering,2005,28(7):1107-1118.
[15]Huang C P,Myoda P S.Sonochemical treatment of wastewater effluent for the removal of pathogenic protozoa exemplified by Cryptosporidium[J].practice periodical of Hazardous,Toxic,and Radioactive Waste Management,2007,11(2):114-122.
致 谢:西安近代化学研究所与甘肃银光化工集团有限公司提供项目平台;西安近代化学研究所的杨毅研究员以及领导、同事给予的鼎力支持,在此一并感谢。

