包覆改性纳米CaO基CO2吸附剂的反应吸附性能
薛孝宠,王 燕,吴素芳,2
包覆改性纳米CaO基CO2吸附剂的反应吸附性能
薛孝宠1,王 燕1,吴素芳1,2
1.浙江大学 化学工程与生物工程学院,浙江 杭州 310027;2.浙江大学 生物质化工教育部重点实验室,浙江 杭州 310027
对包覆改性纳米CaO基CO2吸附剂的反应吸附性能进行研究,分别采用惰性材料MgO和TiO2对纳米CaCO3表面进行包覆改性,并以铝溶胶为黏结剂,通过混合造粒的方法制备改性纳米CaO基CO2吸附剂。在相同的吸附温度(600 ℃)、CO2分压(0.015 MPa)、再生温度(750 ℃)以及N2气氛的条件下,采用热重分析仪(TGA)分别考察了吸附剂的分解温度、吸附速率、吸附容量及循环吸附容量的稳定性。结果表明:MgO和TiO2包覆改性吸附剂的分解温度较未包覆改性的吸附剂分解温度分别提高了20和35 ℃;经过30次循环后,包覆改性的吸附剂的吸附速率和吸附容量均明显大于未改性的吸附剂,其中包覆TiO2改性的吸附剂具有较好的吸附容量稳定性,30次循环后,吸附容量衰减率为34.85%,包覆MgO改性的吸附剂吸附容量衰减率为38.89%,而未经过包覆改性的吸附剂吸附容量衰减率为54.87%。
钙基吸附剂 包覆改性 纳米碳酸钙
高温CO2脱除广泛应用于烟气脱碳和反应吸附强化甲烷水蒸气重整制氢(ReSER)等过程[1,2]。以CaO为主要成分的CaO基CO2吸附剂(简称钙基吸附剂)是高温CO2脱除的首选材料[3],CaO可以通过天然石灰石和蒙托石中的CaCO3高温煅烧得到,因此具有天然储量大和成本低的特点,同时CaO通过与CO2化学反应脱除CO2,具备反应计量数的高反应吸附容量。但是,钙基吸附剂在经历多次反应吸附-再生循环后,吸附性能会出现显著的衰减[4,5],这严重制约了钙基吸附剂在工业上的应用。因此,提高钙基吸附剂在循环反应过程中吸附性能的稳定性是目前亟待解决的问题。研究发现,钙基吸附剂的吸附性能下降主要是CaO的烧结引起的[6]。CaO的烧结指CaO固体颗粒在足够高的温度下但低于熔点的温度时发生颗粒聚集融合的过程。烧结造成了吸附剂表面的微孔闭合,孔隙率和比表面积减小,导致CO2难以扩散到吸附剂内部与CaO反应,从而降低反应吸附能力。改进的方法通常在钙基吸附剂制备过程中,以物理混合的方式添加惰性组分如Al2O3[7],MgO[8]和KnMO4[9]等抑制CaO的烧结。目前大部分的研究主要集中于微米级CaCO3,而相比微米CaCO3,纳米CaCO3分解温度低,经纳米CaCO3分解得到的纳米CaO具有反应吸附速率快和反应吸附容量大等优点,具有更好的工业应用前景[10-13]。但是由于纳米颗粒粒径小,表面自由能高,在高温反应吸附-再生循环过程中更易出现粒子团聚和烧结。Wu等[12,13]分别采用酯水解和吸附相反应等方法,在纳米CaCO3颗粒表层包覆一层TiO2,包覆TiO2改性后的纳米CaCO3较未包覆的纳米CaCO3的稳定性有明显的提高。但是包覆后的纳米CaCO3仍然是一种纳米粒径的材料,很难直接用作CO2吸附剂。Wu等[10]以纳米CaCO3为前驱体,以铝溶胶为粘结剂进行混合造粒的方式合成了氧化铝为载体的纳米钙基吸附剂,不仅提高了纳米CaO吸附剂吸附稳定性,更显示了纳米CaO吸附剂在流化床反应器上应用的潜力。目前以包覆改性的纳米 CaCO3为前驱体制备钙基吸附剂的研究未见报道,因此,本工作采用以吸附相技术分别制备的MgO,TiO2包覆改性的纳米CaCO3为前驱体,通过加入铝溶胶混合,喷雾造粒,得到可以适用于流化床反应器的纳米钙基吸附剂,并在热重分析仪上研究其分解温度、吸附速率、吸附容量和循环稳定性等性能。
1 实验部分
1.1 包覆改性纳米CaO基CO2吸附剂的制备
吸附剂的制备流程如图1所示。首先将含水的纳米CaCO3(平均粒径70nm)分散在无水乙醇中,超声分散得到纳米CaCO3悬浮液,同时加入3A型分子筛脱除体系中多余的水分。由于纳米CaCO3具有亲水疏油性,因此纳米CaCO3表面仍聚集着水薄层,通过滴加TiO2或MgO的前驱体溶液钛酸正丁酯或硝酸镁溶液使其在水薄层内发生水解或沉淀反应,经洗涤和真空抽滤可得到包覆改性的CaCO3,作为吸附剂的前驱体。
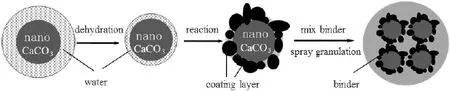
图1 包覆改性纳米CaO基CO2吸附剂的制备流程Fig.1 The preparation of coating modified nano CaO based CO2adsorbent
其中,在纳米CaCO3粒子表面水薄层内发生的水解反应,MgO包覆见反应式(1),TiO2包覆见反应式(2)。
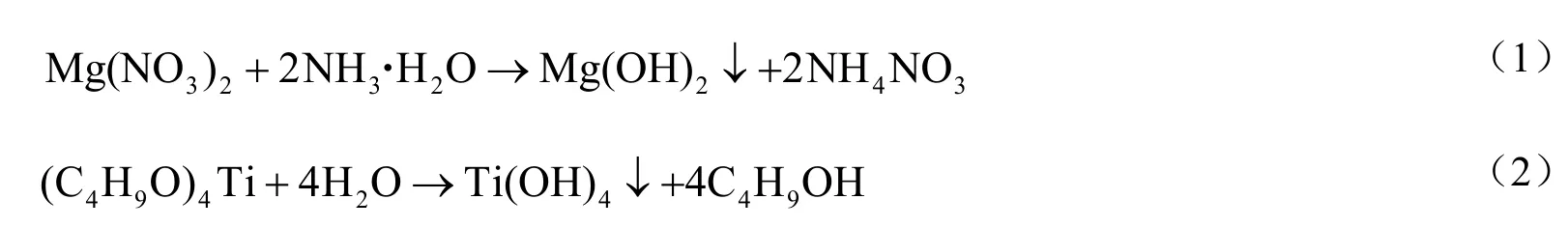
将MgO和TiO2包覆改性后的纳米CaCO3前驱体,按CaCO3与Al2O3的质量比为85∶15,将CaCO3与铝溶胶(含质量分数为10%的Al2O3)混合,包覆改性后的纳米CaCO3经550~650 ℃煅烧2~5h,通过喷雾造粒得到纳米CaO基CO2吸附剂,经MgO和TiO改性的吸附剂分别记为sorb-2和sorb-3,同时未改性的纳米CaCO3制备的吸附剂标记为sorb-1。
1.2包覆改性纳米CaO基CO2吸附剂表征
采用日电公司生产的JEM-1200EX型透射式电子显微镜(TEM)观察吸附剂颗粒的尺寸、形貌及分散状态。取少量吸附剂于塑料样品管中,加入无水乙醇超声分散,然后拿铜网蘸取样品液,干燥后放入TEM仪器中进行观测,放大倍数为10~30万倍。
采用Japan Inc公司的BELSORP-miniⅡ测试仪测定样品的表面积、孔容和孔径,以液氮作为吸附介质,吸附温度为-196 ℃,采用BET方程计算比表面积,以BJH模型计算介孔的孔容和孔径。
1.3包覆改性纳米CaO基CO2吸附剂吸附性能
采用美国Perkin Elmer公司Pyris1热重分析(TGA)仪测定样品的分解温度和吸附性能,将一定量(1~2 mg)的吸附剂样品置于样品篮中,在N2气氛下,以15 ℃/min的速率升温至800 ℃,维持15 min,使CaCO3完全分解成CaO后降至600 ℃,切换成0.015 MPa CO2和0.085 MPa N2气氛进行吸附,吸附10 min,吸附完成后将气体切换成纯N2,并以15 ℃/min的速率升温至750 ℃进行吸附剂的再生,如此实现吸附剂的多循环吸附性能测试。根据TGA实时记录的吸附剂质量变化数据,可以计算吸附容量和吸附速率,用来表征吸附剂的单次吸附性能,通过计算衰减率来定量吸附剂的循环吸附稳定性。吸附容量定义为吸附的CO2摩尔数与吸附剂初始质量的比值,mol/kg;衰减率为首次吸附容量与某一次循环吸附容量的差值与首次吸附容量的比值,%。
2 结果与讨论
2.1 吸附剂的微观表征结果
2.1.1 纳米CaCO3包覆前驱体表征
采用吸附相技术并参考文献[13]的最优条件,制备了MgO,TiO2包覆改性的纳米CaCO3前驱体,其中MgO质量分数为12 %,TiO2质量分数为10 %。采用TEM表征其包覆效果,如图2(b)和(c)所示。由图可看出,纳米 CaCO3的形状近似立方形,粒径约为 70~100nm,MgO包覆改性的纳米CaCO3外围明显包覆了一层絮状物,厚度在8nm左右,而TiO2包覆改性的纳米CaCO3表面明显有深色包覆层,包覆层厚度约10~20nm。对比图2(b)和(c)可以看出TiO2较MgO在纳米CaCO3表层分布更加均匀。

图2 包覆改性纳米CaCO3与未包裹纳米CaCO3的TEM照片Fig.2 TEM images of coated and uncoated nano CaCO3
2.1.2 吸附剂的微观结构比较
采用3种不同纳米CaCO3前驱体与铝溶胶混合制备得到的CaO基CO2吸附剂,测试其比表面积、孔容和平均孔径,结果如表1所示。
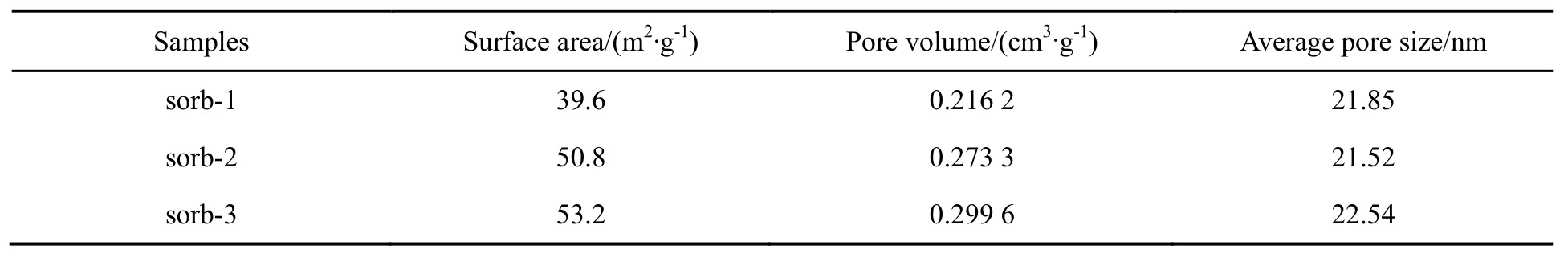
表1 3种吸附剂的微观结构Table 1 Microstructure of three adsrobents
由表1可看出,sorb-3的比表面积最大,sorb-2次之,而未改性的sorb-1最小;孔容也有类似的规律,这可能是由于sorb-2和sorb-3的前驱体包覆层经过热分解后提供部分比表面积和孔体积所致。3种吸附剂的平均孔径较为一致,sorb-3孔径略微大一点,这可能由于Ti(OH)4分解比Mg(OH)2分解提供了更大的孔。
2.2 吸附剂的分解温度
由于吸附剂的分解温度直接关系到吸附剂在使用过程中的能耗,对制备的3种不同吸附剂的分解温度进行测定,结果如图 3所示。由图可看出,sorb-1开始分解的温度最低,sorb-2与sorb-3近似,最终分解温度从低到高依次为sorb-1,sorb-2,sorb-3。MgO和TiO2包覆改性吸附剂较未包覆改性的吸附剂分解温度分别提高了20和35 ℃。这可能是由于包覆在CaCO3表层的惰性物质在一定程度上降低了分解时传热的效率,由于TiO2包覆层更加致密,因此sorb-3分解温度最高,达到了750 ℃。
2.3 吸附剂的吸附速率
纳米CaO具有吸附CO2速率高的优点,考察3种吸附剂的初次吸附速率和30次循环后的吸附速率,结果如图4所示。由图4(a)可看出,初次循环sorb-1具有最高的吸附速率,在0.07 mol/(kg·s)左右,sorb-3较sorb-2吸附速率高,其原因是由于初次循环,3种吸附剂的纳米CaO均具有很高的活性,未改性的吸附剂sorb-1的活性CaO相对含量更高;而同为包覆改性组分的sorb-2和sorb-3,由于sorb-3的比表面积和孔体积均较sorb-2大,因此吸附速率也相对较高。由图4(b)可看出,经过30次循环后,sorb-1的吸附速率显著下降,而sorb-2和sorb-3的吸附速率下降幅度较少,其原因可能是惰性组分的加入抑制了CaCO3的部分烧结,阻止了吸附速率的下降。
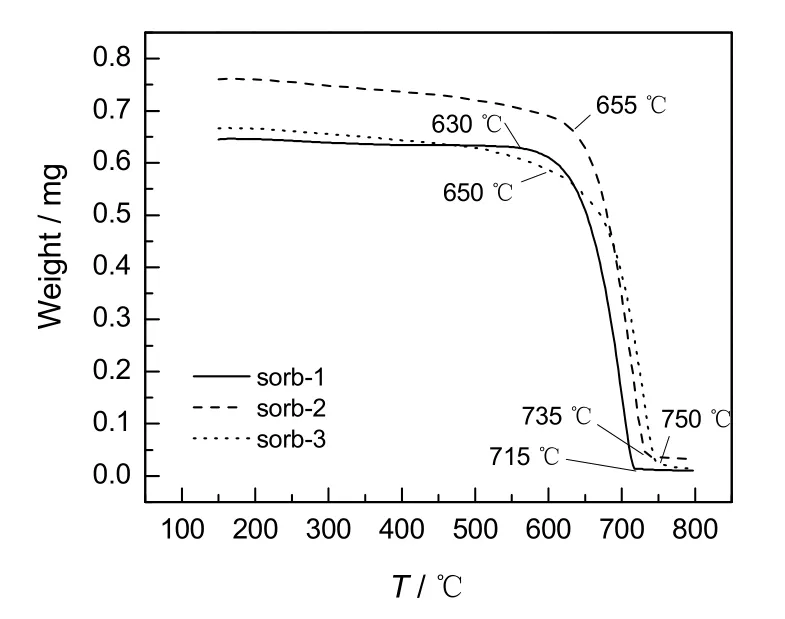
图3 3种吸附剂的分解温度Fig.3 Decomposition temperature of three adsorbents
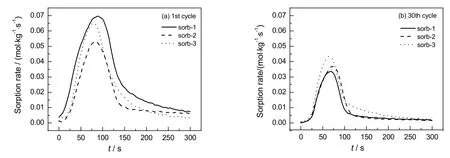
图4 3种不同吸附剂的吸附速率Fig.4 Sorption rate of three adsorbents
2.4 吸附剂的吸附容量及稳定性
将3种吸附剂在600 ℃,0.015 MPa CO2和0.085 MPa N2气氛下进行吸附,在750 ℃,纯氮气下进行再生,得到的循环吸附容量如图5所示。由图可看出,未进行包覆改性的吸附剂sorb-1首次吸附容量为7.64 mol/kg,吸附容量高于其他2个吸附剂,这主要是因为未包覆的吸附剂活性纳米CaO含量较高但循环过程前15次循环时衰减率较大,后15次循环后吸附容量仍有略微衰减,30次循环吸附容量衰减率为54.87%;包覆MgO改性的sorb-2首次吸附容量为6.80 mol/kg,30次循环后吸附容量衰减率为38.89%;包覆TiO2改性的sorb-3首次吸附容量为6.94 mol/kg,循环过程前10次有较大衰减,后面吸附容量基本保持稳定,30次循环容量衰减率为34.85%。CaO基CO2吸附剂吸附性能下降主要是CaO的烧结引起[6],由于新鲜吸附剂具有较大的比表面积和丰富的孔结构,因此在前期高温使用时非常容易发生烧结,导致吸附容量迅速下降,随着循环进行,吸附剂烧结程度加深并形成较稳定的结构,因此在吸附容量下降较为平稳,惰性组分的加入有效地促进了吸附剂稳定结构的形成,使吸附剂维持在一个较高的吸附容量。

图5 3种吸附剂的吸附容量Fig.5 Sorption capacity of three adsorbents
3 结 论
采用吸附相技术对纳米CaCO3前驱体进行MgO和TiO2包覆改性,并将此改性纳米CaCO3与铝溶胶混合制备得到纳米CaO基CO2吸附剂。包覆改性后的吸附剂比未改性的CaCO3分解温度要高20~35 ℃,经过多次反应吸附-再生循环后,改性后吸附剂的吸附速率和吸附容量稳定性优于未改性吸附剂。其中包覆TiO2改性的吸附剂具有最高的吸附速率和最好的吸附容量稳定性,30次循环后吸附容量衰减率仅为34.85%,而未经过包覆改性的吸附剂30次循环吸附容量衰减率为54.87%,包覆MgO改性为38.89%。同时,综合考虑吸附稳定性和成本的前提下, 包覆MgO制备改性纳米CaO基CO2吸附剂是一种经济有效的选择。
[1]Gibbins J, Chalmersh. Carbon capture and storage[J]. Energy Policy, 2008, 36(12): 4317-4322.
[2]Harrison D P. Sorption-enhancedhydrogen production: a review[J]. Industrial & Engineering Chemistry Research, 2008, 47(17): 6486-6501.
[3]Abanades J C, Rubin E S, Anthony E J. Sorbent cost and performance in CO2capture systems[J]. Industrial & Engineering Chemistry Research, 2004, 43(13): 3462-3466.
[4]Abanades J C, Alvarez D. Conversion limits in the reaction of CO2with lime[J]. Energy & Fuels, 2003, 17(2): 308-315.
[5]李振山, 蔡宁生, 黄煜煜. 钙基二氧化碳吸收剂循环反应特性[J]. 工程热物理学报, 2006, 27(2): 215-218. Li Zhenshan Cai Ningsheng,huang Yuyu. Cyclic reaction characters of Ca-based CO2adsorbents[J]. Journal of Engineering Thermophysics, 2006, 27(2): 215-218.
[6]Sun P, Grace J R, Lim C J. The effect of CaO sintering on cyclic CO2capture in energy systems[J]. AIChE Journal, 2007, 53(9): 2432-2442.
[7]Zhou Z, Qi Y, Xie M. Synthesis of CaO-based sorbents through incorporation of alumina/aluminate and their CO2capture performance[J]. Chemical Engineering Science, 2012, 74(28): 172-180.
[8]Li L, King D L, Nie Z. Magnesia-stabilized calcium oxide absorbents with improved durability forhigh temperature CO2capture[J]. Industrial & Engineering Chemistry Research, 2009, 48(23): 10604-10613.
[9]孙荣岳, 李英杰. 硝酸锰对钙基吸收剂循环煅烧/碳酸化捕集CO2的影响[J]. 煤炭化学, 2011, 36(8): 1391-1395. Sun Rongyue, Li Yinjie. Effect of manganese nitrate on calcination/carbonation for CO2capture using calcium-based sorbent[J]. Journal of China Coal Society, 2011, 36(8): 1391-1395.
[10]Wu S F, Li Qh, Kim J N. Properties of a nano CaO/Al2O3CO2sorbent[J]. Industrial & Engineering Chemistry Research, 2008, 47(1): 180-184.
[11]Florin Nh,harris A T. Reactivity of CaO derived from nano-sized CaCO3particles through multiple CO2capture-and-release cycles[J]. Chemical Engineering Science, 2009, 64(2): 187-191.
[12]Wu S F, Zhu Y Q. Behavior of CaTiO3/nano-CaO as a CO2reactive adsorbent[J]. Industrial & Engineering Chemistry Research, 2010,49(6): 2701-2706.
[13]Wang Y, Zhu Y Q, Wu S F. A new nano CaO-based CO2adsorbent prepared using an adsorption phase technique[J]. Chemical Engineering Journal, 2013, 218: 39-45.
Adsorption Properties of Coating Modified Nano CaO-Based CO2Adsorbents
Xue Xiaochong1, Wang Yan1, Wu Sufang1,2
1. College of Chemical and Biological Engineering, Zhejiang University,hangzhou 310027, China;2. Key Laboratory of Biomass Chemical Engineering of Ministry of Education, Zhejiang University,hangzhou 310027, China
The adsorbent was prepared in a spray granulation method by mixing the inert material MgO or TiO2coating modified with nano-CaCO3and with alumina sol as binder. The thermo-gravimetric analyzer was used to investigate the decomposition temperature, adsorption rate, adsorption capacity and stability under the conditions of reactive carbonation temperature 600 ℃, CO2partial pressure 0.015 MPa,and calcination temperature 750 ℃ in nitrogen gas. The results showed that the decomposition temperature of MgO, TiO2coating modified nano CaO-based CO2adsorbent was increased by 20 and 35 ℃, respectively. The adsorption rate and adsorption capacity were bothhigher than those of uncoated nano CaO-based CO2adsorbent after 30 carbonation-calcination cycles. The TiO2coated nano CaO-based CO2adsorbenthad thehighest stability with 34.85% decrement after 30 cycles, and the MgO coated one was 38.89% while the uncoated nano CaO-based CO2adsorbent was 54.87%.
CaO-based adsorbent; coating modification; nano calcium carbonate
TQ028.1+4
A
1001—7631 ( 2015 ) 04—0379—06
2014-04-03;
2015-05-12。
薛孝宠(1988—),男,硕士研究生;吴素芳(1964—),女,教授,通讯联系人。E-mail: wsf@zju.edu.cn。
国家自然科学基金(21276234)。

