Au电极上CO2电还原过程中电极失活原因
王 琴,王晓春,杨冬伟,李 露,贾友见,施 锦
Au电极上CO2电还原过程中电极失活原因
王 琴1,王晓春2,杨冬伟2,李 露2,贾友见1,施 锦2
1.昆明理工大学理学院,云南 昆明 650500;2.昆明理工大学冶金与能源工程学院,云南 昆明 650093
在水溶液中,电还原CO2制取CO时,电极易中毒失活,采用扫描电子显微镜(SEM)、X射线光电子能谱(XPS)对反应前后的电极材料进行检测,研究CO2在KHCO3水溶液中发生电化学还原反应时,Au电极失活原因及电极材料活性降低对反应过程的影响。结果表明,电极表面吸附了一层黑色有害物质。这层黑色有害物质大部分是石墨碳,并有微量的铁和锌。采用塔菲尔曲线、电化学阻抗(EIS)、线性扫描曲线、恒电位电解和气相色谱法等研究了有害物质对CO2电还原反应动力学过程的影响,发现随着反应的进行,生成CO的平衡电位负移,电荷转移电阻增大,交换电流密度变小,产物CO的电流效率迅速降低。说明电极表面附着的有害物质使电极材料活性降低,阻碍了CO2电还原反应的进行。
二氧化碳 电化学还原 中毒机理 电极失活
CO2减排是全世界亟待解决的重大问题[1-3]。将CO2转化为有用化学品,减少化石燃料的使用量,是实现CO2减排的重要技术途径之一[4]。目前研究最多的CO2资源化技术主要有:(1)生物转化法,利用微生物技术将CO2固定在藻类机体中,进而用藻类合成生物质柴油,该技术存在转化率低[5]、生产周期长和技术不成熟等问题,因而难以实现大规模工业化应用;(2)光催化还原法,利用太阳光为能源,将CO2直接转化为CO和甲酸等化学品,这种技术存在转化率低、光能利用率不理想和电催化剂容易失活等问题,目前尚不能在实际中得以应用与推广;(3)高温高压催化氢化法[6],在高温及高压条件下,利用特定催化剂,使CO2与H2发生反应,生成甲烷和甲酸等化合物,这种方法存在催化剂活性低且易于中毒[7]、反应生成的水对反应过程的负面影响难以消除及反应过程中有部分氢气被转化为水而浪费掉等问题,限制了该项技术的工业化应用。因此,探索新的CO2资源化技术是化学工业研究的重要课题。
甲醇是一种优质的汽油替代燃料,也是一种新型化工原料,以CO2和H2O为原料,利用图1所示的研究思路,将CO2转化为甲醇,是一项重要的CO2资源化技术,其技术要点包括两个主要环节:一是以可再生电能(光伏发电和风能发电等)为电解电能,用电化学催化还原的方法将CO2和H2O转化为CO和H2;二是利用工业制甲醇的传统方法,将CO氢化还原为甲醇。通过上述途径,不仅可以实现CO2的资源化利用,还可以将可再生能源转化为化学能储存在液态燃料中,使之成为易于储存,能够运输,便于携带的能源形式。

图1 以CO2,H2O和可再生能源为基本要素合成液态甲醇燃料的技术途径Fig.1 The technical route of methanol synthesis from CO2,H2O and renewable electricity
电解CO2制CO是上述技术途径的核心环节。根据文献报道[8],在KHCO3水溶液中,CO2可在Au电极上发生电还原反应,生成CO。但在长周期电解过程中,发现Au电极极易中毒失活。本工作采用X射线光电子能谱(XPS)和扫描电子显微镜(SEM)测试技术,通过研究CO2电还原反应机理,分析了Au电极催化性能降低的原因,利用电化学测试方法,研究了电极表面附着的有害物质对阴极反应动力学过程的影响。
1 实验方法
电化学实验在电化学工作站(CHI 660E,上海辰华仪器厂)上完成,电解反应测试装置如图2所示,电解槽用离子交换膜(nafion 117)分隔为阴极室和阳极室,阴极室电解液为0.2 mol/L的KHCO3水溶液,阳极室电解液为0.1 mol/L的H2SO4水溶液,工作电极为Au片(1 cm×1 cm),辅助电极为石墨棒,参比电极为饱和甘汞(SCE)。实验前,用0.1 μm的氧化铝粉末打磨Au电极至表面光亮,然后用超声波清洗,再用琥珀酸(浓硫酸和双氧水体积比为3:1)除去电极表面杂质,最后用大量二次水冲洗。测试前,阴极电解液中先通Ar 30 min,以除去溶液中的溶解氧,再通入CO230 min,使阴极电解液中的CO2浓度达到饱和,电解反应进行时,连续不断地通入CO2,流量控制为30 mL/min。
电化学阻抗(electro chemical impedance spectroscopy,EIS)的测试电位为-2.0 V,振幅为5 mV,频率1~105hz,线性扫描速率为50 mV/s,扫描范围为0~-2.0 V;电解反应气相产物用气相色谱仪(GC-4000A,北京东西电子)测定,气相色谱仪的色谱柱为5A分子筛,以氢气为载气,载气流速为25 mL/min,热导温度为110 ℃,柱箱温度为130 ℃,汽化温度为130 ℃;电极表面形貌用扫描电子显微镜(FEI-quanta 200,荷兰FEI公司)观察;电极表面附着物用X射线光电子能谱仪(PHI 5000 Versa Probe-II,ULVAC-PHI公司)分析。
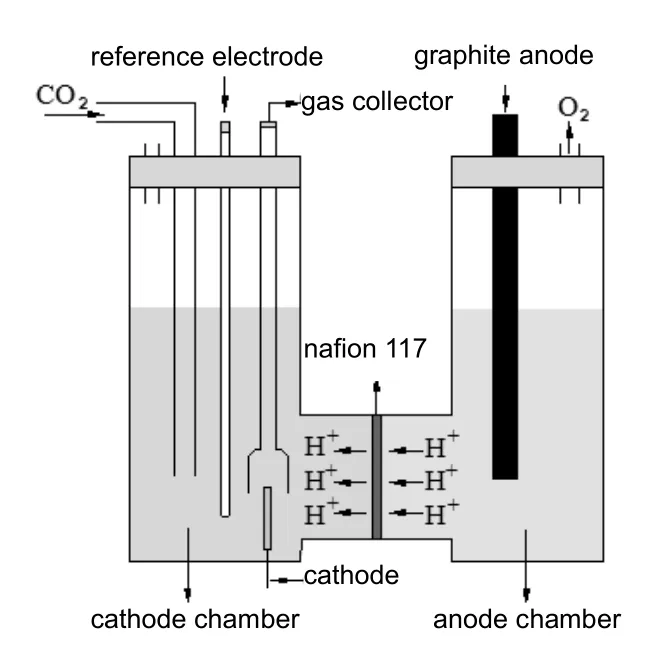
图2 电化学反应装置示意Fig.2 Schematic diagram of the electrolysis cell
2 结果与讨论
2.1 SEM表征
图3为Au电极在实验前后测得的SEM图。由图可知,实验前,电极表面光滑,连续电解2h后,电极表面有物质生成,使Au电极表面被覆盖。
2.2 XPS表征

图3 实验前后Au电极的SEM照片Fig.3 SEM images of Au electrode (a)-before electrolysis; (b)-after 2h electrolysis
图4为CO2电还原反应连续进行2h后,Au电极表面的XPS全扫描谱。可以看出,电极表面附着物主要有C,Zn和Fe。XPS全扫描谱定量分析结果(见表1)表明,Au电极表面C元素占所分析元素总量的71.49%,Zn元素占5.16%,Fe元素占1.84%。

表1 Au电极表面XPS谱定量分析结果Table 1 Quantitative analysis results of XPS spectrum on the surface of Au electrode

图4 CO2电还原反应2h后Au电极表面的XPS全扫描图谱Fig.4 The whole XPS spectrum at the surface of Au electrode after 2h CO2bulk electrolysis reduction

图5 电还原反应2h后Au电极表面C1s的精细图谱及其高斯拟合曲线Fig.5 The fine spectra of Cls and its Gaussian fitting at the surface of Au electrode after 2h CO2bulk electrolysis reduction
图5为CO2电还原反应进行2h后Au电极表面C1s的XPS精细图谱及其高斯拟合曲线。其中,在288.51 eV处的峰对应化学键-COO,286.98 eV处的峰对应C-O键,284.88 eV处的峰对应石墨碳[9],对C1s的精细谱进行高斯拟合见表2。由表可知,石墨碳占碳元素总量的72.20%,说明电解进行2h后,Au电极表面物质的主要成分为石墨碳。位于283.85 eV的峰对应为碳化物,可能是电解液中的金属离子与中间物质形成了碳化锌等碳化物。

表2 C1s XPS谱的高斯拟合结果Table 2 The Gaussian-fitting results of C1s XPS spectrum
2.3 Au电极失活机理分析
2.3.1 CO2电还原反应机理与碳杂质的生成原因分析
CO2电还原反应的机理如图6所示[10],CO2吸附在电极表面,经单电子还原后,转化为自由基离子,这种自由基离子与水发生反应,生成得到一个电子,被还原成CO,从电极表面析出。作为副反应,极少量的自由基离子被还原为C,沉积在电极表面,导致电极中毒。
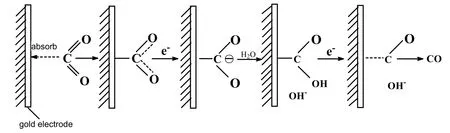
图6 CO2电还原反应机理示意Fig.6 Reaction mechanism of the electrochemical reduction of CO2
2.3.2 金属杂质的生成过程分析
本实验所使用的分析纯KHCO3试剂中,含有微量的Fe和Zn等杂质,在配制电解液时被带入到电解液中,当阴极上发生电还原反应时,这些杂质被还原为金属单质沉积在阴极表面,导致电极失活,阻碍CO2电还原反应的进行。
2.4 阴极表面附着物对CO2电还原反应影响的电化学分析
2.4.1 Tafel曲线
图7为CO2在Au电极上发生电还原反应时测得的Tafel曲线。由图可知,电解反应刚进行时,平衡电位为-1.096 V,当电解反应进行2h后,平衡电位负移至-1.129 V,说明电极表面的附着物使电极的电化学性质发生了改变。
根据Tafel公式[11]:
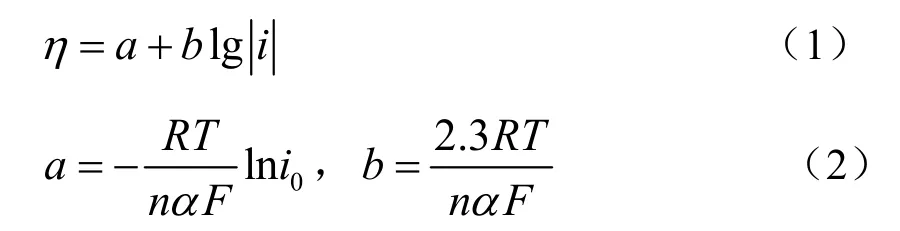

图7 CO2在Au电极上发生电还原反应的Tafel曲线Fig.7 Tafel curves for CO2reduction in different periods on Au electrode
式中:η为过电位;a和b为Tafel常数,其中a代表单位电流密度下体系的过电位,b代表过电位受电流密度的影响程度的大小;i为交换电流;i0为交换电流密度;R为摩尔气体常数,其值为8.314 5 J/(mol·K);T为绝对温度;n为电子转移数;α为传递系数;F为法拉第常数,其值为96 485 C/mol。
电荷转移电阻公式[12]:

可以算出CO2在Au电极上发生电还原反应时的i0,α和电荷转移电阻(Rct),结果如表3所示。由表可知,电解反应2h后,阴极上测得的α增加,i0降低,Rct增大,说明Au电极表面附着的物质对阴极反应产生了影响。
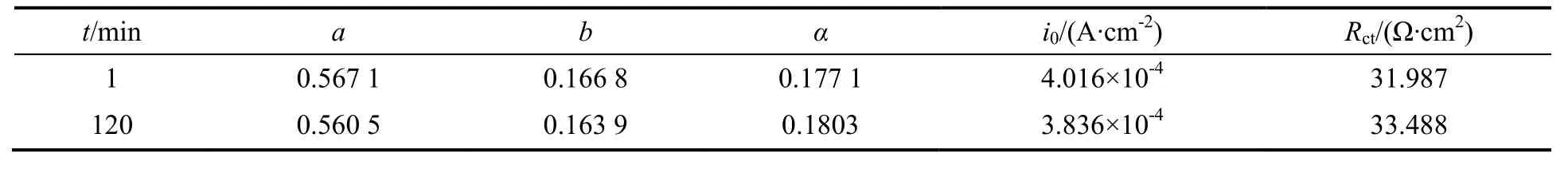
表3 CO2在Au电极上电还原反应的动力学参数Table 3 Dynamic parameters for CO2reduction on Au electrode
2.4.2电化学阻抗谱分析
用ZView软件对阴极反应的电化学阻抗进行了拟合,得到的Nyquist曲线如图8所示,等效电路如图9所示。其中,RS为溶液电阻,RP为反应电阻,Cd为双电层电容,等效元件的拟合值如表4所示。从拟合结果可以看出,Au电极上电还原反应2h后,反应的电荷转移电阻增大,说明Au电极上生成的附着物抑制了CO2电还原反应的进行,Au电极的活性降低。
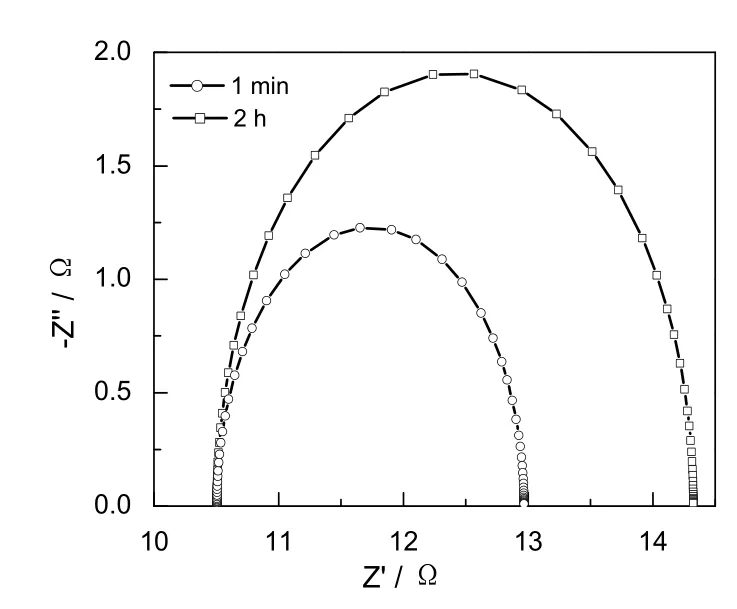
图8 Au电极在KHCO3电解液中的电化学阻抗图谱Fig.8 EIS curves of Au electrode in KHCO3aqueous solution

图9 Au电极在KHCO3电解液中的等效电路图示Fig.9 EIS equivalent circuit model of Au electrode in KHCO3aqueous solution

表4 电解液中等效电路元件拟合结果Table 4 The fitting results of equivalent circuit component in aqueous solution
图10为交流阻抗的Bode图,在低频区,当电解反应2h后,测得的相角相对电解初期(1 min)变化不明显,而阻抗幅模却比反应初期大;在高频区,电解反应2h后测得的相角与阻抗幅模均与反应初期相比无太大变化;在中频区,电解反应2h后测得的相角与阻抗幅模比电解初期大,说明交流阻抗随时间变大,即电解2h后,反应变得困难,Au电极活性降低,与图9结果一致。
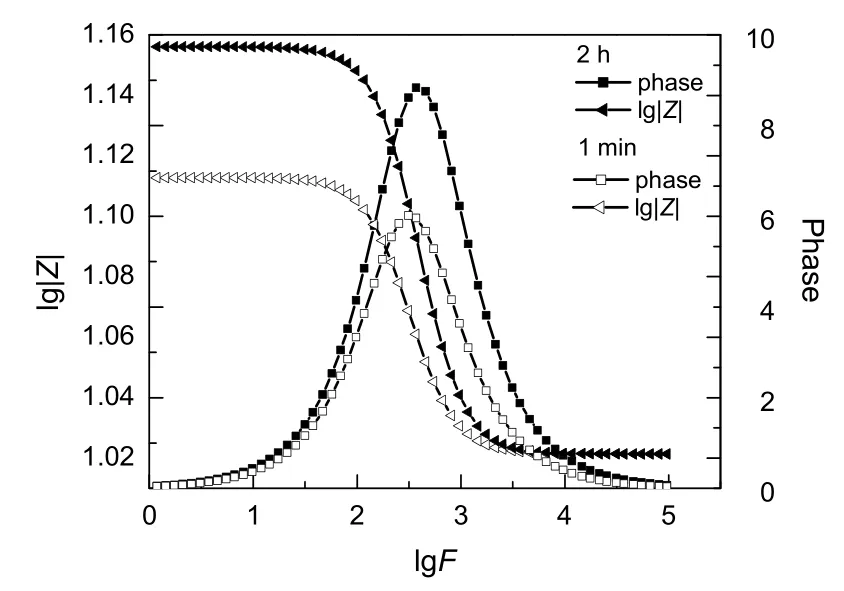
图10 交流阻抗Bode图谱Fig.10 Bode diagram of alternating-current
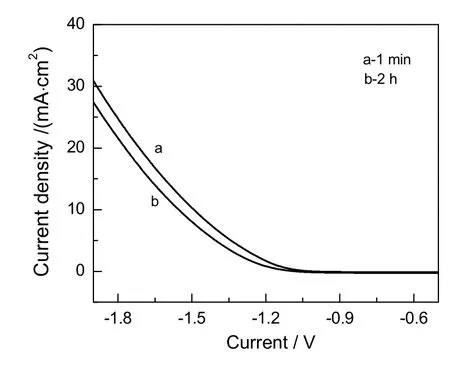
图11 CO2在Au电极上发生电还原反应的线性扫描伏安曲线Fig.11 Linear sweep curves of CO2reduction to CO on Au electrode
2.4.3 极化曲线与恒电位电解曲线分析
图11为Au电极上测得的线性扫描伏安曲线。由图可知,反应初期电流密度较大,电解反应进行2h后,电流密度迅速降低,说明Au电极表面附着的物质抑制了CO2电还原反应的进行。
图12为CO2在Au电极上连续电解2h测得的恒电位电解曲线,电解电位为-2.0 V。由图可知,电流密度随着电还原反应的进行逐渐减小,说明阴极表面的附着物对CO2电还原反应产生了不利影响,导致电极活性降低。
2.4.4 电流效率计算
恒电位电解过程中,将阴极反应生成的气相产物用气体收集器收集,然后,用微量注射器取样,注入气相色谱仪分析其成分和含量,得到CO2电化学还原生成的CO峰面积随时间的变化如表5所示。计算CO2电还原生成CO的电流效率公式如下:

图12 CO2在Au电极上发生电还原反应的恒电位电解曲线Fig.12 Potentiostatic electrolysis curve for CO2reduction on Au electrode

式中:δ为生成CO的电流效率;S为用气相色谱仪测得的CO的峰面积;S0为标准气体中CO的峰面积,其值为775 709 μV;n0为标准气体中CO的摩尔数,其值为4.464 3×10-6mol;n为转移电子数,其值为2;Q为通过的电量,其值为3 C。
由表5可看出,在电还原反应初期,CO2转化为CO的电流效率较高,随后迅速降低,在60 min后趋于稳定。

表5 生成CO的电流效率随时间的变化Table 5 Time-dependence of the Faradaic efficiencies of CO2reduction to CO
3 结 论
KHCO3水溶液中,CO2可以在Au电极上发生电还原反应,生成CO,但在长周期电解过程中,生成CO的电流效率迅速降低,60 min后趋于稳定,并且平衡电位负移、电荷转移电阻增大及交换电流密度变小。扫描电镜和X射线光电子能谱分析结果表明,电解反应过程中,阴极表面有附着物生成,其主要成分为石墨碳与少量Fe,Zn,由于这些附着物的存在,使电极材料的催化活性迅速降低,从而抑制了CO2电还原反应的进行。
[1]Raudaskoski R, Turpeinen E. Catalytic activation of CO2: use of secondary CO2for the production of synthesis gas and for methanolsynthesis over copper-based zirconia-containing catalysts[J]. Catal Today, 2009, 144(3/4): 318-323.
[2]Kim J S, Lee S B, Choi M J, et al. Performance of catalytic reactors for thehydrogenation of CO2tohydrocarbons[J]. Catal Today, 2006,115(1/4): 228-234.
[3]Gattrel M, Gupta N, Co A. Electrochemical reduction of CO2tohydrocarbons to store renewable electrical energy and upgrade biogas[J]. Energy Conversion and Management, 2007, 48: 1255-1265.
[4]Kaneco S, Katsumatah, Suzuki T, et al. Electrochemical reduction of carbon dioxide to ethylene at a copper electrode in methanol using potassiumhydroxide and rubidiumhydroxide supporting electrolytes[J]. Electrochemica Acta, 2006, 51(16): 3316-3321.
[5]赵 毅, 钱新凤, 张自丽. 二氧化碳资源化技术分析及应用前景[J]. 科学技术与工程, 2014, 14(16): 175-183. Zhao Yi, Qian Xinfeng, Zhang Zili. Technical analysis and application prospect on resource utilization of carbon dioxide[J]. Science Technology and Engineering, 2014, 14(16): 175-183.
[6]王 琳, 姜玄珍. 对ZrO2作为CO2氢化反应催化剂载体的研究[J]. 高效化学工程学报, 1990, 4(3): 284-289. Wang Lin, Jiang Xuanzhen. The studies of ZrO2as catalyst support for CO2hydrogenation[J]. Journal of Chemical Engineering of Chinese Universities, 1990, 4(3): 284-289.
[7]储 伟, 吴玉塘, 罗仕忠. 低温甲醇液相合成催化剂及工艺的研究进展[J]. 化学进展, 2001, 13(2): 128-134. Chu Wei, Wu Yutang, Luo Shizhong. Investigation on the catalysts and reaction process for the methanol synthesis at lower-temperature in liquid phase[J]. Progress in Chemistry, 2001, 13(2): 128-134.
[8]Hori Y, Konishih, Futamura T, et al. “Deactivation of copper electrode” in electrochemical reduction of CO2[J]. Electrochimica Acta,2005, 50(27): 5354-5369.
[9]Wagner C D, Riggs W M, Davis L E, et al.handbook of X-ray Photoelectron Spectroscopy[M]. New York: Perkin-Elmer, 1979: 38-39.
[10]Li Wenzhen. Electrocatalytic reduction of CO2to small organic molecule fuels on metal catalysts[C]// ACS Symposium Series. USA: American Chemical Society, 2010: 55-76.
[11]藤岛昭. 电化学测定方法[M]. 陈 震, 姚建年, 译. 北京: 北京大学出版社, 1995: 139-140.
[12]Bard A J, Faulkner L R. 电化学方法原理和应用[M]. 邵元华, 朱果逸, 译. 北京: 化学工业出版社, 2012: 71-72.
Deactivation Mechanism of Au Electrode in Electrochemical Reduction of CO2
Wang Qin1, Wang Xiaochun2, Yang Dongwei2, Li Lu2, Jia Youjian1, Shi Jin2
1. Faculty of Science, Kunming University of Science and Technology, Kunming 650500, China;2. Faculty of Metallurgical and Energy Engineering, Kunming University of Science and Technology, Kunming 650093, China
The working electrode might get inactivate easily in the process of electrochemical reduction of CO2to CO in aqueous solution. The effects of the deactivation reasons of the Au electrode and the decrease of electrode activity on the reaction during the electrochemical reduction of CO2in KHCO3aqueous solution,and the surface of Au electrode were investigated by scanning electron microscope (SEM) and X-ray photoelectron spectroscopy (XPS).The results showed that a small amount of impurities composed of C graphite and a little of Fe and Zn adsorbed on the surface of the Au electrode. The electrochemical kinetic characteristics of CO2reduction on Au electrode were studied using Tafel curve, Electrochemical impedance spectroscopy(EIS), Linear sweep curve, Potentiostatic electrolysis, and gas chromatographic. As a result, with the reaction going on, the equilibrium potential of CO2conversion to CO shifted to negative, the electron transfer resistance rised up, the exchange current density reduced continuously, and the faradaic efficiency of CO decreased rapidly, which indicated that C graphite and metal adsorbed on the electrode decreased the electrocatalytic activity of Au electrode, andhindered the CO2reduction.
carbon dioxide; electrochemistry reduction; poisoning mechanism; electrode deactivation
TQ151.5+1
A
1001—7631 (2015) 04—0352—07
2014-12-08;
2015-05-11。
王 琴(1989—),女,硕士研究生;贾友见(1966—),男,副教授,通讯联系人。E-mail: jiayoujian@163.com。
国家自然科学基金项目(51164020)。

