熔盐电解-区域熔炼法制备太阳能级硅的工艺研究
孙东亚,何丽雯,廉冀琼,谢 安,曾小兰,杨若绵
(1厦门理工学院 材料科学与工程学院,福建 厦门 361024;2华侨大学 材料科学与工程学院,福建 厦门 361021)
太阳能级硅(SG-Si)是组建太阳能发电站的主要材料,随着近年来光伏产业的快速发展,对SG-Si的需求量急剧增加。目前,工业上制取多晶硅的传统工艺是西门子法,但是,由于其工艺流程长、能耗较高、生产成本较高且环境污染严重,其广泛应用受到限制。而熔盐电解法制取硅流程短、成本低、环境友好,因而越来越受到关注[1-6]。近年来,研究者们在熔盐电解法制取和精炼金属硅方面进行了卓有成效的研究[7-11],但利用熔盐电解SiO2生成硅合金制取纯硅的报道较少[4,6,12]。
本工作选用提纯后的SiO2粉和高纯电极材料,从原料和器具上减少了硼和磷等杂质元素的引入;实验选取较适宜的电解电压(2.6V)和电解温度(850℃),在CaCl2-LiCl电解质体系中先熔盐电解制备出Ca-Si合金,再通过区域熔炼提纯,制得了纯度符合太阳能电池使用的多晶硅。
1 实验
1.1 试剂及工具
SiO2(150~200目),CaCl2(国药 AR),LiCl(国药AR),起弧机。
1.2 实验装置及预电解
实验电解槽为自制装置,如图1所示。按照CaCl2∶LiCl=9∶1(摩尔比)进行混料配成混合电解质,原料SiO2及混合电解质在150℃的烘箱中烘干48h,然后放在干燥箱中备用。先将电解质粉末若干投入到电解槽中预电解:用电弧产生的高温将电解质熔融,电解质部分熔解后,撤离起弧装置,由熔融电解质在外加电流作用下自行导电加热,温度达到600℃后保温2~3h。预电解可以有效驱除电解质中的水分和易挥发性杂质,提高熔盐体系的初始温度。

图1 实验装置图Fig.1 Equipment sketch of experiment
1.3 原理与制备流程
因为由熔盐直接电解SiO2还原制备硅单质与其他物质的水溶液电解不同(Si-O系没有导电性的氧化相),所以,只能采取以金属或化合物导体代替Si-O系氧化物,直接由金属来传递电子完成电解还原反应。当外加电极电动势足够低,直至低于SiO2的理论分解电动电势时,脱氧反应就会在SiO2、金属导体及熔融盐的三相界面处发生[10]。脱氧反应发生后,生成的金属和Si单质将会充当新的导体提供电子转移,整个脱氧反应就会继续在新的三相界面处发生,直至全部还原生成单质。在实际的电解过程中,由于电解质中金属化合物的存在,SiO2电解还原时通过的电流并非全部用于生成目的产物单质Si,导致实际单质Si的量M1低于理论产物的量M0,SiO2直接熔盐电解制备单质硅的电流效率η可表示为

式中:M1为通过单位电量电解实际得到的单质硅的质量;M0为通过单位电量按照法拉第定律计算得到的单质硅的质量。
SG-Si的制备过程如图2所示。将SiO2粉末缓慢加入到电解炉槽中,用温控系统调节控制炉内实际温度,整流器控制输入电压电流参数。每隔4h左右收集沉积在电解槽底部的产物。阴离子在阳极失去电子形成气体释放,产生的气体经过通风管道进行吸收净化达标后排放。产物在真空条件下进行两次区域熔炼后,得到的硅锭削去顶部、底部和四侧的表皮,得到目标产物。

图2 SG-Si的制备过程Fig.2 Schematic diagram of preparation processing for SG-Si
1.4 产物的表征
采用D8Advance型X射线衍射仪(XRD)进行产物的物相表征,X射线源为经Ni滤波的CuKα射线,波长为1.5418nm;使用EVO MA10/LS10型扫描电镜(SEM)观测其微观形貌;原料及产物的杂质元素含量采用7700型电感耦合等离子发射质谱仪(ICP-MS)进行检测。
2 结果与讨论
2.1 原料提纯及电解质选取
原料SiO2的提纯工艺:将SiO2先磨细至一定目级(小于150目),然后用含有氢氟酸的混合酸溶液进行充分酸洗,再进行清洗、过滤和烘干。氢氟酸能渗透到颗粒中杂质富集的缝隙和晶界处与杂质反应,除去绝大部分金属杂质,并对硼和磷有一定去除作用。提纯后的SiO2杂质含量测试数据如表1所示,其中硼元素和磷元素含量均小于0.2×10-6。
氯化钙及其电解质体系较多地用于固体石英和精炼金属硅制备高纯硅的熔盐电解研究[11-14]。从CaCl2-LiCl二元熔度图 可知,CaCl2-LiCl混合可以按任何比例互溶,逐步增加氯化钙中氯化锂的加入量到10%时,可降低混合熔盐的熔点(约30℃),同时可提高熔盐的流动性和电导率。故本工作选择CaCl2为主,LiCl为熔解助剂的混合熔盐。另外,在850℃下,相对 SiO2(-2.02V),CaCl2(-3.45V)和 LiCl(-3.74V)具有更低的电解电动势[15],说明它们的稳定性强于前者,在熔盐中施加槽电压的瞬间不会先于SiO2分解而富集过多的钙锂金属。
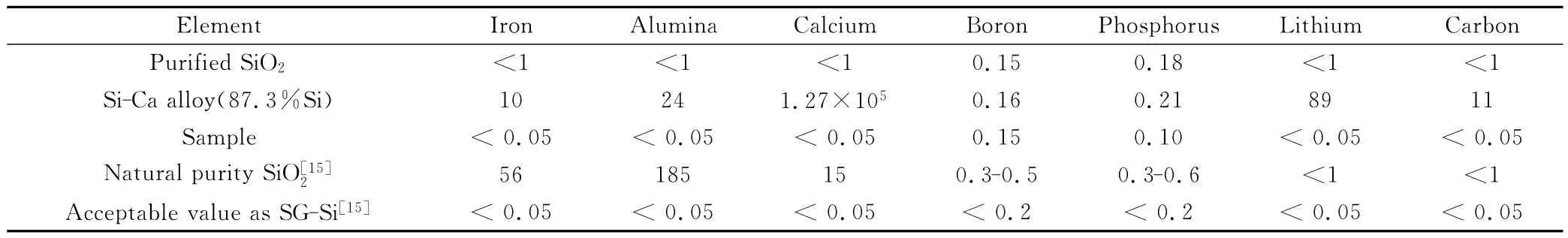
表1 原料及产物中的杂质含量/10-6Table 1 Impurity contents in production and raw material/10-6
钨阴极的使用等同于文献[16]报道的钼丝,作为SiO2“接触电极”,可有效地传导电解过程中迁移电子。石墨套阳极附近SiO2颗粒中的O2-首先迁移出来与石墨发生反应,生成CO2和CO气体,而在钨阴极上会析出金属和硅单质。考虑到减少电解过程中的杂质对产物的渗透污染,自制实验电解槽中直接接触电解质的材料均选择杂质含量较少、且本身具有良好的高温惰性及化学惰性的物质。电解的阴阳极主要电极反应为

2.2 电解温度的选择
电解过程中温度对电解质的密度、黏度、表面张力及还原反应速率等物理化学性质都有重要影响。所以,电解温度选择必须考虑电解体系中的熔盐与原料的熔点特性,以CaCl2-LiCl体系为例,CaCl2与LiCl以摩尔比9∶1互熔时,混合熔盐的熔点约为727℃,而SiO2的熔点为1670℃,其混合物的熔点随着各组分含量的不同变化范围较大。为探索合理的电解温度,在其他条件相同的情况下选择不同的电解温度进行实验,根据收集到的阴极产物计算出不同温度下的电流效率η,如图3所示。

图3 电解温度对电流效率的影响Fig.3 Effect of electrolytic temperature on current efficiency
从图3可以看出,电解温度为700℃时的电流效率为28%左右,随着温度的升高,电流效率增大,在850℃时达最大值49.6%,之后温度进一步升高,电流效率反而减小。这是因为,温度较低时,电解质呈胶着状态,体系的黏度和表面张力较大,影响了离子的迁移和扩散,电流效率较低。随着温度的升高,黏度逐渐减小,离子迁移的动能增加,阻力减小,电流效率得到提高。同时,阳极气体量增大,使得O2-在电解质溶液中的迁移扩散距离减小,电化学还原速度加快,到850℃左右达到峰值。当温度再升高时,电流效率降低的可能原因是:一方面,O2-在电解质中的溶解度增大,实际参与反应的O2-浓度减小,根据化学反应动力学可知不利于其在阳极反应析出;另一方面,高温也加速了电解质的挥发,造成CaCl2与LiCl电解质的损失。故反应温度设定为 850℃,这与Yasuda 等[13,14,16,17]在CaCl2熔盐中SiO2阴极脱氧制取硅时的电解温度相当。
2.3 电解槽电压的选择
图4为电解产物组成与槽电压的关系。可以看出,电解槽电压低于2.0V时,生成产物量较少,之后随着电压值的增大,产物中硅及产物总量逐渐增加,到2.6V左右时产物中硅的含量达到最大值(87.3%)。当电压高于2.6V后,产物中硅的含量也会降低。这说明,较低电压时,由于熔盐与电极极化现象不可避免引起欧姆电压和超电压的消耗。另外,由于阳极为析气反应,气体的生成吸附在阳极上形成气膜,使电解液在电极上的润湿性变差,也会消耗一定的电动势。这样,加在SiO2颗粒上的实际分解电动势可能远小于槽电压值,O2-脱离出Si═ O键的动力不足,Si4+实际浓度较小,Si4+由熔体向双电层移动并继续经双电层向阴极电极表面的扩散过程变缓,故产物中硅含量较低。同时,低电压也会造成Si4+向Si2+副反应的发生,从而形成钙硅合金。随着电压的升高,加在电极上的电动势达到理论电动势(2.02V),硅析出为主要阴极反应,产物中硅含量增多。槽电压到2.6V时,单位时间内有效电流密度达到最大值,产物的总量也接近最大值(89.4g)。之后,由于槽电压升高,电流密度达到最大值后,扩散不能及时向电极表面供应足够数量的阳离子而开始使电极反应速率变慢。同时,槽电压值逐渐接近Ca2+析出的电动势,Ca在产物中的含量增多,硅的相对含量降低。

图4 产物组成与槽电压的关系Fig.4 Relationship with the product composition and electrolytic voltage
阴极金属离子沉积模型如图5所示。硅及杂质金属原子在钨阴极上的沉积是由里向外沉积的,每层由硅和少量金属原子组成,由于硅导电性较差,电子不容易通过硅进行迁移,每多沉积一定数量的硅,有效电流密度就发生一定的下降,Si4+在阴极的吸附越来越困难,且下一层电解沉积只能发生在里层金属部位。由于靠近金属的部位优先沉积分解电动势较小的硅,外层的金属粒子越来越少,沉积一定的层厚(约几百纳米)后,有效传导电流很小,电流空耗严重,硅沉积的速度变得越来越缓慢。电压再升高时,并不能增加电流密度和硅沉积的速度,只会缩短沉积开始到沉积平衡的时间,相同时间内电解沉积产物的总量反而会减小,硅含量也会随之减小,故较为适宜的电解电压为2.6V。从电解产物SEM图像(图6)也可以看出,合金粉呈不规则片状,这进一步说明上述阶段性的沉积过程的可能性。到达沉积反应阶段后,再用增大极化的方法已不可能再增大电极反应速率,只能靠采取强化扩散的措施。为确保电解反应的有效持续,本工作采取定时将钨阴极上的沉积层清理的方法,取得了较好的效果。
2.4 物相分析

图5 阴极离子沉积示意图Fig.5 Schematic diagram of ion deposition on cathode

图6 电解产物的SEM图Fig.6 SEM image of electrolytic product
图7为电解产物的XRD图谱。对照单质硅(PDF:27-1402)、CaSi合金相(PDF:26-0324)及 CaSi2合金相(PDF:01-1276)标准谱线,电解产物图谱除了Si的特征峰出现外,CaSi及CaSi2的衍射峰也存在,说明在此条件下,有钙硅合金生成。由于硅锂合金特征衍射峰的角度分布范围较宽,且许多特征衍射峰的位置与钙硅合金非特征衍射峰可能重叠,单从XRD图谱上很难确定是否有硅锂合金的生成。电解产物的ICP-MS元素分析结果显示,锂元素的含量小于100×10-6,说明几乎没有钙锂合金的生成,这可能与氯化锂较大的分解电动势有关。另外,从衍射峰强度来看,钙硅合金相的特征峰强度较硅小,说明产物中合金相生成的量较少,这与合金含量分析中钙的结果(12.7%)相符。

图7 电解产物的XRD图谱Fig.7 XRD patterns of electrolytic product
2.5 电解产物的后处理
表1列出了电解及区熔提纯后产物中的杂质含量数据。说明用提纯后的SiO2粉末为原料,电解后合金粉中硼、磷、金属和碳含量均有升高,这说明熔盐、电极材料及电解槽中存在的杂质在电解过程中会渗透到产物中,需要电解后提纯处理。表2为各元素在硅熔点下的分凝系数[19]。可知,除B外,合金产物中的钙及其他杂质元素比硅的分凝系数小,通常可以通过真空凝固的方法来进行分离去除[13]。区域熔炼的过程在真空下石英坩埚中进行,钙等金属杂质会分离于固液界面处,最终凝固在硅锭的顶部、底部及四个侧面。经过两次区熔提纯,并将硅锭的顶部、底部及侧面部分表皮切割后,剩余的硅锭(约85%区域)中金属杂质去除率在99.9%以上,磷和碳元素降低,硼含量变化很小,这与各元素在真空下分凝系数的差异有关。从最终产物的元素含量看来,硼的含量为0.15×10-6,磷的含量为0.10×10-6,其他各杂质元素及总含量水平均符合太阳能级硅的标准。

表2 各元素在硅熔点下的分凝系数[19]Table 2 Distribution coefficient in silicon at the melting point of silicon[19]
3 结论
(1)以高纯SiO2粉末为原料,在CaCl2与LiCl的混合熔盐(摩尔比9∶1)中,高纯钨和石墨坩埚为电极材料,电解温度850℃、槽电压2.6V,经4h以上电解可在阴极上沉积钙硅合金。
(2)电解产物经过两次区域熔炼后,最终产物中硼的含量为0.15×10-6,磷的含量为0.10×10-6,其他各杂质元素及总含量水平均符合太阳能级硅的标准。
[1]RAO G M,ELWELL D,FEIGELSON R S.Electrowinning of silicon from K2SiF6-molten fluoride systems[J].Journal of the Electrochemical Society,1980,127(9):1940-1944.
[2]BIEBER A L,MASSOT L,GIBILARO M,et al.Silicon electrodeposition in molten fluorides[J].Electrochimica Acta,2012,62(2):282-289.
[3]HU Y,WANG X,XIAO J,et al.Electrochemical behavior of silicon(IV)ion in BaF2-CaF2-SiO2melts at 1573K[J].Journal of the Electrochemical Society,2013,160(3):81-84.
[4]ERGÜL E,KARAKAYAĪ,ERDOGˇAN M.Electrochemical decomposition of SiO2pellets to form silicon in molten salts[J].Journal of Alloys and Compounds,2011,509(3):899-903.
[5]HAARBERG G M,FAMIYEH L,MARTINEZ A M,et al.Electrodeposition of silicon from fluoride melts[J].Electrochimica Acta,2013,100:226-228.
[6]XIAO W,JIN X B,DENG Y,et al.Rationalisation and optimisation of solid state electro-reduction of SiO2to Si in molten CaCl2in accordance with dynamic three phase interlines based voltammetry[J].Journal of Electroanalytical Chemistry,2010,639(1):130-140.
[7]MASSOT L,BIEBER A,GIBILARO M,et al.Silicon recovery from silicon-iron alloys by electrorefining in molten fluorides[J].Electrochimica Acta,2013,96:97-102.
[8]YASUDA K,NOHIRA T,KOBAYASHI K,et al.Improving purity and process volume during direct electrolytic reduction of solid SiO2in molten CaCl2for the production of solar-grade silicon[J].Energy Technology,2013,1(4):245-252.
[9]CAI J,LUO X,LU C,et al.Purification of metallurgical grade silicon by electrorefining in molten salts[J].Transactions of Nonferrous Metals Society of China,2012,22(12):3103-3107.
[10]王淑兰,陈晓云.CaCl2-NaCl-CaO熔盐中电解精炼Si的研究[J].金属学报,2012,48(2):183-186.WANG Shu-lan,CHEN Xiao-yun.Study on the electro-refining silicon in molten salt CaCl2-NaCl-CaO[J].Acta Metallurgica Sinica,2012,48(2):183-186.
[11]CAI J,LUO X,HAARBERG G M,et al.Electrorefining of metallurgical grade silicon in molten CaCl2based salts[J].Journal of the Electrochemical Society,2012,159(3):155-158.
[12]OISHI T,WATANABE M,KOYAMA K,et al.Process for solar grade silicon production by molten salt electrolysis using aluminum-silicon liquid alloy[J].Journal of the Electrochemical Society,2011,158(9):93-99.
[13]YASUDA K,NOHIRA T,HAGIWARA R,et al.Direct electrolytic reduction of solid SiO2in molten CaCl2for the production of solar grade silicon[J].Electrochimica Acta,2007,53(1):106-110.
[14]NOHIRA T,YASUDA K,ITO Y.Pinpoint and bulk electrochemical reduction of insulating silicon dioxide to silicon[J].Nature Materials,2003,2(6):397-401.
[15]梁英教,车阴昌.无机物热力学数据手册[M].沈阳:东北大学出版社,1993.LIANG Ying-jiao,CHE Yin-chang.Handbook of Thermodynamic Data of Inorganic Substances[M].Shengyang:Northeastern University Press,1993.
[16]YASUDA K,NOHIRA T,ITO Y.Effect of electrolysis potential on reduction of solid silicon dioxide in molten CaCl2[J].Journal of Physics and Chemistry of Solids,2005,66(2):443-447.
[17]YANG X,YASUDA K,TOSHIYUKI N,et al.Reaction be-havior of stratified SiO2granules during electrochemical reduction in molten CaCl2[J].Metallurgical and Materials Transactions B,2014,45(4):1337-1344.
[18]TOBA T,YASUDA K,NOHIRA T,et al.Fundamental study on reduction rate for electrolytic reduction of SiO2powder in molten CaCl2[J].ECS Transactions,2013,50(11):119-126.
[19]TRUMBORE F A.Solid solubilities of impurity elements in germanium and silicon[J].Bell System Technical Journal,1960,39(1):205-233.

