合成Cu2ZnSnS4薄膜四元共电沉积机理与退火相转变
贺显聪,郝 菀,皮锦红,张传香,沈鸿烈
(1南京工程学院 材料工程学院,南京 211167;2江苏省先进结构材料与应用技术重点实验室,南京 211167;3南京航空航天大学
材料科学与技术学院,南京 210016)
Cu2ZnSnS4(CZTS)的直接带隙约1.5eV,与太阳光谱的响应较好,在可见光波段吸收系数为104~105cm-1,适合用于制备薄膜太阳电池吸收层[1]。CZTS薄膜制备方法有真空法[2-5]和非真空法[6-10],其中非真空法中电化学沉积制备最具有工业化前景。电化学沉积制备CZTS薄膜主要通过电沉积Cu-Sn-Zn预制层(分步电沉积和三元共电沉积)及后续硫化方法来制备[11-16],这些方法制备的CZTS薄膜结晶性能优异,薄膜成分比例控制精确[17],但制备的CZTS薄膜中不可避免地存在杂相,在后续硫化过程中引入硫时也容易使薄膜中产生空洞缺陷,不利于制备高质量的CZTS薄膜;另外,工艺复杂,较难控制。为简化工艺,降低制备成本,提高制备CZTS薄膜的质量,研究人员提出了电化学原子层沉积法[18,19],基于对组分元素交替欠电位沉积,从而循环形成化合物半导体。Zhang等[20]运用电化学原子层外延原理在Ag衬底上合成了CZTS,其直接带隙为1.5eV。Jeon等[21]和 Cui等[22]也研究了添加复杂络合剂及改变硫源含量等对合成CZTS组织形貌的影响,提高了膜层沉积质量。采用纯钼片作为衬底,钼和CZTS有良好的欧姆接触,并且有较好的导电性和稳定性,适合于做太阳电池的引出端。但对在纯钼片衬底上直接共电沉积制备四元CZTS的电化学生长机理及预制层退火过程中的相转变的报导较少。因此,本工作以钼片为衬底,通过电化学沉积金属预制层后续硫化退火,研究四元共电沉积预制层机理,溶液配方及工艺参数,并分析了钼衬底上电沉积预制层退火过程中的相转变机制。
1 实验
在100mL烧杯中倒入80~90mL超纯水,将基体溶 液 (0.335MNaOH,0.152MC4H6O6,0.11M C6H5Na3O7)加入烧杯中搅拌均匀,调整pH=6~7左右,然后将CuSO4·5H2O,ZnSO4·7H2O和SnCl2·2H2O顺序加入烧杯中,最后,用超纯水将烧杯加满至100mL。在准备好的钼衬底上,室温下将配置好的溶液共电沉积制备预制层。氩气保护下,采用封闭管式炉分别在200,300,350,400,450,500,550,600℃对预制层恒温退火60min,升温速率为10℃/min。
采用电化学工作站(PARSTAT 2273)进行电沉积预制层及循环伏安测试;使用X射线衍射仪(Ultima-Ⅳ)检测薄膜的相转变;采用扫描电镜(JSM-6360LV)观察薄膜表面形貌;利用能谱仪(GENESIS2000XMS60)分析薄膜的成分;拉曼光谱检测杂质相;带可见光源数字源(2450)测量薄膜的光电特性。
2 结果与讨论
2.1 共电沉积四元预制层的机理
在基体溶液基础上加入Na2S2O3·5H2O配成溶液,进行循环伏安特性曲线分析,扫描速率为1mV·s-1,扫描范围为-1.4~0V,如图1(a)所示。可知,硫元素在-1.4~0V电位范围内没有出现明显的氧化还原峰,不能独自电沉积硫元素。再加入CuSO4·5H2O,ZnSO4·7H2O,SnCl2·2H2O配成四元共电沉积溶液,测定其循环伏安特性曲线,如图1(b)所示。可知,当电位低于-0.05V时,溶液中回路电流发生急剧变化,Cu2+开始快速往阴极定向迁移,阴极衬底附近的硫代硫酸根离子在酸性溶液中发生离解反应提供硫源。根据硫元素的能斯特方程计算还原电位约为0.6V,6H++2S2O2-3+4e→2S+3H2O,在负电位作用下,不能独自在衬底上电沉积析出。但根据文献[18]中电化学原子层外延机理,硫源与衬底附近的Cu2+发生化学反应生成CuS,其反应式为:Cu2++S+2e→CuS,在负电位的作用下在衬底上沉积。同样,当电位降低到-0.5V时,Sn2+开始快速往阴极衬底迁移,并与硫源作用生成SnS,发生电化学反应:Sn2++S+2e→SnS,并在负电位的作用下在衬底上沉积。电位降到-1.05V时,Zn2+也往阴极衬底快速迁移,Zn2+与S原子反应:Zn2++S+2e→ZnS,以硫化物的形态沉积在衬底表面。所以,为了使三种金属离子都能沉积在衬底表面,必须保证电沉积恒电位低于-1.05V,同时,析出来的硫化物为半导体特性,会增加阴极的阻抗,阻止电沉积的发生,但从实验的结果看并没有出现这种现象。因此,金属离子和硫原子是交替沉积在衬底上的。电沉积实验表明,在钼衬底上单独电沉积Sn和Zn都较为困难,所以,共沉积时最先沉积的是Cu,然后,Sn和Zn才能更加容易地在Cu上沉积。由此可以认为,预制层薄膜是原子交替沉积在衬底表面而形成的,且以Cu/S/Sn/S/Cu/S/Zn/S……顺序进行。

图1 循环伏安特性曲线 (a)基体溶液加Na2S2O3·5H2O;(b)四元共电沉积溶液Fig.1 The cyclic voltammeter curves (a)matrix solution with Na2S2O3· 5H2O;(b)quaternary co-electrodeposited solution
2.2 四元共电沉积预制层溶液配方优化
2.2.1 Na2S2O3·5H2O含量的优化
配制100mL含0.16MCuSO4·5H2O,0.33MZn-SO4·7H2O,0.08MSnCl2·2H2O,0.335MNaOH,0.152MC4H6O6,0.11MC6H5Na3O7的溶液,分别加入0.4,0.5,0.6,0.7,0.8,0.9g的 Na2S2O3·5H2O。根据四元共电沉积循环伏安特性曲线,选取恒定电位-1.2V,电沉积5min制备预制层,预制层在氩气气氛保护下550℃退火1h,XRD分析如图2所示。溶液中Na2S2O3·5H2O为0.6g时,预制层退火后的薄膜出现晶面指数为(101),(112),(200),(220),(312),(400)及(332)的衍射峰都属于CZTS物相,除了这些衍射峰外,还存在一些衍射峰与CZTS标准衍射图谱不一致,而与CuS相的标准衍射峰图谱匹配较好。随着Na2S2O3·5H2O含量增加,杂相衍射峰的强度高于CZTS物相的主峰。因此,不能加入太高含量的Na2S2O3·5H2O。通过与标准PDF卡片对照分析,所出现的杂相仍为CuS。这主要是因为随着Na2S2O3·5H2O浓度的增大,电沉积液中的硫含量较高,加快了Cu离子和S原子的沉积速率,使得衬底上沉积较多的CuS物相。实验发现,Na2S2O3·5H2O含量为0.4g较为合适,在此基础上调节其余成分的浓度。

图2 不同Na2S2O3·5H2O含量合成的CZTS薄膜XRD图Fig.2 XRD patterns of CZTS films synthesized with different contents of Na2S2O3·5H2O
2.2.2 CuSO4·5H2O含量的优化
从图2实验结果可以看出,Na2S2O3·5H2O为0.4g时,原配方中Cu的沉积速率仍过快,也就是溶液中Cu2+浓度仍有些偏高,现保持其他溶质浓度不变,降低溶液中CuSO4·5H2O的含量,从而降低其Cu2+的电沉积速率。分别加入0.18,0.22,0.3g的CuSO4·5H2O配制溶液,电沉积预制层在氩气气氛保护下550℃退火1h,XRD分析结果如图3所示。可知,虽然电沉积溶液中的Cu2+浓度降低,但是膜层中仍出现CuS的杂相。但随着Cu2+浓度的增加,CuS杂相的含量减少。当溶液中CuSO4·5H2O含量增加到0.3g时,已经基本没有CuS杂相。从这一现象可以得出,随着溶液中Cu2+浓度的降低,不仅使得Cu的沉积速率减慢,也减缓了Sn的沉积速率,而Sn减缓得更快,电沉积完成后膜层中的CuS量超出了SnS量,导致退火后多余的CuS无法转变为三元化合物或四元CZTS。由于ZnS物相(PDF:00-001-0792)的所有衍射峰位与CZTS物相(PDF:01-075-4122)衍射峰位仅相差大约0.2°,XRD无法精确判别这一因素是否也会影响Zn的沉积速率,当溶液中CuSO4·5H2O含量为0.3g时,CuS和SnS的沉积速率达到平衡,所以,基本上看不到有杂相衍射峰存在。

图3 不同CuSO4·5H2O含量合成的CZTS薄膜XRD图Fig.3 XRD patterns of CZTS films synthesized with different contents of CuSO4·5H2O
2.2.3 SnCl2·2H2O含量的优化
通过调整Na2S2O3·5H2O和CuSO4·5H2O成分后,将电沉积的预制层在550℃退火1h后进行形貌和成分分析,如图4所示。从图4(a)中可以看出,薄膜中含有球形的Cu2ZnSnS4物相,整体形貌较均匀。EDS成分分析可知(图4(b)),膜层中Sn元素含量明显偏低,这将会导致反应无法完全生成CZTS相,同时,也证实了CuSO4·5H2O含量过高会出现CuS杂相。Zn元素含量偏高,在最终的膜层中有多余的ZnS相,而ZnS相的衍射峰基本与CZTS峰相似,所以单靠XRD无法检测出来。
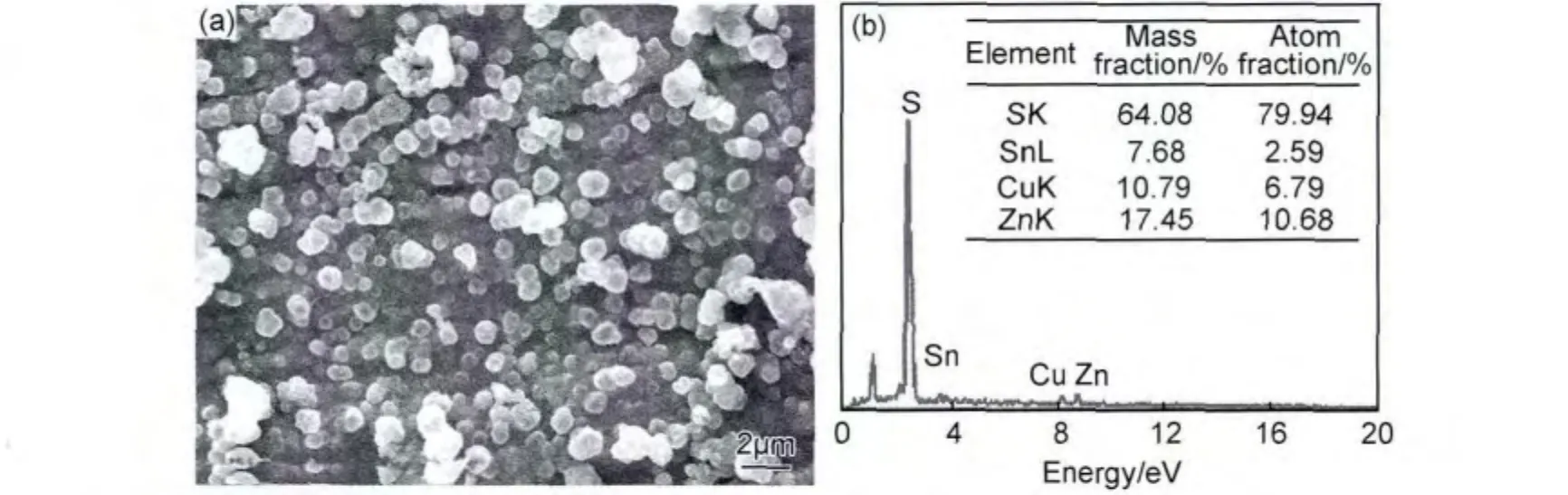
图4 优化Na2S2O3·5H2O和CuSO4·5H2O含量合成的CZTS (a)形貌;(b)EDSFig.4 Synthesized CZTS by optimizing content of Na2S2O3·5H2O and CuSO4·5H2O (a)morphology;(b)EDS
综上分析,必须增加膜层中Sn元素的含量,满足Cu∶Sn原子比为2∶1,即通过增加电沉积溶液中Sn2+的浓度来提高其沉积速率,故在原溶液中加入0.18g SnCl2·2H2O基础上增加其含量,将0.25,0.28,0.31,0.34g SnCl2·2H2O分别加入溶液中进行实验,整个实验过程保持电沉积条件不变,溶液中其他溶质含量也不变。在氩气保护下,将试样550℃退火1h,XRD分析结果如图5所示。当SnCl2·2H2O含量为0.25g和0.28g时,薄膜又出现了CuS的杂峰,且随着溶液中Sn2+浓度的增加,膜层中CuS的含量升高。当SnCl2·2H2O含量增加到0.31g和0.34g时,Sn和Cu的沉积速率达到平衡。当SnCl2·2H2O含量为0.31g时,薄膜中原子比为Cu∶Zn∶Sn=15.11∶23.17∶7.7,Cu和Sn的原子个数比已经接近理论值2∶1,但是,Zn含量严重偏高。而SnCl2·2H2O含量为0.34g时,膜层中原子比例为Cu∶Zn∶Sn=14.34∶24.5∶11.12,Cu和Sn原子个数比小于理论值2,Zn元素也是严重偏高。结合图4(b)可以证实,随着Sn2+浓度的升高,Cu和Sn的沉积速率都会加快,同时,也会加快Zn的电沉积速率。可以认为,当SnCl2·2H2O含量为0.31g时,生成的物相衍射峰接近CZTS标准图谱,但由于ZnS衍射峰与CZTS衍射峰仅相差约0.2°,所以,不能在衍射图谱上看出ZnS的杂相。
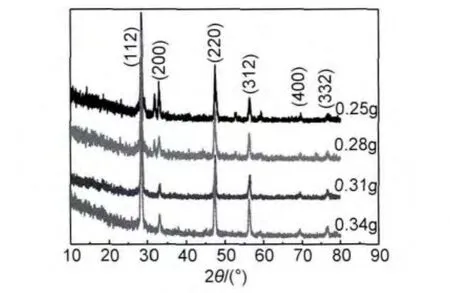
图5 不同SnCl2·2H2O含量合成的CZTS薄膜XRD图Fig.5 XRD patterns of CZTS films synthesized with different contents of SnCl2·2H2O
2.2.4 ZnSO4·7H2O含量的优化
由于膜层中Zn元素的含量严重偏高,从0.8g开始以0.1g为单位降低ZnSO4·7H2O含量进行实验,物相分析结果如图6所示。不同ZnSO4·7H2O含量各试样分析的X射线衍射谱都与CZTS标准衍射图谱接近,并没有其他杂相衍射峰的出现,说明在调节Zn含量过程中,Zn2+的浓度并没有严重影响Cu和Sn的电沉积速率,而是始终保持以比例形式沉积在钼衬底上。对ZnSO4·7H2O含量为0.4g的试样进行成分分析,各元素的原子比为Cu∶Zn∶Sn∶S=23.56∶11.62∶10.38∶54.44,基本和CZTS化合物的化学计量比相一致。通过实验优化得到钼衬底上四元共电沉积预制层的溶液配方和电沉积工艺参数,如表1所示。

图6 不同ZnSO4·7H2O含量合成的CZTS薄膜XRD图Fig.6 XRD patterns of CZTS films synthesized with different contents of ZnSO4·7H2O

表1 钼衬底上四元共电沉积预制层的溶液配方及工艺参数Table 1 Compositions and parameters of the quaternary co-electrodeposited electrolyte for preparing precursor on Mo substrate
2.3 四元共电沉积预制层退火过程的相转变
按照优化出来的配方恒定电位为-1.2V,电沉积时间为5min,制备一批实验参数完全相同的预制层,分别进行200,300,400,500,550,600℃退火保温1h,XRD分析结果如图7所示。可知,四元共沉积的预制层薄膜的主要衍射峰与CuS,ZnS,SnS物相的标准衍射图谱吻合,这与原子层外延电沉积原理[17]是一致的。但是,这三种物相的所有晶面衍射峰并没有全部出现,并且衍射峰也有些宽化,说明电化学沉积原子层外延反应过程中物相的结晶性并不是很好,衍射晶面较弱的峰测试分析不出来。观察该样品的形貌(图8(a)),明显分辨出电沉积膜层是层状的,且膜层比较致密均匀,晶体颗粒较为细小,膜层上还分布着颗粒状物质。同时对此样品进行成分分析,样品薄膜面扫描平均原子比为Cu∶Zn∶Sn∶S=23.57∶11.46∶11.96∶53.00,基本和CZTS物相的化学计量比吻合。A区域各元素原子比为Cu∶Zn∶Sn∶S=13∶12.53∶11.19∶63.28,推测大概为致密的 CuS/SnS/ZnS交替层。B区主要为颗粒状CuS。结合图8(a)和成分分析的结果也证实了共电沉积薄膜的形成机理。

图7 不同温度退火1h后钼衬底上预制层的 XRD图 (a)室温,200,300℃;(b)400,500,550,600℃Fig.7 XRD patterns of the annealed precursors at different temperatures for 1hon Mo substrate(a)room temperature,200,300℃;(b)400,500,550,600℃
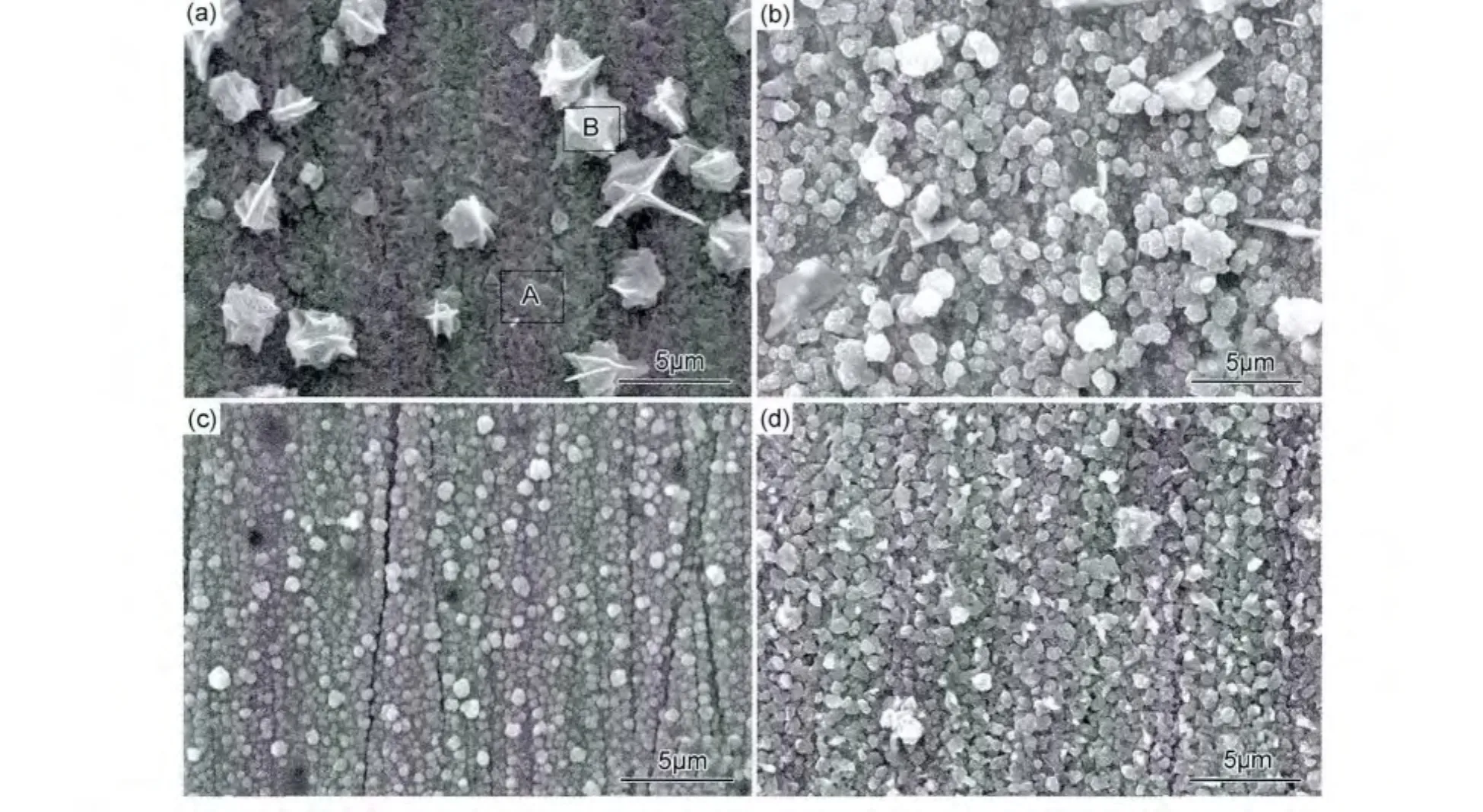
图8 不同温度下退火1h的预制层微观形貌 (a)室温;(b)200℃;(c)400℃;(d)550℃Fig.8 SEM images of the annealed precursors at different temperatures for 1h (a)room temperature;(b)200℃;(c)400℃;(d)550℃
经200℃退火后,原子开始发生扩散和重排,膜层开始出现三元 Cu2(3)SnS3(4)衍射峰,也有少量的 CZTS生成。图8(b)为200℃退火后观察到的微观形貌,颗粒状物质分布在致密的膜层表面,且还保留着一些块状的二元硫化物相。经400℃退火后,膜层中出现强度较高的CZTS衍射峰,基本观察不到杂相峰的存在。从图8(c)中可以看出,颗粒大小开始均匀一致,膜层也较为致密,但晶粒细小,在400℃下退火并不能使原子充分扩散形成CZTS物相,膜层中可能依然存在三元硫化物相。根据图7(b)分析,在高于400℃的温度下退火得到的物相衍射峰已经基本接近CZTS标准衍射图谱,其中主要峰晶面指数为(101),(112),(200),(220),(312),(400),(332)。当退火温度达到550℃时,各晶面的衍射峰与CZTS的标准衍射图谱完全对应一致,膜层较为均匀、致密,晶粒也变粗大。预制层550℃退火1h的成分分析如图9(a)所示,样品中各元素的原子比为Cu∶Zn∶Sn∶S=23.72∶12.22∶13.07∶50.99,基本与CZTS化合物计量比一致。为进一步分析其相微结构,对薄膜样品进行拉曼分析,如图9(b)所示,结果发现在~253,~284,~336,~352cm-1和~372cm-1出现拉曼峰,其中~336cm-1处为最强峰,这与文献[9]报道的CZTS拉曼光谱基本一致。
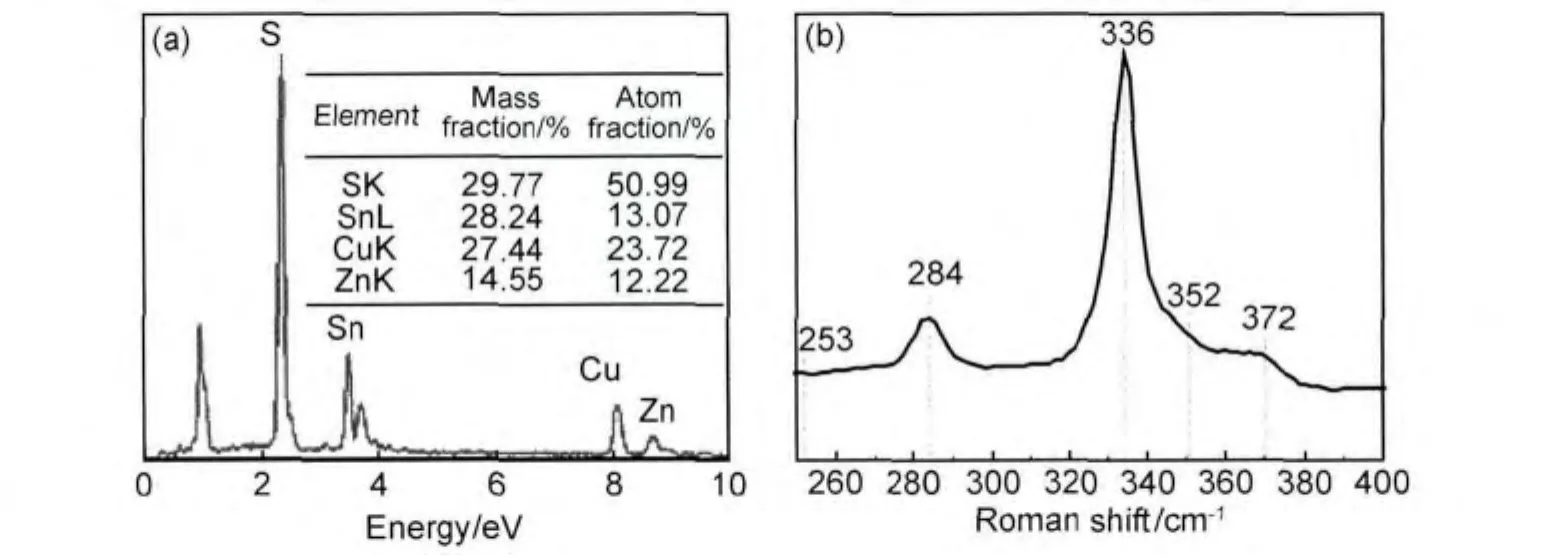
图9 预制层550℃退火1h后的EDS分析(a)和拉曼光谱(b)Fig.9 EDS analysis(a)and Raman spectra(b)of the precursor by annealing at 550℃for 1h
使用银浆和金线在制备的CZTS薄膜上作引线,保证引线与CZTS薄膜欧姆接触。采用四探针法分别测试暗态和在辐照灯功率为3mW·cm-2光照下测得的I-V 曲线,其结果如图10(a)所示。从I-V 曲线明显看出光电流存在。图10(b)为光响应测试结果,在无外加偏置电压情况下光电流达到约60nA,证实所制备的CZTS薄膜具有非常好的光响应性。

图10 550℃退火1h后制备的CZTS薄膜光电性能 (a)I-V曲线;(b)光响应Fig.10 The photoelectric properties of CZTS film annealed at 550℃for 1h (a)I-Vcurves;(b)photocurrent response
3 结论
(1)通过控制变量法优化得到100mL溶液配方:0.3g CuSO4·5H2O,0.4g ZnSO4·7H2O,0.31g SnCl2·2H2O,0.4g Na2S2O3·5H2O,0.34g NaOH,3.26g C6H5Na3O7,2.28g C4H6O6,以纯 Mo片为衬底,沉积电位为-1.2V,电沉积时间为5min。
(2)电沉积过程中,Cu2+和Sn2+浓度变化影响其本身和其他元素的沉积速率,而Zn2+浓度变化仅影响其本身沉积速率。四元共电沉积预制层以原子层外延为机理,在负电位作用下,Cu2+先电沉积在衬底表面,且与S化学反应生成CuS,Sn和Zn离子以同样方式交替沉积。
(3)二元硫化物组成的预制层随退火温度升高逐渐相互反应,转变为三元硫化物 Cu2(3)SnS3(4)和四元硫化物CZTS。550℃退火1h合成的CZTS薄膜原子比为Cu∶Zn∶Sn∶S=23.72∶12.22∶13.07∶50.99,与CZTS化合物计量比基本一致,且制备的CZTS薄膜光响应性好。
[1]JIANG F,SHEN H L,WANG W,et al.Preparation and properties of Cu2ZnSnS4absorber and Cu2ZnSn S4/amorphous silicon thin-film solar cell[J].Appl Phys Express,2011,4(7):074101.
[2]SCHUBERT B A,MARSEN B,CINQUE S,et al.Cu2ZnSnS4thin film solar cells by fast coevaporation[J].Prog Photovolt:Res Appl,2011,19(1):93-96.
[3]YOO H,KIM J.Growth of Cu2ZnSnS4thin films using sulfurization of stacked metallic films[J].Thin Solid Films,2010,518(22):6567-6572.
[4]NAKAVAMA N,ITO K.Sprayed films of stannite Cu2ZnSnS4[J].Appl Surf Sci,1996,92:171-175.
[5]KISHORE K Y B,SURESH B G,UDAV B P,et al.Preparation and characterization of spray-deposited Cu2ZnSnS4thin films[J].Sol Energy Mater Sol Cells,2009,93(8):1230-1237.
[6]TANAKA K,FUKUI Y,MORITAKE N,et al.Chemical composition dependence of morphological and optical properties of Cu2ZnSnS4thin films deposited by sol-gel sulfurization and Cu2ZnSnS4thin film solar cell efficiency[J].Sol Energy Mater Sol Cells,2010,95(3):838-842.
[7]YEH M Y,LEE C C,WUU D S.Influences of synthesizing temperatures on the properties of Cu2ZnSnS4prepared by sol-gel spincoated deposition[J].J Sol-Gel Sci Tech,2009,52(1):65-68.
[8]FISCHEREDER A,RATH T,HAAS W,et al.Investigation of Cu2ZnSnS4formation from metal salts and thioacetamide[J].Chem Mater,2010,22:3399-3406.
[9]SCHURR R,HOLZING A,JOST S,et al.The crystallisation of Cu2ZnSnS4thin film solar cell absorbers from co-electroplated Cu-Zn-Sn precursors[J].Thin Solid Films,2009,517:2465-2468.
[10]ARAKI H,KUBO Y,JIMBO K,et al.Preparation of Cu2ZnSnS4thin films by sulfurization of co-electroplated Cu-Zn-Sn precursors[J].Phys Status Solidi C,2009,(6):1266-1268.
[11]ENNAOUI A, LUX-STEINER M, WEBER A,et al.Cu2ZnSnS4thin film solar cells from electroplated precursors:novel low-cost perspective[J].Thin Solid Films,2009,517:2511-2514.
[12]SCRAGG J J,DALE P J,PETER L M.Synthesis and characterization of Cu2ZnSnS4absorber layers by an electrodepositionannealing route[J].Thin Solid Films,2009,517:2481-2484.
[13]SCRAGG J J,DALE P J,PETER L M,et al.New routes to sustainable photovoltaics:evaluation of Cu2ZnSnS4as an alternative absorber material[J].Phys Stat Sol(B),2008,245(9):1772-1778.
[14]ARAKI H,KUBO Y,MIKADUKI A,et al.Preparation of Cu2ZnSnS4thin films by sulfurizing electroplated precursors[J].Sol Energy Mater Sol Cells,2009,93(6-7):996-999.
[15]SCRAGG J J,DALE P J,PETER L M.Towards sustainable materials for solar energy conversion:preparation and photoelectrochemical characterization of Cu2ZnSnS4[J].Electrochem Commun,2008,10(4):639-642.
[16]PAWAR S M,PAWARA B S,MOHOLKARA A V,et al.Single step electrosynthesis of Cu2ZnSnS4(CZTS)thin films for solar cell application[J].Electrochimica Acta,2010,55(12):4057-4061.
[17]江丰,沈鸿烈.Cu2ZnSnS4薄膜及其太阳电池的研究进展[J].半导体光电,2011,32(6):758-759.JIANG F,SHEN H L.Research progresses on Cu2ZnSnS4film and related solar cell[J].Semiconductor Optoelectronics,2011,32(6):758-759.
[18]GREGORY B W,STICKNEY J L.Electrochemical atomic layer epitaxy(ECALE)[J].J Electroanalytical Chem,1991,300:543-561.
[19]VILLEGAS I,STICKNE J L.Preliminary studies of GaAs deposition on Au(100),(110)and(111)surfaces by electrochemical atomic layer epitaxy[J].J Electroanalytical Chem,1992,139:686-694.
[20]ZHANG X,SHI X Z,YE W C,et al.Electrochemical deposition of quaternary Cu2ZnSnS4thin films as potential solar cell material[J].Appl Phys A,2009,94:381-386.
[21]JEON M,TANAKA Y,SHIMIZU T,et al.Formation and characterization of single-step electrodeposited Cu2ZnSnS4thin films:effect of complexing agent volume[J].Energy Procedia,2011,10:255-260.
[22]CUI Y F,ZUO S H,JIANG J C,et al.Synthesis and characterization of co-electroplated Cu2ZnSnS4thin films as potential photovoltaic material[J].Sol Energy Mater Sol Cells,2011,95(8):2136-2140.

