可见光活性氮掺杂纳米二氧化钛研究进展
曹文斌,许军娜,刘文秀,孙 芃,张 欣
(北京科技大学 材料科学与工程学院,北京 100083)
1972年日本东京大学Fujishima等[1]发现二氧化钛(TiO2)单晶电极在紫外光照射下可将水分解为氢气和氧气,而后Frank等[2]于1977年利用TiO2光催化剂成功地降解了水中的氰化物,自此,光催化技术得到了广泛的关注。光催化过程是将光能转换为化学能,光是光催化能量的来源。当用能量大于等于禁带宽度的光照射TiO2半导体时,价带上的电子会被激发跃迁至导带,同时在价带上产生相应的空穴。光生电子与空穴迁移到TiO2表面与表面吸附氧或水反应,生成具有强氧化性的羟基自由基(OH·)和超氧自由基()等活性基团,这些活性基团可以将有机污染物分解而起到光催化降解作用。但是TiO2的禁带宽度较宽(锐钛矿相TiO2禁带宽度Eg=3.2eV),只能吸收紫外光(约占太阳光3%~5%),绝大部分的可见光(45%)不能被充分地利用,限制了其对光的利用效率和在实际中的应用。此外,电子-空穴对也会在TiO2内部或表面复合,降低光催化效率。因此,拓宽TiO2的光响应范围,降低光生电子与空穴的复合几率,提高太阳光的利用率和TiO2光催化活性成为该领域的研究重点。
贵金属沉积、掺杂改性、半导体复合、染料敏化等手段均可用于拓宽TiO2光响应范围、提高光催化效率。其中,掺杂改性是最重要的手段之一。它通过掺杂杂质在TiO2内部引入杂质能级或者改变价带或导带的位置来改变光生电子-空穴跃迁的途径,从而达到降低激发能量,拓宽TiO2光吸收范围和提高TiO2光催化活性的目的。
一般认为,过渡金属元素掺杂尽管可实现可见光响应,但掺入的过渡金属离子容易成为光生电子-空穴对的复合中心而降低TiO2的光催化效率。非金属掺杂则既可实现可见光响应,同时还具有良好的可见光催化性能而成为研究的热点[3]。其中氮元素由于其离子半径与氧离子半径比较接近,具有较小的电离能和较好的稳定性等成为非金属掺杂TiO2研究的焦点[4]。
本文就氮掺杂对TiO2能带结构的影响及氮掺杂二氧化钛(N-TiO2)的制备方法的研究现状进行了综述,对该研究中存在的问题进行了总结并就今后该领域的研究和发展方向提出了思考。
1 氮掺杂对TiO2能带结构的影响
早在1986年,Sato等[5]就成功地在TiO2表面引入NOx制备出具有可见光响应能力的TiO2。2001年,Asahi等[6]在Science上报道了当氮替代TiO2中少量晶格氧时,可窄化TiO2禁带宽度并在保证紫外光活性的同时提高其可见光活性。至此,N-TiO2才引起人们的重视并逐步成为该领域的研究热点[7]。氮掺杂主要通过对TiO2能带结构的影响来降低激发能,使其吸收边发生红移,实现可见光响应。但是,对于引起其可见光活性的机制仍存在争议。根据氮掺杂对TiO2能带结构影响的不同,目前主要认为主要有四种可见光响应机制:带隙杂化机制、杂质能级机制、氧空位机制以及杂质能级与氧空位协同作用机制。
(1)带隙杂化机制
掺杂氮在TiO2中可能以置换氮、间隙氮或置换氮与间隙氮共存的形式存在。Asahi等[6]采用密度泛函理论分别对置换氮(Ns)、间隙氮(Ni)以及置换氮与间隙氮共存(Ni+s)时的态密度进行了计算,发现氮处于Ni和Ni+s状态时,掺杂氮分别以NO和N2的形式存在,由于这不能与TiO2的带隙能级充分重叠,因而无法实现可见光响应;置换氮的p轨道可与O 2p轨道发生杂化,使TiO2价带顶上抬而窄化禁带宽度(如图1(b)所示),通过带隙杂化机制实现了可见光响应。Long[8]和黄佐财等[9]通过第一性原理对置换氮掺杂锐钛矿相TiO2(氮掺杂浓度2.08%,原子分数,下同)的电子结构进行计算,得到了与Asahi一样的结论。不过,一些研究结果从实验和理论上均证明了间隙氮掺杂也可以使 TiO2实现可见光响应[10,11]。

图1 未掺杂 TiO2(a)和 Asahi提出的 N-TiO2(b)的能带结构图[12]Fig.1 The band structures of un-doped TiO2(a)and N-TiO2(b)proposed by Asahi
(2)杂质能级机制
Irie等[13]通过高温煅烧法制备了氮掺杂二氧化钛粉体(TiO2-xNx,0<x<0.02),发现在紫外光(300~400nm)照射下TiO2-xNx的量子产率要高于在可见光照射下(400~530nm)的量子产率,这一现象并不能用杂化带隙减小理论来解释,因此,他们提出了杂质能级机制,即氮在TiO2价带顶的上方形成了一个独立的N 2p窄带。在紫外光的照射下,TiO2价带和N 2p窄带上的电子可以激发至导带,而在可见光的照射下,只有N 2p窄带上的电子可以激发至导带,所以,在紫外光照射下氮掺杂二氧化钛的量子产率要高于可见光下的量子产率。但是在氮掺杂浓度大于0.6%(TiO2-xNx,x>0.02)时,他们并不反对Asahi的观点。Irie基于氮掺杂二氧化钛光催化产物分析得出的杂质能级机制,存在一定的局限性,如不能区别反应产物是来自于光氧化还是光还原反应,而且不能判定该产物是由有机物与光生空穴直接发生反应还是由有机物与水光氧化过程中产生的活性基团发生反应。而Nakamura等[14]通过向高氯酸电解质中加入不同的还原剂(I-,Br-或SCN)测定氮掺杂二氧化钛在紫外光或可见光下的光生电流解决了这一问题。他们发现在紫外光照射下,加入还原剂后氮掺杂二氧化钛的光生电流均有所增大,表明这些还原剂均被氧化,而在可见光照射下只有添加I-还原剂时,光生电流才有所增大,这主要是由于在紫外光下,电子从TiO2的价带跃迁至导带,空穴来自于O的2p价带,而在可见光下,电子从TiO2的N 2p轨道构成中间能级跃迁至导带,空穴来自于中间能级,O的2p价带产生的空穴能量高于N 2p中间能级产生的空穴(图2所示),因此,氮掺杂二氧化钛在紫外光下的氧化能力高于可见光下。

图2 Nakamura提出的N-TiO2能带结构及可能的电子-空穴跃迁途径图[14]Fig.2 The band gap structure and the possible photoinduced electron-hole transition pathway proposed by Nakamura
Irie和Nakamura通过实验证明了氮的掺杂可在TiO2价带顶上方引入一个N2p杂质能级,而相关的第一性原理的计算也证明了杂质能级的存在[15]。Yang等[16]计算了具有不同氮掺杂浓度的置换型氮掺杂TiO2的电子结构,发现当氮掺杂浓度小于等于2.1%时,光响应机制为杂质能级机制;而当氮掺杂浓度大于等于4.2%时,则属于杂化带隙减小机制。张学军等[17]在置换氮掺杂浓度为2.08%时得到了与Lee[15]和Yang一样的结论,但是与Long和黄佐财等提出的在该条件下带隙变窄的机制相矛盾。这些差别可能是由于不同课题组在计算时所采用的计算参数存在差异而造成的。因此,对于具体情况不能单纯强调理论计算结果,应结合实验数据进一步分析计算结果的合理性以及进一步优化计算模型,以便二者能够更好地结合在一起。
除了置换氮掺杂的形式,氮还能以间隙氮的形式掺入TiO2晶格中。Valentin等[18]系统研究了置换氮或间隙氮形式氮掺杂对锐钛矿相TiO2能带结构的影响。当氮以置换的方式掺入TiO2晶格时,氮以N-的形式存在,未成对电子均分布在氮的2p轨道,N2p局域能级位于价带上方约0.14eV处,如图3(a)所示。而当N以间隙原子方式掺入TiO2晶格时,氮则与一个晶格氧形成N-O连接,此时系统能量达到最低。N-O连接的π键成键轨道很深,位于价带下方,而π*反键轨道则在位于价带顶上方约0.73eV处形成杂质能级,如图3(b)所示,该杂质能级的位置要高于置换氮形成的位于价带顶上方0.14 eV的杂质能级,因此间隙氮更容易成为空穴的捕获中心,从而降低TiO2在光催化过程中的直接氧化能力[18]。

图3 置换氮掺杂(a)与间隙氮掺杂(b)锐钛矿相TiO2的电子能带结构图[18]Fig.3 Electronic band structure for(a)substitutional and(b)interstitial N-doped anatase TiO2
(3)氧空位机制
人们发现,经等离子体或在还原气氛条件下处理后,TiO2的光吸收范围可拓宽至可见光区。例如,Nakamura等[19]将TiO2经等离子处理后,发现TiO2的吸收边从420nm红移至600nm,且在电子顺磁共振(EPR)谱中发现了电子被氧空位捕获的特征峰(g=2.004)。如图4所示,他们认为氧空位可在导带底下方(0.75~1.18eV)形成一个氧空位能级,这样电子就可以先迁移至这个能级,再跃迁至导带,从而降低电子激发所需要的能量,使TiO2的光吸收能力拓宽至可见光区。
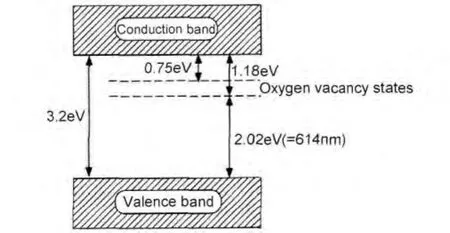
图4 氧空位型锐钛矿相TiO2能带结构图[19]Fig.4 The band gap structure of anatase TiO2with oxygen vacancy
之后,研究者们发现在氮掺杂过程中由于氮掺杂引起的电荷不平衡也容易产生氧空位[20]。如Valentin等通过理论计算表明氮掺杂可以有效地将氧空位的形成能从4.2eV减小到0.6eV,从而有利于氧空位的产生[18,21]。 Wang 等[22]采用局域密度近似法(LDA)计算了具有氧空位的氮掺杂锐钛矿相TiO2的能带结构,发现氮掺杂引起的氧空位可在导带底下方0.24eV处形成一个浅施主能级,使电子从该能级激发至TiO2的Ti3d能级,从而提高TiO2的光催化活性。Lin等[23]发现当氧空位浓度为1%,2%和4%(TiO2-xNx,x=0.031,0.062,0.125)时,氧空位则会在导带底下方0.15~0.30eV附近形成一个施主能级,使其实现可见光响应,而氧空位对光吸收的影响主要在500nm以上。相关实验表明,氧空位的存在的确提高了氮掺杂二氧化钛的可见光催化活性[24,25]。
(4)氧空位与杂质能级协同作用
从上述可见,氮掺杂引入的杂质能级和产生的氧空位缺陷均对提高TiO2的可见光响应能力具有重要的意义。但是以上分析都是根据杂质能级或氧空位单独作用时对TiO2能带结构的影响来讨论的,并没有考虑将杂质能级和氧空位两者共存时对TiO2能带结构的协同影响。Livraghi等[26]采用密度泛函理论研究了当掺氮原子(置换氮Ns·或间隙氮Ni·)和氧空位同时存在时TiO2的能带结构,如图5(a)所示。由该图可见,当掺氮原子与氧空位同时存在时,氧空位束缚电子可将Ti4+还原成Ti3+,从而在导带下方0.8eV处形成Ti3+能级,氮原子自由基Nb·(Ns·或Ni·)接受Ti3+能级上的电子生成反磁性的氮负离子N-b(N-s或N-i),同时Ti3+氧化成Ti4+。这样,在氧气气氛中及可见光照射下(437nm),N-b上的电子被激发跃迁至导带,电子被表面吸附氧(O2)捕获生成强氧化性O2·-,如图5(b)所示。因此,顺磁性的氮原子自由基Nb·是N-TiO2的光激活中心(photoactive center)。

图5 Nb·与氧空位相互作用时TiO2电子能带结构(a)和氧气气氛中N-TiO2在可见光照射下电子激发机制(b)[26]Fig.5 Electronic band structure of TiO2resulting from the interactions between Nb·and oxygen vacancy(a)and the possible mechanism for electron transition in N-TiO2under visible light irradiation in O2atmosphere(b)
以上的研究给出了氧空位和杂质能级协同作用对TiO2能带结构的影响,但并没有对氧空位与掺杂氮的具体作用过程进行分析。Zhang等[27]发现,单电子陷阱氧空位型(single-electron-trapped oxygen vacancy)TiO2和氧空位型N-TiO2均具有可见光响应能力,但是前者对CH3H6气体无降解,而氧空位型N-TiO2对CH3H6则表现出良好的光催化降解能力。他们认为,氧空位型N-TiO2的可见光光催化活性的产生是由氧空位缺陷(VO·)与N-TiO2表面吸附NO共同作用产生的。该观点也得到了Amadelli[28]的认同。Wang等[29]则对该可见光活性机制进行了详细的介绍,如图6所示。对于单电子陷阱氧空位型TiO2(图6(b)),在可见光照射下,电子从价带跃迁至氧空位形成的中间能级,然后再达到导带,随后电子很快又从导带经氧空位中间能级返回至价带,与价带的空穴复合,所以氧空位型TiO2只有可见光响应能力但是没有可见光催化活性。而当同时存在掺杂氮时,如图6(a)所示,当电子回迁至氧空位能级,掺杂氮可以与氧空位捕获的电子发生(图6(a))反应得到N-,N-进一步与O2反应生成O-2,从而阻碍光生电子与价带空穴复合,所以,氧空位型N-TiO2既具有可见光响应能力又具有可见催化光活性。
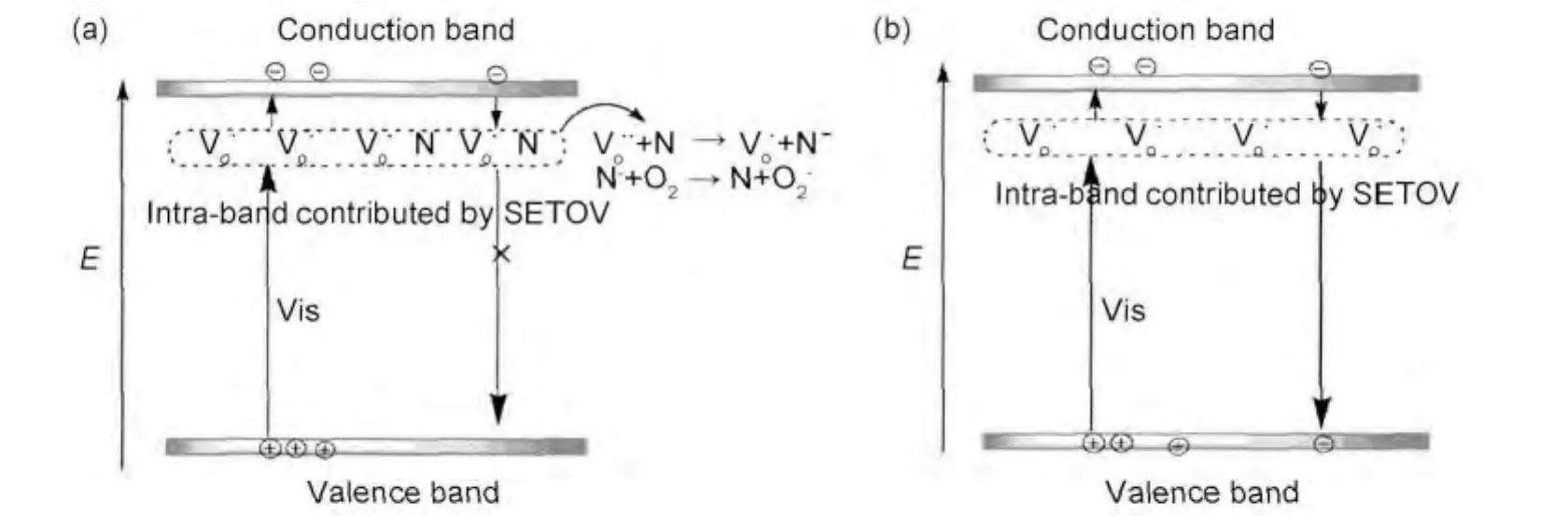
图6 具有氧空位的氮掺杂TiO2(a)与具有氧空位的未掺杂TiO2(b)的可见光活性机制 [29]Fig.6 Schematic diagram of the visible light active mechanism of N-TiO2with oxygen vacancy(a)and un-doped TiO2with oxygen vacancy(b)
2 氮掺杂TiO2的制备方法
由于Ti—O的结合能要高于Ti—N的结合能,因此,在合成过程中一般需要提供额外的能量才能实现氮掺杂。N-TiO2的光催化活性与晶型、粒径、形貌、比表面积、氮掺杂量、氮存在的化学形式和光吸收能力等因素有关,而这些因素与制备方法及合成条件有关。
按照应用形态,N-TiO2制备技术主要包括NTiO2薄膜和粉体制备两大类。
2.1 氮掺杂TiO2薄膜的制备
N-TiO2薄膜的制备常用的是磁控溅射法、脉冲激光沉积法、化学气相沉积法和溶胶凝胶法。
(1)磁控溅射法制备N-TiO2薄膜
磁控溅射法具有很高的镀膜速率,可以适用于不同的基材,可以在大面积的基底上获得均匀性和厚度可控的薄膜,薄膜致密性好且基底的结合力强,不易脱落。但是设备操作复杂,且需要真空系统、设备比较昂贵,使得合成成本较高。
Zhu等[30]采用磁控溅射法在Ar/N2混合气氛中制备了氮含量分别为0.70%,0.82%,0.89%的锐钛矿相 N-TiO2薄膜,禁带宽度从3.36eV 减小到3.12eV。
Sério等[31]采用直流磁控溅射法,通过改变N2在气氛中的含量制备了氮掺杂浓度在0.15%~0.70%,禁带宽度在3.28~3.17eV的N-TiO2薄膜。
(2)脉冲激光沉积法制备N-TiO2薄膜
脉冲激光沉积法可以通过调节基体温度、气体组成和压力、激光能量密度等沉积条件来制备薄膜。该方法可以在多种基体上沉积薄膜,薄膜不易开裂,但是无法制备大比表面积的薄膜。Suda等[32]采用脉冲激光沉积法在O2/N2的气氛中于Ti,TiO,TiO2和TiN基体上制备了薄膜,在可见光下(540~620nm,120mW·cm2),以 TiN为基体制备 TiO2-xNx薄膜对亚甲基蓝的降解能力要高于其他基体制备薄膜。Socol等[33]在玻璃基体上于N2及N2/O2气氛中制备了TiO2薄膜,吸收边从360nm分别红移至480nm和450nm,在可见光照射下可将Cr6+还原为Cr3+。
(3)化学气相沉积法制备N-TiO2薄膜
化学气相沉积法是在高温下使气相物质发生化学反应生成固态物质并在基体上形成薄膜的一种方法。化学气相沉积法可以比较准确地控制薄膜的组分和化学计量比,且大多反应可以在常压下进行,对真空设备的要求不高。制备的膜层致密且均匀,纯度高,但是膜的粒度不均一,平整性较差。Sarantopoulos等[34]以钛酸四异丙酯(TTIP)和氨气分别为钛源和氮源,发现当NH3/TTIP的偏压比为2200、温度为400℃、氮源浓度为0.8%时,在可见光下,N-TiO2对橙黄G的光降解效率是未掺杂TiO2的10倍。Dunnill等[35]以四氯化钛和叔丁胺为钛源和氮源制备了锐钛矿相NTiO2薄膜,该薄膜的禁带宽度从3.2eV减小至2.9eV,在可见光照射下,160h内可以将硬脂酸完全降解。
(4)溶胶凝胶法制备N-TiO2薄膜
溶胶凝胶法一般是先将钛源与氮源混合得到溶胶,将溶胶涂覆于玻璃、硅片、陶瓷等基底上,然后于高温下进行热处理得到结晶良好的N-TiO2薄膜。溶胶凝胶法制备的薄膜纯度较高,化学成分比较均一,比较容易实现掺杂,合成温度较低,对设备的要求简单,但是薄膜的厚度不易控制,且薄膜与基体的附着力差,在后续热处理中薄膜容易开裂。Soni等[36]以钛酸异丙酯和硫脲原料,制备了不同厚度的氮浓度在0.9%~8.3%的介孔N-TiO2薄膜,当氮含量为8.3%时,薄膜在可见光照射下10h内可以使亚甲基蓝完全褪色。Chekini等[37]以TiCl4和尿素为钛源和氮源,制备了锐钛矿相N-TiO2薄膜,发现氮掺杂抑制了锐钛矿相向金红石相转变,与未掺杂TiO2相比,在紫外光下表现出较好亲水性和光催化性能。
2.2 氮掺杂TiO2粉体的制备
氮掺杂TiO2粉体的制备常用的方法有高温煅烧法、水解沉淀法、溶胶凝胶法和水热法。
(1)高温煅烧法制备N-TiO2粉体
高温煅烧法一般通过在含氮气氛中煅烧未掺杂TiO2粉体或煅烧未掺杂TiO2粉体与含氮固相化合物的混合物来制备N-TiO2粉体。Wang等[38]将P25在NH3气氛于400~700℃煅烧制备了N-TiO2粉体,在光照强度为0.4mW/cm2的氙灯照射下,对丙烯气体的去除率最高可达7.3%(体积比)。Li等[39]将商售TiO2与盐酸胍混合煅烧,发现当盐酸胍用量为3M,于350℃煅烧2.5h时,N-TiO2粉体在可见光下4.5h内可以使亚甲基蓝完全褪色。该方法具有操作简便的特点,但是存在晶粒长大、颗粒团聚加剧的问题。
(2)水解沉淀法制备N-TiO2粉体
水解沉淀法一般是先将钛源与含氮化合物混合,通过水解沉淀制备无定形TiO2,然后在空气中或NH3气氛中进行高温热处理制备 N-TiO2粉体。Cheng等[40]先将氨水加入到钛酸四丁酯的乙醇溶液中得到无定形白色沉淀,然后将白色沉淀于350℃热处理4h制备N-TiO2粉体,在可见光照射下,N-TiO2在2h内对苯酚降解率可达65.3%,分别是未掺杂TiO2和P25的2.08和1.97倍。Baruwati等[41]将CH4N4O2加入TiCl4水溶液中,通过加入氨水将溶液的pH值调节为9,然后将生成产物于350~550℃煅烧2h得到了晶粒度为6~20nm的N-TiO2粉体。当热处理温度为350℃时,在可见光照射下,N-TiO2在3h和6h内可以分别将甲基橙和二氯苯酚完全降解。由以上水解沉淀法合成过程可以看出,氮源与钛源可在水解过程中均匀混合,在后续的热处理结晶及氮掺杂过程中,氮元素比较容易在TiO2内部实现均匀掺杂。
(3)溶胶凝胶法制备N-TiO2粉体
溶胶凝胶法制备N-TiO2粉体的基本流程主要包括以下步骤:首先要选择合适的钛源与氮源,然后将二者混合均匀,制备出含有氮、钛的溶胶,随后经过陈化等过程,再将溶胶经过干燥得到干凝胶,最后经热处理得到N-TiO2粉体。由于该方法能够实现钛源和氮源在分子水平上的充分混合,使得掺杂氮可以在TiO2内均匀分布。但是,溶胶的陈化时间一般都比较长,且大都采用有机含钛化合物为钛源,因而合成效率较低、成本较高,尤其是热处理过程容易导致团聚的发生和发生锐钛矿向金红石的相变。Yu等[42]将尿素加入到钛酸异丙酯的异丙醇溶液中先制备透明的溶胶,然后将溶胶于80℃干燥得到干凝胶,最后于400℃煅烧1h制备N-TiO2粉体。
(4)水热法制备 N-TiO2粉体
目前,水热法制备N-TiO2粉体主要有两种途径:
1)两步合成工艺。该工艺先将钛源或者结晶良好的TiO2与氮源混合水热,然后再经过后续热处理得到N-TiO2粉体。后续的热处理尽管可以实现掺杂和提高TiO2的结晶度,但高温热处理也普遍导致颗粒长大、比表面积减小、颗粒团聚等问题。Arienzo等[43]将TiO2粉体与尿素混合,于220℃在水热反应釜中反应4h,然后将得到的产物于350~600℃煅烧1h得到N-TiO2粉体。他们发现,于450℃热处理制备的NTiO2粉体对苯酚的降解率最高。Huang等[44]以钛酸四丁酯、三乙胺和尿素为原料,水热处理后于320℃煅烧6h得到锐钛矿与金红石混晶N-TiO2粉体,当锐钛矿和金红石比为4∶1时,N-TiO2粉体7h内对罗丹明B的矿化率可达41.4%。
2)一步水热合成工艺。一步水热合成工艺是将钛源与氮源混合,然后在温度小于300℃的温度下进行反应得到N-TiO2粉体。与两步水热合成工艺相比,一步水热合成工艺可实现氮掺杂与TiO2的结晶生长同时实现,不需要后续热处理晶化过程,能耗降低,且合成工艺简单,有利于实现工业化生产。Hu等[45]将两步水热合成工艺与一步水热合成工艺相比,发现两步水热合成工艺制备的N-TiO2粉体在紫外光下与可见光下对活性艳蓝(KN-R)的降解率均小于一步水热制备的N-TiO2粉体。Wu等[46]以钛酸丁酯为钛源,三乙胺为氮源,于120~180℃水热12h制备了NTiO2粉体,当水热合成温度为160℃时,N-TiO2粉体在可见光下对甲基橙的降解率最高。
传统的一步水热法合成工艺尚存在水热时间较长(12~72h),TiO2粉体产量较低的问题。本课题组以工业级硫酸氧钛和盐酸胍分别为钛源和氮源于2L的水热釜中于120~150℃反应2h制备了纳米N-TiO2粉体。所合成粉体的晶粒粒径分布在8.2~10.2nm,比表面积在151~220m2/g[47]。在对苯酚溶液的降解条件的系统研究中,当光照强度为15.54mW/cm2时,于150℃反应2h制备N-TiO2粉体对pH=4的苯酚溶液的降解率在10h内可达81%[48]。因此,该合成过程大大缩短了反应时间,提高了合成效率和粉体的产量。
3 结束语
自2001年以来,关于氮掺杂TiO2已开展了大量的理论和实验研究。结果表明,氮掺杂是拓展TiO2的光响应范围、实现可见光响应进而提高TiO2对太阳光利用率和可见光光催化效率的重要手段,具有重要的理论意义和广阔的应用前景。尽管关于氮掺杂TiO2的研究,无论在理论计算或实验研究方面均已取得了突出的进步,但在如下几个方面,依然需要进一步的工作。
(1)虽然多数研究者认同可以通过带隙杂化、杂质能级和氧空位三种机制实现氮掺杂TiO2的可见光响应,并得到了相关理论计算和实验验证。但是,到底哪种机制是实现TiO2可见光响应的主要因素仍不明确。此外,这几种机制与制备工艺之间的关系尚不清楚,因此难以通过对制备工艺技术的调控去制备出具有某种特定光响应机制的氮掺杂TiO2。
(2)虽然人们认为掺杂氮在TiO2中主要以置换氮、间隙氮和表面吸附氮三种状态存在,但目前尚缺乏直接实验证据去确定掺杂氮在TiO2晶格中的具体位置。此外,难以准确测定掺杂氮在TiO2中的浓度,进而通过实验确定掺氮浓度与光响应和光催化性能之间的关系。因此,仍需要进一步研究合适的表征手段确定氮在TiO2晶格中的具体位置和掺氮浓度,从而确定氮的存在形式和对光催化性能的贡献。
(3)氮掺杂实现和提高了TiO2的可见光催化活性,但还可通过过渡金属元素如Fe、Mo、Cr等与N进行共掺杂[49-51]、在 N-TiO2表面沉积贵金属Pt、Ag等方式进一步提高TiO2的可见光催化活性。
(4)缺乏纳米N-TiO2规模化制备技术。目前,国内外尚无商业纳米N-TiO2面市。因此,人们尚需要进一步加大纳米N-TiO2制备技术的投入,通过相关工艺、制备技术的研究,实现纳米氮掺杂的规模化制备。
[1]FUJISHIMA A,HONDA K.Electrochemical photolysis of water at a semiconductor electrode[J].Nature,1972,238(5358):37-38.
[2]FRANK S N,BARD A J.Heterogeneous photocatalytic oxidation of cyanide and sulfite in aqueous solutions at semiconductor powders[J].Journal of Chemical Physics,1977,81(15):1484-1488.
[3]ZHANG J L,WU Y M,XING M Y,et al.Development of modified N doped TiO2photocatalyst with metals,nonmetals and metal oxides[J].Energy & Enviromental Science,2010,(3):715-726.
[4]QIU X F,BURDA C.Chemically synthesized nitrogen-doped metal oxide nanoparticles[J].Chemical Physics,2007,339(1-3):1-10.
[5]SATO S.Photocatalytic activity of NOx-doped TiO2in the visible light region[J].Chemical Physics Letters,1986,123(1-2):126-128.
[6]ASAHI R,MORIKAWA T,OHWAKI T,et al.Visible-light photocatalysis in nitrogen-doped titanium oxides[J].Science,2001,293(5528):269-271.
[7]VARLEY J B,JANOTTI A,VAN De WALLE C G.Mechanism of visible-light photocatalysis in nitrogen-doped TiO2[J].Advanced Materials,2011,23(20):2343-2347.
[8]LONG R,ENGLISH N J.Synergistic effects on band gap narrowing in titania by co-doping from first-principles calculations[J].Chemistry of Materials,2012,22:1616-1623.
[9]黄佐财,冯晶,潘伟.氮掺杂锐钛矿TiO2的电子结构与光学性质的第一性原理计算[J].稀有金属材料与工程,2011,40:475-477.HUANG Z C,FENG J,PAN W.Electronic structure and optical properties of N-doped anatase TiO2by first principles calculations[J].Rare Metal Materials and Engineering,2011,40:475-477.
[10]XIANG Q J,YU J G,WANG W G,et al.Nitrogen self-doped nanosized TiO2sheets with exposed{001}facets for enhanced visible-light photocatalytic activity[J].Chemical Communications,2011,47:6906-6908.
[11]GAO H T,ZHOU J,DAI D M,et al.Photocatalytic activity and electronic structure analysis of N-doped anatase TiO2:a combined experimental theoretical study[J].Chemical Engineering Technology,2009,32:867-872.
[12]JOUNG S K,AMEMIY T,MURABAYASHI M,et al.Mechanistic studies of the photocatalytic oxidation of trichloroethylene with visible-light-driven N-doped TiO2photocatalysts [J].Chemistry,2006,12:5526-5534.
[13]IRIE H,WANTANABE Y,HASHIMOTO K.Nitrogen-concentration dependence on photocatalytic activity of TiO2-xNxpowders[J].Journal of Physical Chemistry B,2003,107(23):5483-5486.
[14]NAKAMURA R,TANAKA T,NAKATO Y.Mechanism for visible light responses in anodic photocurrents at N-doped TiO2film electrodes[J].Journal of Physical Chemistry B,2004,108(30):10617-10620.
[15]LEE J Y,PARK J,CHO J H.Electronic properties of N and C doped TiO2[J].Applied Physics Letters,2005,87(1):011904(3pages).
[16]YANG K S,DAI Y,HUANG B B.Study of the nitrogen concentration influence on N-doped TiO2anatase from first principles calculation[J].Journal of Physical Chemistry C,2007,111:12086-12090.
[17]张学军,张光富,金辉霞,等.N,Co共掺杂锐钛矿相TiO2光催化剂的第一性原理研究[J].物理学报,2013,62(1):017102.ZHANG X J,ZHANG G F,JIN H X,et al.First principles study on anatase TiO2photocatalyst codoped with nitrogen and cobalt[J].Acta Physico-Chimica Sinica,2013,62(1):017102.
[18]VALENTIN C D,PACCHIONI G,SELLONI A,et al.Characterization of paramagnetic species in N-Doped TiO2powders by EPR spectroscopy and DFT calculations[J].Journal of Physical Chemistry B,2005,109(23):11414-11419.
[19]NAKAMURA I,NEGISHI N,KUTSUNA S,et al.Role of oxygen vacancy in the plasma-treated TiO2photocatalyst with visible light activity for NO removal[J].Journal of Molecular Catalysis A:Chemical,2000,161(1-2):205-212.
[20]GRACIANI J,ALVAREZ L J,RODRIGUEZ J A,et al.N doping of rutile TiO2(101)surface a theoretical DFT study[J].Journal of Physical Chemistry C,2008,112:2624-2631.
[21]FINAZZI E,VALENTIN C D,SELLONI A.Frist principle study of nitrogen doping at the anatase TiO2(101)surface[J].Journal of Physical Chemistry C,2007,111:9275-9282.
[22]WANGA Y,DOREN D J.First-principles calculations on TiO2doped by N,Nd,and vacancy[J].Solid State Communications,2005,136(3):186-189.
[23]LIN Z,ORLOV A,LAMBERT R M,et al.New insights into the origin of visible light photocatalytic activity of nitrogen-doped and oxygen-deficient anatase TiO2[J].Journal of Physical Chemistry B,2005,109(44):20948-20952.
[24]IHARA T,MIYOSHI M,IRIYAMA Y,et al.Visible-light-active titanium oxide photocatalyst realized by an oxygen-deficient structure and by nitrogen doping[J].Applied Catalysis B:Environmental,2003,42(4):403-409.
[25]ZHANG Z Z,LONG J L,XIE X Q,et al.Controlling the synergistic effect of oxygen vacancies and N dopants to enhance photocatalytic activity of N-doped TiO2by H2reduction[J].Applied Catalysis A:General,2012,425-426:117-124.
[26]LIVRAGHI S,PAGANINI M C,GIAMELLO E,et al.Origin of photoactivity of nitrogen-doped titanium dioxide under visible light[J].Journal of the American Chemical Society,2006,128(49):15666-15671.
[27]ZHANG J W,WANG Y,JIN Z S,et al.Visible-light photocatalytic behavior of two different N-doped TiO2[J].Applied Surface Science,2008,254:4462-4466.
[28]AMADELLI R,SAMIOLO L,BORSA M,et al.N-TiO2Photocatalysts highly active under visible irradiation for NOxabatement and 2-propanol oxidation[J].Catalysis Today,2013,206:19-25.
[29]WANG Y,FENG C X,ZHANG M,et al.Visible light active N-doped TiO2prepared from different precursors:origin of the visible light absorption and photoactivity[J].Applied Catalysis B:Environmental,2011,104(3-4):268-274.
[30]ZHU L,XIE J,CUI X,et al.Photoelectrochemical and optical properties of N-doped TiO2thin films prepared by oxidation of sputtered TiNxfilms[J].Vacuum,2010,84(6):797-802.
[31]SERIO S,MELO JORGE M E,NUNES Y,et al.Incorporation of N in TiO2films grown by DC-reactive magnetron sputtering[J].Nuclear Instruments and Methods in Physics Research B,2012,273(15):109-112.
[32]SUDA Y,KAWASAKI H,UEDA T.Preparation of nitrogen doped titanium oxide thin films using a PLD method as parameters of target material and nitrogen ratio in nitrogen/oxygen gas mixture[J].Thin Solid Films,2005,476:337-341.
[33]SOCOL G,GNATYUK Y,STEFAN N,et al.Photocatalytic activity of pulsed laser deposited TiO2thin films in N2,O2and CH4[J].Thin Solid Films,2010,518(16):4648-4653.
[34]SARANTOPOULOS C,GLEIZES A N,MAURY F.Chemical vapor deposition and characterization of nitrogen doped TiO2thin films on glass substrates[J].Thin Solid Films,2009,518:1299-1303.
[35]DUNNILL C W,PARKIN I P.N-doped titania thin films prepared by atmospheric pressure CVD using t-butylamine as the nitrogen source:enhanced photocatalytic activity under visible light[J].Chemical Vapor Deposition,2009,15(7-9):171-174.
[36]SONI S S,HENDERSON M J,BARDEAU J F,et al.Visiblelight photocatalysis in titania-based mesoporous thin films[J].Advanced Materials,2008,20(8):1493-1498.
[37]CHEKINIA M,MOHAMMADIZADEH M R,VAEZ ALLAEI S M.Photocatalytic and superhydrophilicity properties of N-doped TiO2nanothin films[J].Applied Surface Science,2011,257(16):7179-7183.
[38]WANG Y,FENG C X,ZHANG M,et al.Enhanced visible light photocatalytic activity of N-doped TiO2in relation to singleelectron-trapped oxygen vacancy and doped-nitrogen[J].Applied Catalysis B:Environmental,2010,100(1-2):84-90.
[39]LI Y H,CAO W B,RAN F Y,et al.Photocatalytic degradation of methylene blue aqueous solution under visible light irradiation by using N-doped titanium dioxide[J].Key Engineering Materials,2007,336-338:1972-1975.
[40]CHENG X W,YU X J,XING Z P.Characterization and mechanism analysis of N doped TiO2with visible light response and its enhanced visible activity[J].Applied Surface Science,2012,258(7):3244-3248.
[41]BARUWATI B,VARMA R S.Synthesis of N-doped nano TiO2using guanidine nitrate:an excellent visible light photocatalyst[J].Journal of Nanoscience and Nanotechnology,2011,11(3):2036-2041.
[42]YU B Y,LAU W M,YANG J.Preparation and characterization of N-TiO2photocatalyst with high crystalline and enhanced photocatalytic inactivation of bacteria[J].Nanotechnology,2013,24(33):335705.
[43]D'ARIENZO M,SCOTTI R,WAHBA L,et al.Hydrothermal N-doped TiO2:explaining photocatalytic properties by electronic and magnetic identification of N active sites[J].Applied Catalysis B:Environmental,2009,93(1-2):149-155.
[44]HUANG D G ,LIAO S J,QUAN S Q,et al.responsive NTiO2mixed crystal by a modified hydrothermal process[J].Journal of Non-Crystalline Solids,2008,354(33):3965-3972.
[45]HU S Z,WANG A J,LI X,et al.Hydrothermal synthesis of well dispersed ultrafine N-doped TiO2nanoparticles with enhanced photocatalytic activity under visible light[J].Journal of Physics and Chemistry of Solids,2010,71(3):156-162.
[46]WU D Y,LONG M,CAI W M,et al.Low temperature hydrothermal synthesis of N-doped TiO2photocatalyst with high visible light activity[J].Journal of Alloy and Compounds,2010,502:289-294.
[47]XU J N,LIU Q,LIN S F,et al.One-step synthesis of nanocrystalline N-doped TiO2powders and their photocatalytic activity under visible light irradiation[J].Research on Chemical Intermediates,2013,39(4):1655-1664.
[48]XU J N,WANG F,LIU W X,et al.Nanocrystalline N-doped TiO2powders:mild hydrothermal synthesis and photocatalytic degradation of phenol under visible light irradiation[J].International Journal of Photoenergy,2013,Article ID 616139,7pages.
[49]LIU W X,LIU Q,LI X F,et al.Photocatalytic degradation of coking wastewater by nanocrystalline(Fe,N)co-doped TiO2powders[J].Science China Technological Sciences,2010,53:1477-1482.
[50]KHAN M,XU J N,CHEN N,et al.First principle calculations of the electronic and optical properties of pure and(Mo,N)codoped anatase TiO2[J].Journal of Alloys and Compounds,2012,513:539-545.
[51]KHAN M,CAO W B,CHEN N,et al.Ab-initio calculations of synergistic chromium nitrogen codoping effects on the electronic and optical properties of anatase TiO2[J].Vacuum,2013,92:32-38.

