碳助磨制备纳米镁铝储氢合金的结构及储氢性能研究
张同环,周仕学,牛海丽,肖成柱,王乃飞
(1山东科技大学 化学与环境工程学院,山东 青岛 266590;2日照钢铁控股集团有限公司,山东 日照 276806)
金属镁储氢密度高(理论储氢密度为7.6/%,质量分数,下同)、吸放氢过程可逆、平台滞后效应小,因而成为最具应用前景的储氢材料之一。然而,纯MgH2脱氢温度高、动力学缓慢,大大限制了它的应用。为了克服这些缺点,研究人员采用了纳米化、添加催化剂、与其他储氢材料进行复合等方法对镁进行改性。机械球磨法是使镁基储氢材料纳米化的主要方法之一,不但可以减小颗粒尺寸,而且可增加晶格缺陷,因而可改善材料的储氢性能 。本文作者在前期工作中发现,在镁粉中添加30%~40%改性后的无烟煤作为助磨剂,经2~3h球磨即可使镁颗粒粒度达到纳米级[3,4]。添加铝能显著降低储氢材料的放氢温度[5-7],铝与镁的配合方式有两种,一种是直接球磨镁、铝的单质[8,9],另一种先将镁铝制成合金,然后经机械球磨进行改性[10-12]。目前,多数研究集中于第一种方法,在长时间的球磨过程中形成镁铝合金,而对于第二种方法制备镁铝储氢材料的研究较少。
本工作以改性无烟煤作为助磨剂,在氢气气氛下球磨镁铝合金,研究了球磨吸氢材料及静态再吸氢材料的晶相及放氢动力学性能变化。
1 实验
原料:镁铝合金,含铝9%,镁91%,用磨削的方法制成碎屑,粒度5~10mm;微晶碳,粒度<0.074mm,由无烟煤经脱灰、1500℃碳化改性制得,具体参数见文献[4]。将镁铝合金、微晶碳按质量比70∶30装入不锈钢球磨罐中,反复充放氢气(纯度>99.9%,体积分数)以置换出罐内空气后,充氢至1.0MPa并球磨5.5h,期间每隔1h补充氢气至1.0MPa,以维持罐内氢气压强。球磨机为ND7-2L型行星式球磨机,主轴转速为240r/min,磨球与物料的质量比为40∶1。球磨后在氩气气氛的手套箱中将物料取出,放入样品袋中密封。
用S4800扫描电子显微镜(SEM)观察了储氢材料的微观形貌;用D/max-rB型X射线衍射仪(XRD)测定储氢材料的晶体结构,铜靶辐射,扫描速率10(°)/min,步长0.02°;用FineSorb-3010型程序升温脱附装置(TPD)测定了储氢材料的放氢温度,TCD检测器;用Sievert装置测试储氢材料的吸放氢动力学及P-C-T测试。
2 结果与讨论
2.1 氢气球磨后镁铝合金的SEM分析
图1为镁铝合金与微晶碳按照质量比70∶30混合,在1.0MPa氢气气氛下球磨5.5h之后SEM图片及其粒度分析。由图可见,球磨5.5h后材料粒度达到纳米级,但是粒度分布较宽,在40~130nm范围内,其平均粒径为74nm。镁铝合金的快速细化得益于微晶碳及高压氢气的助磨作用。肖学章等[7]在氩气气氛下球磨金属镁和铝的粉末,当球磨时间为70h时,粉体粒度最小仍>5μm,随着球磨时间延长至100h,粉体发生冷焊而使粒度增大。与之相比,本工作仅在5.5h内就可使镁颗粒度达到纳米级,不但大大缩短了球磨时间,能耗也显著降低。微晶碳在球磨中起到的作用主要包括两个方面:(1)研磨介质:微晶碳具有脆性,极易磨细,当碳颗粒小到一定粒度后,其硬度会大大提高,当镁合金与碳颗粒受到碰撞挤压时,碳颗粒就会嵌入镁合金颗粒中,使镁合金颗粒发生剥离;(2)分散剂:细化的碳颗粒黏附在镁铝合金颗粒表面,将合金颗粒分散开,阻碍了合金颗粒间发生碰撞而产生冷焊。此外,镁铝合金在高压氢气气氛中会发生氢脆现象,改变了合金本身的力学性能,使合金易发生脆性断裂[13]。
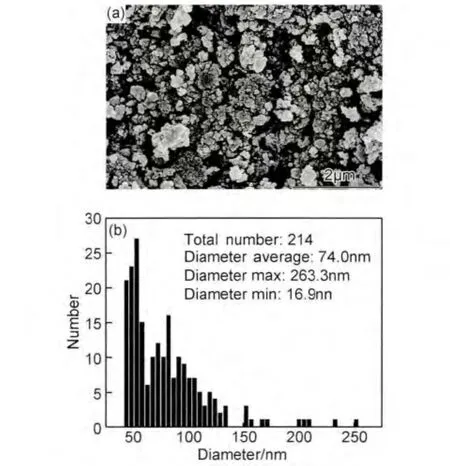
图1 氢气球磨镁铝合金的SEM图片(a)及其粒度分布(b)Fig.1 SEM image(a)and size distribution(b)of Mg-Al alloy after 5.5hof milling
2.2 球磨样品的相转变
图2给出了镁铝合金原料、氢气球磨5.5h以及在290℃、2MPa氢气下再吸氢的XRD谱图。与原料相比,球磨后材料的XRD衍射峰强度大大降低,衍射峰明显宽化,说明镁铝合金中的晶体遭到严重破坏。同时,材料中出现了新的物相:四方晶系的β-MgH2及少量斜方晶系的γ-MgH2。根据文献[14],通过气-固反应生成β-MgH2需要较高的温度和氢压(>327℃,>5MPa);而生成γ-MgH2则需要更高的温度和氢压(250~900℃,2.5~8GPa)。在本工作的球磨实验中,镁铝合金在室温和1MPa的氢压下能够生成β-MgH2和γ-MgH2归功于以下两点:(1)球磨使镁不断露出新鲜表面,表面能要比未进行球磨的镁粉高,使其更易吸附并解离氢气分子;(2)有效的碰撞瞬间产生较高的能量,为H原子进入镁晶格提供了所需的活化能。
与球磨储氢的材料相比,经过高温静态储氢后,材料中的镁氢化更完全(图2(c)),γ-MgH2不再出现,只存在β-MgH2,这说明γ-MgH2是一种高能态的氢化物,不能稳定存在,在静态储氢过程中很难产生[15];同时镁铝合金中的Mg17Al12相消失,出现了Al单质相。文献[16]研究了热处理对镁铝合金的影响,发现合金在420℃固溶保温20h后Mg17Al12几乎全部分解,Al原子以置换固溶的形式进入到Mg基体中,在本工作中,虽然球磨后的镁铝合金放氢及再吸氢的温度不超过320℃,热处理时间总共不足2h,但由于本工作所制备的镁铝合金粒度为纳米级,因此Mg17Al12分解时间大大缩短。
将图2中的XRD用Jade软件进行处理,利用谢乐公式:

k=0.89,λ=0.15406nm,计算球磨储氢及再吸氢的材料中β-MgH2的晶体粒度,数据如表1所示,计算时半高宽及衍射角度都需转化成弧度。结果表明,再吸氢后,MgH2平均晶体粒度由15.3nm增长到24.0nm,增长幅度近60%,这是由于在加热过程中MgH2中晶格缺陷减少所致。
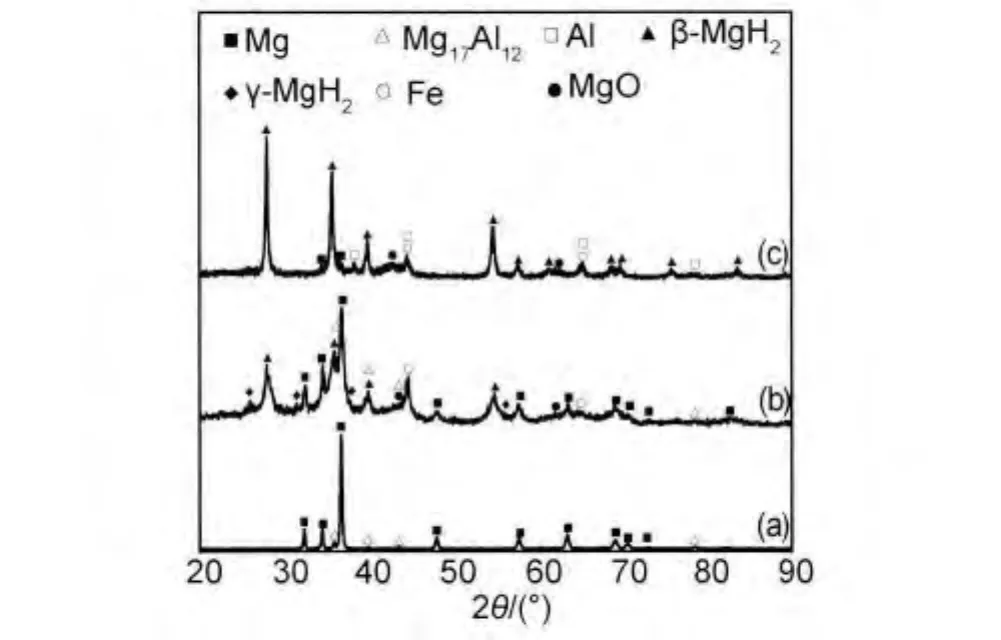
图2 镁铝合金的XRD谱图 (a)原料;(b)球磨后;(c)再吸氢后Fig.2 XRD patterns of Mg-Al alloy (a)raw material;(b)after milling;(c)after re-hydrogenation
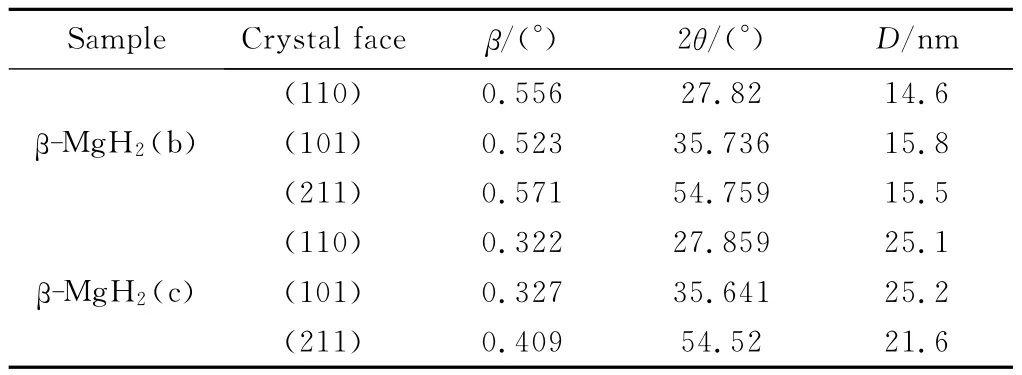
表1 MgH2晶体粒度计算Table 1 Calculation of MgH2crystal size
2.3 氢气球磨镁铝合金的放氢动力学
为了研究氢气球磨后镁铝合金的放氢动力学性能,采用TPD测试并计算了该材料的放氢动力学表观活化能。图3为球磨后的材料在不同升温速率下的TPD测试曲线。由图可见,球磨后材料的TPD只有一个放氢峰,初始放氢温度约为182℃,高峰放氢温度随升温速率的增大而升高,当升温速率为10℃/min时,放氢峰温为284.1℃,远远低于纯MgH2的初始放氢温度和高峰放氢温度,这应得益于MgH2纳米级的晶体粒度。根据Kissinger方程[17]:
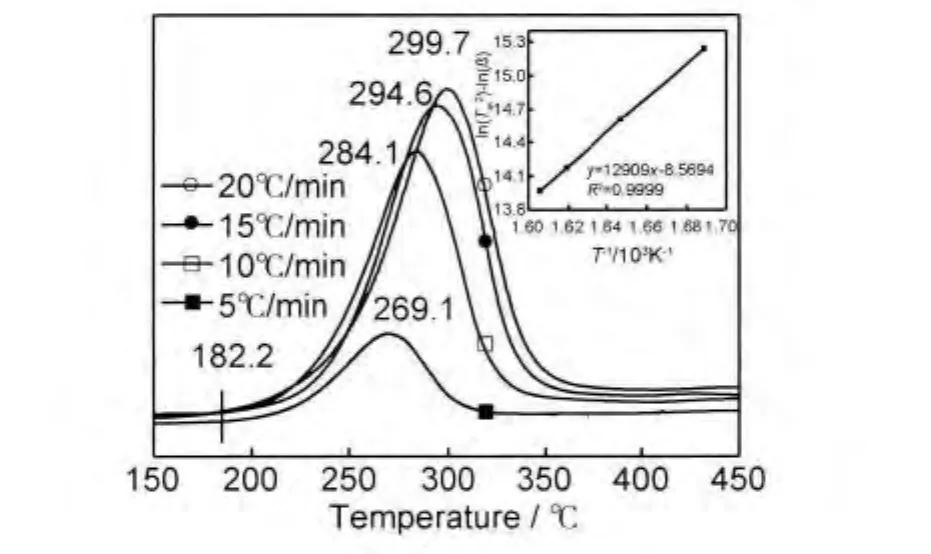
图3 氢气球磨镁铝合金的TPD测试曲线及Kissinger方程拟合曲线Fig.3 TPD and Kissinger equation fitting curves of the Mg-Al alloy as-milled at different heating rate
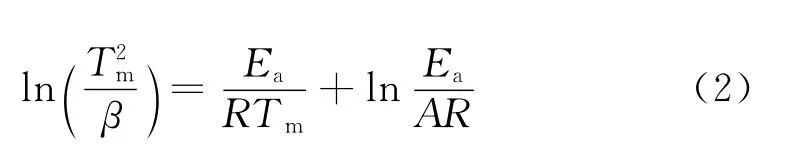
式中:β为升温速率,Tm为放氢高峰温度,Ea为表观放氢活化能,A为指前因子,R为气体常数。将图3中升温速率及对应的放氢峰温按照式(2)进行处理,绘制出线性曲线,如图4所示,该直线的线性方程为:
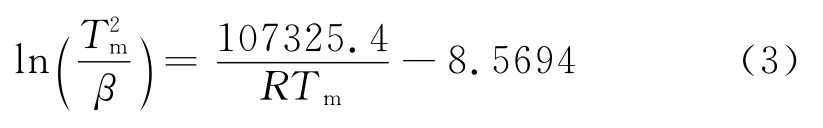
由此得出该材料放氢反应一级表观活化能为107.3 kJ/mol。然而,与纯镁 MgH2的表观放氢活化能(120kJ/mol)相比,该镁铝储氢合金放氢活化能降低了13kJ/mol。
图4为球磨后的材料在不同温度下的放氢曲线。由图可见,合金在一个近似呈直线快速放氢过程后进入平衡状态。随着温度升高,放氢所用的时间减少。球磨材料的储氢量约为3.03%,230℃时,约有60%的氢可以放出,当温度高于260℃时,几乎所有的氢都能放出,当放氢温度由260℃升至320℃时,放氢所需时间由20min缩短至7min。
根据拟一级放氢反应方程:
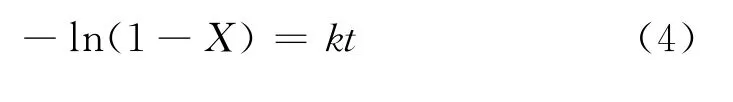

图4 氢气球磨镁铝合金在不同温度下的放氢曲线Fig.4 Desorption curves of the Mg-Al alloy as-milled at different temperatures
式中:X为 MgH2转化率,k为反应速率常数,t为反应时间。对图4中的放氢数据进行拟合,得出260~320℃范围内t与-ln(1-X)的线性曲线如图5(a)~(c)所示。其直线的斜率为该温度下的反应速率常数k。根据阿伦尼乌斯公式(Arrhenius equation):
绘制出k与1/T的线性曲线(图5(d)),线性关系式为:
由此可得由Arrhenius公式计算出氢气球磨材料的放氢表观一级活化能为102.9kJ/mol,与用Kissinger方程计算出的活化能107.3kJ/mol基本一致。
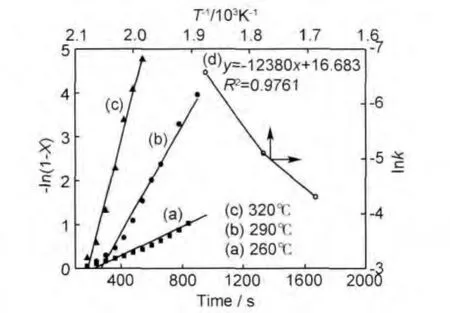
图5 放氢过程-ln(1-X)与t关系曲线(a)-(c)及Arrhenius公式拟合曲线(d)Fig.5 Curves of-ln(1-X)versus t (a)-(c)and lnk versus 1/Taccording to Arrhenius equation(d)
2.4 氢气球磨后的镁铝合金再次吸放氢动力学
图6为氢气球磨后的镁铝合金经290℃放氢后在不同温度、2MPaH2下再吸氢曲线。由图可见,该材料的饱和储氢密度约为4.60%,合金中约有87.62%的Mg进行了有效吸氢。材料在200℃和230℃的储氢密度分别为2.75%和3.78%;在260℃吸氢时,经过约25min可达到饱和吸氢;随着温度升高,达到饱和吸氢所需时间减小,到320℃吸氢时,经5min即可达到饱和吸氢,表现出优异的吸氢动力学性能。
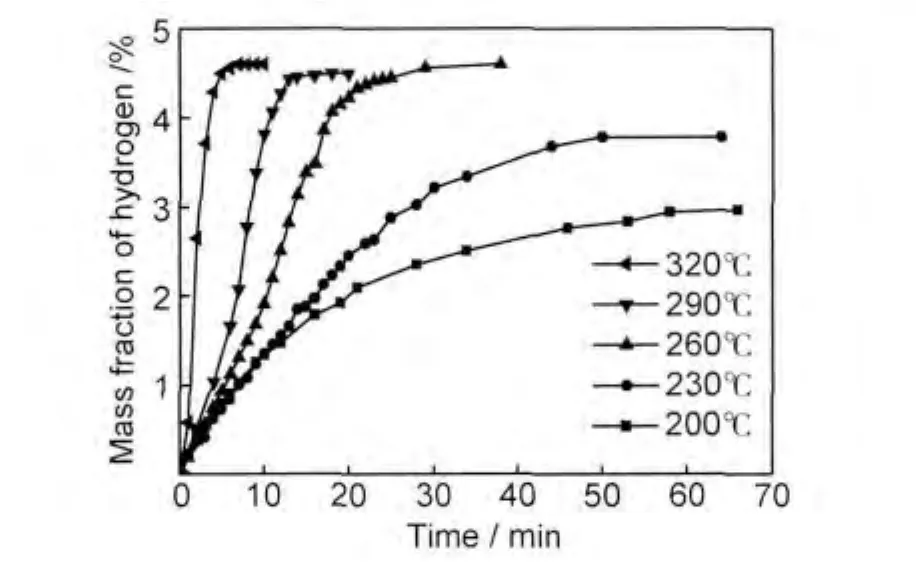
图6 球磨材料放氢后在2.0MPaH2下的吸氢曲线Fig.6 Hydriding curves of the as-milled material after dehydrogenation
图7为镁铝合金在290℃、2.0MPaH2下再吸氢后的TPD测试曲线。与球磨储氢的材料相比(图3),再吸氢后的材料由于MgH2晶粒长大,放氢初始温度和峰温都明显升高,其中初始放氢温度升高近23℃。用式(2)计算出再吸氢后材料的放氢表观活化能为67.1kJ/mol,比球磨储氢的材料降低40.2kJ/mol,比纯MgH2降低53kJ/mol,说明再吸氢后的材料再放氢时,材料中的氢原子突破镁晶格束缚所需的能量降低,结合图2分析认为是由于镁铝合金分解出单质Al起到催化作用的结果。MgH2的吸放氢性能同时受到其晶体粒度和催化剂的影响,晶体粒度增大使其放氢温度升高,动力学性能变差,而镁铝合金在加热时分解出的Al又起到催化MgH2放氢的作用,降低了其放氢活化能。比较以上结果可以得出,单质Al比合金态存在的Al催化作用更显著。
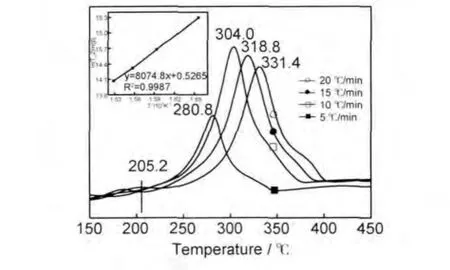
图7 材料再吸氢后TPD测试曲线及Kissinger方程拟合曲线Fig.7 TPD and Kissinger equation fitting curves of the re-hydrogenated material
从图3和图7中可以发现,不管是球磨吸氢材料还是静态吸氢材料,TPD曲线温度峰都比较宽,虽然图7中曲线峰附近变得稍微尖锐,但是曲线峰底部依然很宽。认为TPD曲线形状受材料颗粒粒度分布的影响,粒度分布宽时,TPD放氢峰宽散,反之,TPD放氢峰尖锐。
2.5 镁铝储氢合金的P-C-T测试
图8给出了球磨镁铝合金分别在260,290℃的吸放氢P-C-T曲线。由图可见,260℃时,储氢材料吸放氢平台压约为0.14MPa,当温度升高至290℃时,平台压升高至0.20MPa左右;温度升高时,吸氢平台压与放氢平台压之间的滞后效应减小,这与合金中存在晶格缺陷有关[18],晶格缺陷越多,滞后效应就越明显,当温度升高时,镁合金中由于球磨造成的晶格缺陷减少,因而滞后效应减小。
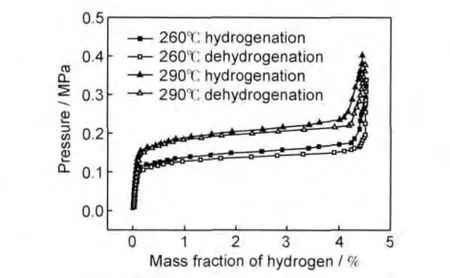
图8 镁铝合金材料的吸放氢P-C-T曲线Fig.8 Hydriding/dehydriding P-C-T curves of the Mg-Al alloy
3 结论
(1)微晶碳和高压氢气的存在有助于镁合金颗粒的细化。以70% 镁铝合金、30%微晶碳为原料,在1MPa H2下经5.5h球磨可以制得分散性良好的纳米级储氢材料,材料的平均粒径为74nm。球磨后,镁铝合金中的 Mg可转化成β-MgH2和少量的γ-MgH2,Mg17Al12未被破坏。
(2)镁铝合金储氢材料静态吸氢动力学性能较好,在290℃、2MPaH2下,10min内即可完成吸氢,且MgH2全部以β-MgH2态存在,储氢量可达4.60%。但合金中的Mg17Al12相加热时会分解为Mg和单质Al。
(3)球磨储氢材料具有较低的放氢温度(放氢峰温<300℃),而静态再吸氢材料由于MgH2晶粒长大而使放氢温度增高,但由Kissinger方程计算出的活化能来看,球磨吸氢材料和静态吸氢材料表观活化能分别为为 107.3kJ/mol和67.1kJ/mol,降低了40.2kJ/mol。表明铝对MgH2的放氢具有优异的催化作用,但是铝的添加方式对其催化作用影响很大,合金态的铝催化作用受到限制,单质态的铝催化作用更好。
[1]IMAMURA H,MASANARI K,KUSUHARA M,et al.High hydrogen storage capacity of nanosized magnesium synthesized by high energy ball-milling[J].Journal of Alloys and Compounds,2005,386(1-2):211-216.
[2]NARAYANAN D L,LUEKING A D.Mechanically milled coal and magnesium composites for hydrogen storage[J].Carbon,2007,45(4):805-820.
[3]胡秀颖,周仕学,王振华,等.球磨时间对镁碳复合储氢材料结构和性能的影响[J].功能材料,2008,39(3):424-429.HU X Y,ZHOU S X,WANG Z H,et al.Effect of ball milling time on the structure and properties of Mg-C composites for hydrogen storage[J].Journal of Functional Materials,2008,39(3):424-429.
[4]卢国俭,周仕学,马怀营,等.反应球磨法制备镁/碳纳米复合储氢材料[J].功能材料,2007,38(7):1128-1131.LU G J,ZHOU S X,MA H Y,et al.Preparation of magnesium/carbon nanocomposites for hydrogen storage by reaction milling[J].Journal of Functional Materials,2007,38(7):1128-1131.
[5]CRIVELLO J C,NOBUKI T,KUJI T.Improvement of Mg-Al alloys for hydrogen storage applications[J].International Journal of Hydrogen Energy,2009,34:1937-1943.
[6]JIANG J J,WEI J,LENG H Y.Effect of Al on the hydrogen storage properties of Mg(BH4)2[J].International Journal of Hydrogen Energy,ISSN:03603199;doi:10.1016/j.ijhydene.2013.01.093
[7]肖学章,陈立新,刘广成,等.球磨Mg17Al12纳米晶/非晶合金的微结构和储氢性能[J].西安交通大学学报,2007,41(11):1368-1372.XIAO X Z,CHEN L X,LIU G C,et al.Microstructures and hydrogen storage characteristics of nanocrystal/amorphous Mg17Al12alloy prepared by ball milling[J].Journal of Xi’an Jiaotong University,2007,41(11):1368-1372.
[8]HUANG L W,ELKEDIM O,NOWAK M,et al.Synergistic effects of multiwalled carbon nanotubes and Al on the electrochemical hydrogen storage properties of Mg2Ni-type alloy prepared by mechanical alloying[J].International Journal of Hydrogen Energy,2012,37(2):1538-1545.
[9]BOUOUDINA M,GUO Z X.Comparative study of mechanical alloying of(Mg+Al)and(Mg+Al+Ni)mixtures for hydrogen storage[J].Journal of Alloys and Compounds,2002,336(1-2):222-231.
[10]PALMA A S,ITURBE G,JOSE L,et al.MgAl alloy synthesis,characterization and its use in hydrogen storage[J].International Journal of Hydrogen Energy,2010,35(21):12120-12124.
[11]谢昭明,付安庆,陈玉安,等.Al的添加对Mg2Ni储氢合金结构和氢扩散能力的影响研究 [J].功能材料,2006,37(4):601-603.XIE Z M,FU A Q,CHEN Y A,et al.Effect of Al addition on microstructure and hydrogen diffusion capability of Mg2Ni alloy[J].Journal of Functional Materials,2006,37(4):601-603.
[12]王美涵,张连中,孙立贤,等.Mg1.75Al0.25Ni1-xCrx(0≤x≤0.2)合金的制备及其性能[J].高等学校化学学报,2005,26(10):1877- 1880.WANG M H,ZHANG L Z,SUN L X,et al.Preparation and properties of Mg1.75Al0.25Ni1-xCrx(0≤x≤0.2)alloys[J].Chemical Journal of Chinese Universities,2005,26(10):1877-1880.
[13]罗翔,郑坊平,王春涛,等.添加Ti0.9Zr0.1Mn1.5复合球磨对Ti9.6V86.4Fe4合金储氢性能的影响[J].西安交通大学学报,2007,41(12):1491-1494.LUO X,ZHENG F P,WANG C T,et al.Influence of composite ball milling with Ti0.9Zr0.1Mn1.5on hydrogen storage properties of Ti9.6V86.4Fe4alloy[J].Journal of Xi’an Jiaotong University,2007,41(12):1491-1494.
[14]BORTZ M,BERTHEVILLE B,BOTTGER G.Structure of the high pressure phaseλ-MgH2by neutron powder diffraction[J].Journal of Alloys and Compounds,1999,287:L4-L6.
[15]ZHOU S X,CHEN H P,DING C,et al.Effectiveness of crystallitic carbon from coal as milling aid and for hydrogen storage during milling with magnesium[J].Fuel,2012,109:68-75.
[16]许娟,李鹏飞,郭锋.热处理对 AZ91D镁合金相结构的影响[J].材料热处理学报,2011,32(4):30-33.XU J,LI P F,GUO F.Effect of heat treatment on microstructure of AZ91Dalloy [J].Transactions of Materials and Heat Treatment,2011,32(4):30-33.
[17]李武会,田保红,马坪,等.ScMn2合金贮氢(氘)性能[J].金属学报,2012,48(7):822-829.LI W H,TIAN B H,MA P,et al.Hydrogen storage properties of ScMn2alloy[J].Acta Metallurgica Sinica,2012,48(7):822-829.
[18]余学斌,陈金舟,吴铸,等.Cr含量对TiMn1.2-xCrxV0.25Fe0.05合金吸/放氢性能的影响[J].金属学报,2004,40(5):527-530.YU X B,CHEN J Z,WU Z,et al.Effect of Cr content on the sorption performance of TiMn1.2-xCrxV0.25Fe0.05alloys [J].Acta Metallurgica Sinica,2004,40(5):527-530.

