高龄糖尿病患者认知功能损害的危险因素
朱奕潼 苗 雅 李 蔚 何 婷 钟 远 (上海交通大学附属第六人民医院,上海 200233)
糖尿病(DM)主要危害是长期控制不良的高血糖引发的全身各系统严重的并发症,如心血管疾病、DM肾病、DM视网膜病及周围神经病变。近年研究发现,DM代谢异常除了可以损伤周围神经外,也可造成中枢神经系统的损害,从而导致认知功能下降,多表现为记忆和学习能力的减退〔1〕。另有研究显示阿尔茨海默病(AD)患者脑内存在胰岛素信号通路异常,Steen等〔2〕甚至提出“AD是3型糖尿病”的说法,认为脑内的胰岛素抵抗可能是AD发病的重要机制。另外,DM病程及DM诸多血糖参数中,何者与糖尿病患者认知功能下降的关系更加密切,目前尚无定论。本文拟筛选与老年DM患者认知功能下降有密切关系的DM相关参数,为高龄老年患者认知功能下降的预防和治疗提供更多参考。
1 资料与方法
1.1 研究对象 筛查研究对象来源于2010年4月至2013年6月我院老年科门诊和住院患者,年龄>70岁,性别不限,所有患者均签署知情同意书,能配合完成神经心理学量表测定及其他相关检查。2型糖尿病(T2DM)诊断依据1999年WHO DM诊断标准。DM组患者为符合T2DM诊断标准,或既往诊断为T2DM目前接受药物治疗者。未达到DM诊断标准者纳入对照组。排除有下列情况之一的患者:(1)有脑卒中病史,脑CT或MRI检查有明显脑血管病病灶,Hachinski缺血指数评分(HIS)≥4分;(2)合并引起痴呆的其他神经系统疾病,包括帕金森病、癫痫、脑外伤、肿瘤、感染、中毒等;(3)有抑郁症病史,汉密尔顿抑郁量表(HAMD)评分>7分;(4)合并美国精神病学会精神障碍诊断和统计手册(DSM-IV)诊断标准的其他精神疾病;(5)2年内有酒精、药物滥用或依赖史或筛选前2 w内使用过影响脑功能的药物;(6)合并其他内分泌疾病、显著的系统性疾病或不稳定医学情况或曾经出现低血糖、酮症昏迷史。
筛查并最终完成各种相关检查患者308例。其中DM组133例,平均年龄(82.08±4.20)岁,男 97 例,女 36 例;对照组175 例,平均年龄(81.87±4.29)岁,男123 例,女52 例。两组年龄、性别、受教育情况、高血压病史、高血脂病史、冠心病病史及吸烟史均无明显统计学差异,具有可比性。见表1。DM组患者的FBG、2 h-BG和HbA1c明显高于对照组(P<0.001)。
表1 两组患者一般情况比较(±s)
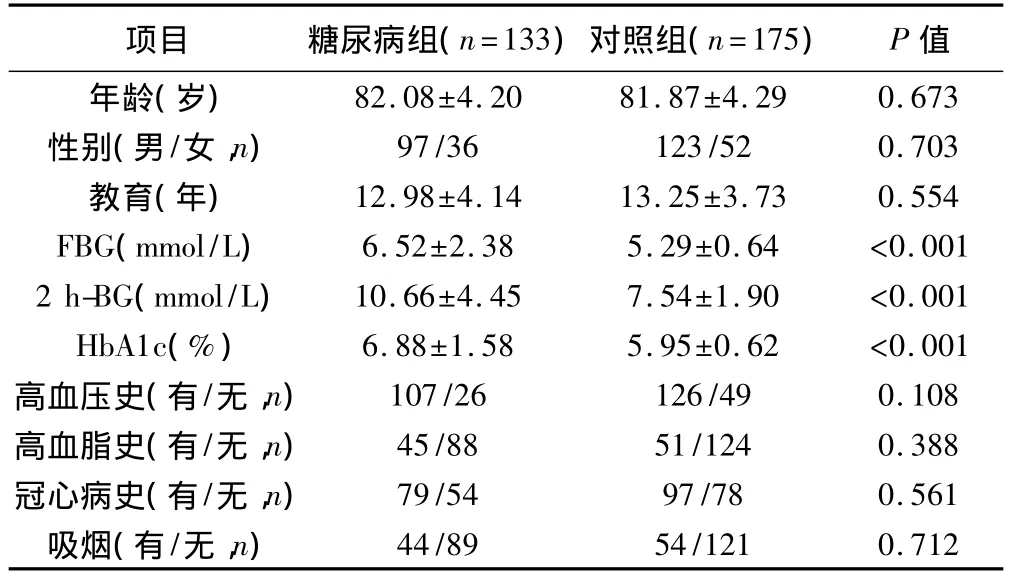
表1 两组患者一般情况比较(±s)
项目 糖尿病组(n=133)对照组(n=175) P值82.08±4.2081.87±4.290.673性别(男/女,n) 97/36123/520.703教育(年) 12.98±4.1413.25±3.730.554 FBG(mmol/L) 6.52±2.385.29±0.64 <0.0012 h-BG(mmol/L) 10.66±4.457.54±1.90 <0.001 HbA1c(%) 6.88±1.585.95±0.62 <0.001高血压史(有/无,n) 107/26126/490.108高血脂史(有/无,n) 45/8851/1240.388冠心病史(有/无,n) 79/5497/780.561吸烟(有/无,n)年龄(岁)44/8954/1210.712
1.2 生化指标测定 清晨空腹和早餐后2 h分别采肘静脉血2 ml,采用全自动生化仪测定空腹血糖(FBG)和餐后2 h血糖(2 h-BG),采用离子交换高压液相分离法测定糖化血红蛋白(HbA1c)。
1.3 认知功能评定 所有患者均进行相关神经心理学量表测定,并均由专人统一完成,包括简易智能状态量表检查(MMSE);蒙特利尔认知评估(北京版)量表(MOCA);临床痴呆量表(CDR)和总体衰退量表(GDS)。
对CDR和GDS,根据量表的评价分为不同的等级,依据CDR量表的评价得分分为5个等级,分别为1级CDR=0,2级CDR=0.5,3 级 CDR=1,4 级 CDR=2,5 级 CDR=3。根据 GDS量表的评价分为3个不同级别,分别为GDS=1或2的患者归为认知功能基本正常组,GDS=3,4或5者归为认知功能损害组,GDS=6或7者归为认知功能严重损害组。
1.4 统计学处理 用SPSS13.0软件,计量资料两样本均数比较采用非配对t检验,计数资料比较采用χ2检验,相关性采用逐步回归分析。
2 结果
2.1 两组患者认知功能量表评分比较 与对照组比较,DM组MMSE、评分明显降低〔(23.13±5.11)vs(25.31±3.61),P<0.001〕,MOCA 评分明显降低 〔(18.55±5.34)vs(20.16±4.92),P=0.006〕。两组CDR量表评价比较,DM组符合1级患者5例(3.8%),2级 79例(59.4%),3级28例(21.1%),4级14例(10.5%),5级7例(5.3%);同样标准,对照组1级患者17例(9.7%),2级 114例(65.1%),3级 39例(22.3%),4级4例(2.3%),5级1例(0.6%),两组之间具有显著差异(P=0.001)。两组之间GDS量表评价比较,DM组中认知功能基本正常患者42例(31.6%),认知功能损害者 89例(66.9%),严重认知功能损害2例(1.5%);对照组中认知功能基本正常65例(37.1%),认知功能损害者110例(62.9%),无严重认知功能损害者,DM组认知功能损害和严重损害者较对照组增多,但是两组之间未达统计学差异(P=0.174)。
2.2 逐步回归分析认知功能下降的危险因素 对DM组患者,以MMSE为因变量,以年龄、性别、受教育年限、DM病程、FBG、2 h-BG和HbA1c为自变量,进行逐步回归分析,最终进入方程的是年龄(β=-0.403,P<0.001)、DM 病程(β=-0.131,P=0.014)和 FBG(β=-0.150,P=0.005)。
3 讨论
DM患者由于血管并发症的有效干预,生存时间明显延长,大脑继而成为糖代谢异常作用的又一靶器官,认知损害及痴呆也成为DM患者新的晚期并发症。Xu等〔3〕对l 265人随访观察9年后发现DM患者发生认知损害和痴呆的风险增加,由轻度认知损害进展为痴呆的时间平均为1.83年,较无DM者提前了3.18年。Logroscino等〔4〕的研究也显示,老年T2DM 患者基线认知功能测试的得分低于非糖尿病患者,并且在随后2~6年的随访过程中发现其认知功能损害的危险性增加。但也有研究得出相反结果,Heitner等〔5〕应用组织荧光和免疫组织化学方法对DM和年龄相匹配的对照组患者的大脑进行尸检研究,未发现DM加重中枢神经系统损伤的有力证据。理论上DM患者合并高血压、高血脂、冠心病的可能性较对照组大,但是本研究DM组和对照组在高血压、高血脂、冠心病史中并无明显差异,对此矛盾的可能解释是本研究入组患者平均年龄在80岁左右,由于他们年龄较高,而与年龄密切相关的高血压、高血脂及冠心病的发病率更是明显增加。另外一种可能是本研究样本仍偏小,抽样误差导致研究结果与理论结果差异。
本研究证实T2DM老年患者总体认知功能较年龄相匹配的对照组老年患者明显降低。
Cosway等〔6〕研究发现,DM病程与修订韦氏记忆量表中的词语记忆、即刻及延迟记忆等明确相关。两项大规模多中心针对老年女性的研究发现,T2DM患者基线认知功能测试的得分低于非糖尿病者,随访发现其认知功能减退程度与DM病程呈正相关,随DM病程的延长发生认知功能障碍的危险性呈上升趋势〔4,7〕。美国檀香山亚裔老年人研究(HAAS)发现,DM 病程>20年的患者与病程≤5年者相比,脑血管损伤和脑萎缩的发生率明显增加〔8〕,说明DM病程长是认知功能障碍的危险因素。Mortimer等〔9〕发现中国老年人群FBG升高与认知功能损害密切相关。Mortby等〔10〕甚至发现正常高值的血糖水平同样可以促使大脑萎缩和认知能力下降,故有效控制血糖水平可能是预防认知功能减退的重要手段之一。本研究提示:DM病程和FBG水平是DM患者认知功能损害的重要危险因素。我们认为老年人血糖水平的良好控制与认知功能是相互依存的,认知功能差的老年患者自控能力差,血糖控制也较差;而较差的血糖控制可进一步加重认知的恶化,形成恶性循环。故对这类人群及其家属进行定期健康教育,打破恶性循环,积极控制血糖并改善认知显得尤其重要。
DM患者的认知功能障碍涉及的发病环节非常复杂,是目前研究的热点,尚有许多谜团未解,目前认为主要的可能机制有以下几点:(1)血流动力学改变:DM患者体内过高的糖基化终末产物可损伤脑血管内皮功能导致脑血流量减少,局部供血不足,致线粒体能量代谢障碍,引起神经元坏死或凋亡〔11〕。(2)胰岛素代谢紊乱:胰岛素是一种重要的神经营养因子(NGF),长期作用不足会出现神经元退行性变。而慢性的高胰岛素血症可以抑制β-淀粉样蛋白(Aβ)的降解,加重中枢Aβ的沉积〔12〕。(3)NGF作用,高血糖状态下血中低亲和力的NGF受体浓度增高,其可使NGF以最低限度转运而影响其作用的发挥,造成应激性蛋白激酶对神经丝的磷酸化异常,诱导神经细胞的凋亡〔13〕。(4)炎症反应:高血糖会启动氧化应激系统,导致血液循环中的细胞因子升高,如白介素(IL)-6和肿瘤坏死因子(TNF)-α,从而引起全身炎症反应导致大脑损伤〔14〕。除以上机制外,尚有学者认为非酶性蛋白糖基化、神经元钙稳态的异常也是DM加重认知功能受损的可能机制。
综上所述,T2DM对老年患者认知功能有明显的损害。应该重视DM代谢失常状态对老年患者认知功能的影响,从预防入手,将有效减少老年痴呆的患病率和延缓其病程。而严格控制血糖、应用胰岛素增敏剂增加中枢神经系统的胰岛素信号强度,可能在未来临床改善DM老年患者认知功能的治疗中起到重要作用。
1 Dominguez RO,Pagano MA,Marschoff ER,et al.Alzheimer disease and cognitive impairment associated with diabetes mellitus type 2:associations and a hypothesis〔J〕.Neurologia,2014;29(9):567-72.
2 Steen E,Terry BM,Rivera EJ,et al.Impaired insulin and insulin-like growth factor expression and signaling mechanisms in Alzheimer's disease-is this type 3 diabetes〔J〕?J Alzheimers Dis,2005;7(1):63-80.
3 Xu W,Caracciolo B,Wang HX,et al.Accelerated progression from mild cognitive impairment to dementia in people with diabetes〔J〕.Diabetes,2010;59(11):2928-35.
4 Logroscino G,Kang JH,Grodstein F.Prospective study of type 2 diabetes and cognitive decline in women aged 70-81 years〔J〕.BMJ,2004;328(7439):548.
5 Heitner J,Dickson D.Diabetics do not have increased Alzheimer-type pathology compared with age-matched control subjects.A retrospective postmortem immunocytochemical and histofluorescent study〔J〕.Neurology,1997;49(5):1306-11.
6 Cosway R,Strachan MW,Dougall A,et al.Cognitive function and information processing in type 2 diabetes〔J〕.Diabet Med,2001;18(10):803-10.
7 Gregg EW,Yaffe K,Cauley JA,et al.Is diabetes associated with cognitive impairment and cognitive decline among older women?Study of Osteoporotic Fractures Research Group〔J〕.Arch Intern Med,2000;160(2):174-80.
8 Korf ES,White LR,Scheltens P,et al.Brain aging in very old men with type 2 diabetes:the Honolulu-Asia Aging Study〔J〕.Diabetes Care,2006;29(10):2268-74.
9 Mortimer JA,Borenstein AR,Ding D,et al.High normal fasting blood glucose is associated with dementia in Chinese elderly〔J〕.Alzheimers Dement,2010;6(6):440-7.
10 Mortby ME,Janke AL,Anstey KJ,et al.High“normal”blood glucose is associated with decreased brain volume and cognitive performance in the 60s:the PATH through life study〔J〕.PLoS One,2013;8(9):e73697.
11 Maiese K,Chong ZZ,Shang YC.Mechanistic insights into diabetes mellitus and oxidative stress〔J〕.Curr Med Chem,2007;14(16):1729-38.
12 Medhi B,Chakrabarty M.Insulin resistance:an emerging link in Alzheimer's disease〔J〕.Neurol Sci,2013;34(10):1719-25.
13 Calza L,Giardino L,Giuliani A,et al.Nerve growth factor control of neuronal expression of angiogenetic and vasoactive factors〔J〕.Proc Natl Acad Sci U S A,2001;98(7):4160-5.
14 Esposito K,Nappo F,Marfella R,et al.Inflammatory cytokine concentrations are acutely increased by hyperglycemia in humans:role of oxidative stress〔J〕.Circulation,2002;106(16):2067-72.

