青蒿素的危机
李双文

2015年诺贝尔生理学或医学奖授予了中国科学家屠呦呦、爱尔兰科学家威廉·坎贝尔和日本科学家大村智。屠呦呦获奖的理由是发现和提取了青蒿素,坎贝尔和大村智获奖的理由是发明了治疗盘尾丝虫病和淋巴丝虫病的药物阿维菌和伊维菌素。尽管青蒿素被誉为治疗疟疾的“神药”,但是,青蒿素在疟疾治疗中也面临一些问题。
疟原虫的耐药性
人类对疟疾的抗争表现为道高一尺魔高一丈的拉锯战。无论何种药物,疟原虫在适应了一段时间后就会对药物产生耐药性,疟原虫对青蒿素和双氢青蒿素同样如此。因此,屠呦呦获得今年的诺贝尔生理学或医学奖只是对过去中国科研人员成绩的肯定,但同时也提出了一个问题,如何应对越来越严重的疟原虫的耐药性。
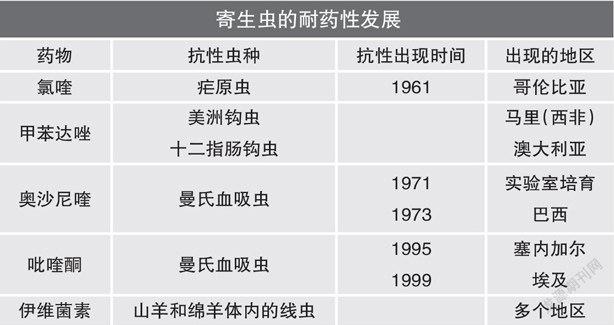
疟原虫对青蒿素产生耐药性的危机早就让世界卫生组织(WHO)和全球饱受疟疾之害地区的人们头痛。世界上疟疾耐药性最严重的地区当属湄公河三角洲。早在20世纪五六十年代疟原虫就已经两次对关键药物,如氯喹和乙胺嘧啶等产生了耐药性。疟原虫的耐药是因为其基因产生了突变,而且,从那时起,疟原虫的耐药基因已经向世界各地传播。同时,寄生虫的耐药又是一个全球性问题。
此后,中国科学家发明的青蒿素和双氢青蒿素的使用抑制了疟疾的耐药性。当然,疟原虫耐药也有使用方法问题,即单一使用某种药物会让寄生虫很快产生基因突变,从而产生耐药性。意识到这一点,世界卫生组织一再提醒各国卫生部门谨慎用药,并且推广疟疾治疗的联合用药(以青蒿素为基础的综合疗法,ACTs),但是,疟疾的耐药性还是不可避免地再次出现,而且是针对疟疾的特效药青蒿素。2003~2004年,首例青蒿素耐药(ACTs耐药)病例出现在泰国-柬埔寨边界。2009年,以青蒿素为基础的综合疗法对泰国、柬埔寨等国的一些疟疾已经明显失效。
因此,世界卫生组织不得不承认,过去10多年,治疗疟疾最有效的药物青蒿素已经在柬埔寨、缅甸、越南、老挝以及泰国边境地区越来越多的患者中失去作用。这个事实让人们无奈和惋惜,因为,青蒿素是几十年来对抗疟疾最有效的药物,也是中药中经过了现代实验医学,包括药理学、病理学、生物化学、分子生物学和基因学检验并得到国际认可和推崇的一种药物。
在21世纪初,世界卫生组织宁愿相信疟疾对以青蒿素为基础的综合疗法耐药的原因是伴侣药的问题,而非青蒿素的问题。但是,严酷的现实告诉人们,疟原虫对青蒿素的耐药既是药物的问题,又是疟原虫适应环境和药物自身的问题。
依赖于现代科学,如基因学,现在研究人员确认了青蒿素失效的主要原因是因为疟原虫的一个基因突变。这个发现是逐步确认的。2012年,发表在英国《自然》杂志的一篇研究文章提出,一种名为K13的基因突变蛋白与疟原虫耐受青蒿素有紧密关联性。2013年在美国《新英格兰医学杂志》上发表的另一篇文章则提示,东南亚的疟疾耐药性普遍存在K13基因突变。研究人员确认K13基因位点在疟原虫的第13个染色体上,其编码的K13蛋白形状与风车类似。
2015年初,美国哥伦比亚大学的大卫·费多克等人和位于泰国曼谷的玛希隆大学-牛津大学热带医学联合研究所的邓多普等人在美国《科学》杂志在线发表的两篇文章确认了K13基因是如何让疟原虫对青蒿素耐药的。
费多克等人利用锌指核酸酶技术来修复疟原虫的基因,如果对耐药性疟原虫的K13突变基因进行修复,则疟原虫不会耐药。在给耐药性疟原虫植入普通的K13基因后会让它们对青蒿素再次敏感,相反,把突变后的K13基因植入对药物敏感的疟原虫后又会让它们对青蒿素产生耐药性。
邓多普等人分析了来自东南亚和非洲的1000多名患者携带的疟原虫的所有信使RNA分子,结果发现,有K13基因突变的疟原虫会使参与蛋白折叠和修复的基因的功能增强,从而降低参与DNA复制的基因表达。这个机制会帮助疟原虫修复青蒿素对它们的杀伤。这个机理也体现在,疟原虫是通过放缓生长速度以减轻青蒿素对其进行伤害,于是,疟原虫的耐药就不可避免地产生了。
抗御疟疾的深层机理
现在,另一些研究人员通过对肠道菌的研究从分子角度解释了为何儿童比成人更容易患疟疾,因此也揭示了疟原虫耐药的另一种机理。
葡萄牙古尔班基安研究所的研究人员发现,人体内共生的肠道菌表面有一些糖分子,这些糖分子称为聚糖。人体免疫系统识别这些聚糖之后,能产生高水平的天然血液循环抗体,后者就是人体抗御疾病的卫士之一。于是,他们提出一个假说,针对肠道菌表面聚糖的天然抗体,也能够识别病原体表达的相似的糖分子,例如识别疟原虫表面类似的糖分子,从而攻击疟原虫,避免疟疾的产生。
这种假说的基础是,人体某些肠道菌表面的糖分子与疟原虫表面的糖分子相似,故而前者诱导机体产生的抗体可以通过相似性来攻击疟原虫。而且,由于成年人机体中诱导产生的抗体滴度足够大,所以比儿童更能有效地抗御疟疾。
假说需要实验来证实。古尔班基安研究所的伊尔马兹等人在研究中发现,人体肠道内一种最常见的大肠杆菌——大肠埃希氏菌能产生类似疟原虫的聚糖半乳糖残基,因此,这些大肠杆菌的半乳糖残基能诱导机体生成天然的抗体,称为抗半乳糖残基抗体。这些抗体产生后,会识别疟原虫产生的半乳糖残基,把疟原虫当成外来入侵物而发起攻击。攻击的过程是,抗半乳糖残基抗体激活免疫系统中的补体系统,从而呼唤免疫系统的其他成员来杀死疟原虫,由此阻止这种寄生虫从组织和皮肤进入血液而导致疟疾的产生。
这种机理显然能解释为何在热带和亚热带的疟疾高发地区,只有一部分成年人被蚊虫叮咬之后会感染疟疾,但5岁以下的儿童明显更容易受到感染。因为,成年人拥有更多的抗半乳糖残基抗体,能抵御疟原虫进入血液。婴幼儿体内还没有足够多的大肠杆菌,因此不能诱导机体生成高浓度的抗半乳糖残基抗体,以抗御疟疾的产生。

青蒿
进一步的研究证明了这一点。伊尔马兹等人把人工合成的半乳糖残基输入小鼠体内,让小鼠产生了高水平的抗半乳糖残基抗体,结果,这些抗体让小鼠的疟疾发病率大大减少,这说明正是抗半乳糖残基抗体的水平不高才使婴幼儿容易患疟疾。
自然赋予人类这种天然的抗御疟疾的原理给人以道法自然的启示。疟原虫固然能造成人患病,但是,人体自身的微生物也提供了一种天然的防御方法,即通过肠道菌产生与疟原虫相似的半乳糖残基,诱发机体产生抗体,以抗御疟疾。这种方法显然有治本的作用,因为,如果把人体内大肠杆菌产生的与疟原虫相似的半乳糖残基作为抗原来生产疫苗,就有可能不仅预防成人患疟疾,还能预防儿童患疟疾,真正实现预防优于治疗的目标。
同时,由于这是微生物之间的相生相克和模仿,很难刺激疟原虫的抗药(疫苗)性,因此,这可能是研发抗疟疾长效疫苗的一种途径。当然,目前这只是一种设想,但在疾病防治方面拥有道法自然的神韵,也因此不仅可能是攻克疟原虫抗药性的一条途径,而且也可能是预防和根除疟疾的一种希望。
如何化解疟原虫的耐药性?
人类要想赢得抗击疟原虫以及其他寄生虫战争的胜利需要采取更为新颖的方式,除了在用药手段上创新外,还需要有新的方法,如研发新的药物,或在青蒿素的基础上采用复方药物,以及用基因工程的方法来治疗疟疾。
基因工程主要是针对疟原虫的基因进行修饰,即改造疟原虫的基因,可用的手段已经比较明晰。例如,可以通过锌指核酸酶来修复疟原虫变异的K13基因。锌指核酸酶是将一个非特异性的核酸内切酶FokI(FokI是一种存在于细菌的限制酶)与含有锌指的结构进行融合,可对特定的基因序列进行切割和修复。被切开的DNA可以由切除的修复机制使切开处的单链部分被删除,然后又重新连接到一起。
通过锌指核酸酶为耐药性疟原虫植入普通的K13基因,可以让它们对青蒿素再次敏感。另一种方法是用CRISPR/Cas基因修饰系统(也称基因编辑器或基因剪刀),这种基因剪刀已经被研究人员尝试用来切割艾滋病病毒(HIV)感染者和患者体内细胞中的艾滋病病毒,从而根除潜伏的艾滋病病毒。
不过,这两种相似的方法都存在一个较大的难题,即如何对数以千万计的疟原虫和艾滋病病毒进行基因的切割和修复,因为,这个工程太庞大了。对艾滋病病人实施基因工程清除艾滋病病毒的工作量还小一些,但对人体内和蚊子体内的疟原虫实施基因工程的改造则是一个极为庞大的工程。
同时,疟原虫的基因突变也使其抗药性成为一种特质,因此要利用疟原虫的基因突变研发新的药物和疫苗可能计划没有变化快。不过,伊尔马兹等人的研究结果提供了一种攻克疟原虫抗药性的本元思路,即道法自然。如同自然界的各种生物相生相克一样,也有一些微生物是疟原虫的克星,如果能利用这一点来研发“以物治虫”或“以虫治虫”的药物和疫苗,将会事半功倍。
【责任编辑】张田勘
——青蒿素

