旋毛虫寄生致小鼠十二指肠组织细胞凋亡
李丹,罗靖梅,赵蕾,邴玉艳,杜娈英
(承德医学院,河北 承德 067000)
旋毛形线虫(Trichinella spiralis)简称旋毛虫,是一种重要的人兽共患寄生虫,具有极强的感染能力,能够引起几乎所有哺乳动物和人的旋毛虫病[1]。其生活史可分为成虫和幼虫两个阶段,成虫寄生于宿主的小肠内,是旋毛虫在宿主体内的早期阶段[2]。幼虫在小肠内脱囊并钻入肠黏膜发育为成虫的过程为侵入期,是旋毛虫生长发育过程中的关键阶段,拟通过采用体内实验检测旋毛虫感染小鼠模型十二指肠组织细胞凋亡情况,为旋毛虫的早期诊断和治疗提供一定的实验依据。
1 材料与方法
1.1 实验材料
旋毛虫株(河南株)由承德医学院病原生物学教研室小鼠传代保种。实验用昆明雄性健康成年小鼠,体质量20~25 g,购自承德医学院实验动物中心。重要试剂:TUNEL试剂盒,美国Roche公司;兔抗Caspase-3抗体,美国sigma公司。
1.2 实验分组
40只小鼠随机分为4组,即旋毛虫感染3、5、7 d组及正常对照组,每组10只。
1.3 动物模型的建立[3-4]
处死河南株保虫小鼠1只,全身骨骼、肌肉称质量,组织捣碎机充分搅拌,获得混悬液,调整混悬液中的幼虫密度至200条幼虫/0.2 mL,经灌胃方式感染小鼠,建立动物模型。
1.4 标本组织苏木素-伊红(HE)染色
分别取感染3、5、7 d组和正常对照组小鼠十二指肠,于10%的甲醛溶液内固定24 h,经脱水、二甲苯透明、石蜡包埋、切片、HE染色后于显微镜下观察组织病理改变。
1.5 原位末端标记(TUNEL)染色
按照美国Roche公司提供的试剂盒说明书,对十二指肠组织进行切片,60 ℃烤片后常规脱蜡、水化,蒸馏水、PBS水洗2次每次5 min,加入TUNE反应液进行反应后滴加50~100 μL DAB显色液显色3~10 min,后经苏木素复染、中性树胶封片一系列步骤进行TUNEL染色。感染3、5、7 d的实验组和对照组分别选取5个不同组织块的切片各1张,光学显微镜下观察,细胞核染成深棕色为阳性细胞,细胞核染成深蓝色为阴性细胞。定量分析方法为计算凋亡指数,凋亡指数=一定范围内的凋亡细胞数/一定范围内的细胞总数×100%。
1.6 Western-blot法分析Caspase-3变化
分别取正常对照组和感染3、5、7 d小鼠十二指肠组织,经组织蛋白提取、BCA蛋白浓度测定、蛋白处理、电泳、转膜、兔抗Caspase-3多克隆抗体1∶200倍稀释,4 ℃下孵育过夜、辣根过氧化物酶标记的二抗孵育以1∶5000倍稀释,摇床摇1 h,经TBST洗3次后显影、定影,最后采用Quantity One软件对显影条带进行分析。
1.7 统计分析
2 结果
2.1 HE染色结果
正常对照组小鼠十二指肠组织未见任何病理变化;感染3 d组十二指肠黏膜层上皮细胞水肿不明显,黏膜层稍见出血;感染5 d组十二指肠黏膜层上皮细胞可见轻微水肿,黏膜层肠腺可见明显出血,炎细胞较少,固有膜明显空泡状改变;感染7 d组十二指肠黏膜层大量炎性细胞浸润并伴有大量出血,局部黏膜上皮细胞水肿,固有膜空泡状改变更加明显,肠绒毛缺损。见图1。

图1 不同感染时间小鼠十二指肠组织HE染色结果(×200)
2.2 TUNEL法检测结果
正常对照组十二指肠黏膜层可见零星散在的细胞核呈深棕色或棕黄色的凋亡细胞。旋毛虫感染3 d、5 d、7 d组十二指肠黏膜层可见明显凋亡细胞。见图2。且随着感染时间的延长,细胞凋亡指数亦明显增多,组与组之间两两比较差异有统计学意义(P<0.05)。见表1。
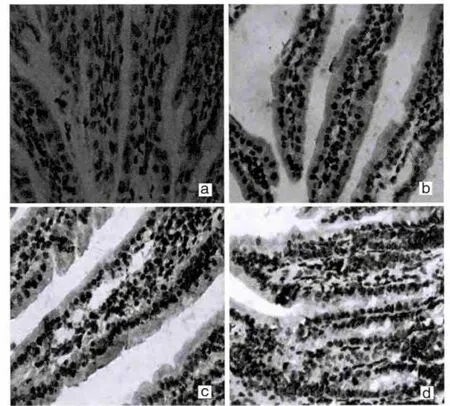
图2 不同感染时间小鼠十二指肠组织TUNEL染色结果(×200)
表1 不同感染时间的十二指肠组织细胞凋亡指数()
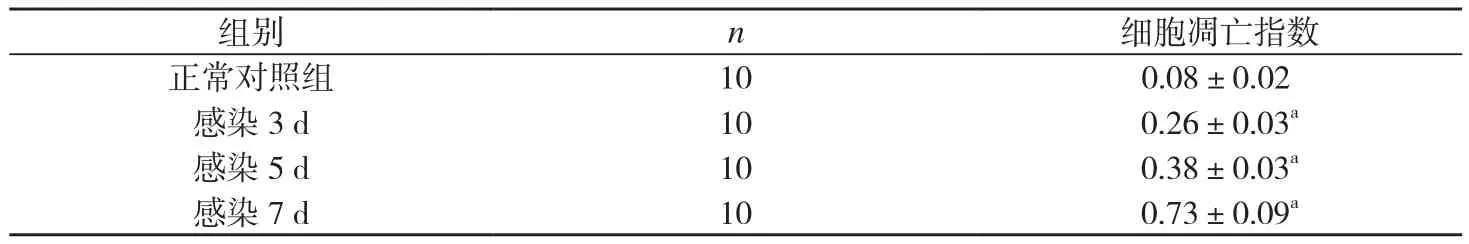
表1 不同感染时间的十二指肠组织细胞凋亡指数()
F=29.208,P=0.001。与正常对照组比较,aP<0.05;感染3、5、7 d 组间两两比较,P<0.05。
组别 n 细胞凋亡指数正常对照组 10 0.08±0.02感染 3 d 10 0.26±0.03a感染 5 d 10 0.38±0.03a感染 7 d 10 0.73±0.09a
2.3 Western-blot法检测结果
Western-blot结果分析Caspase-3变化结果显示,随着旋毛虫感染时间的延长,小鼠十二指肠组织Caspase-3蛋白的表达量随之增多,与正常对照组比较P<0.05,3、5、7 d组间两两比较均差异有统计学意义(P<0.05)。见图3。
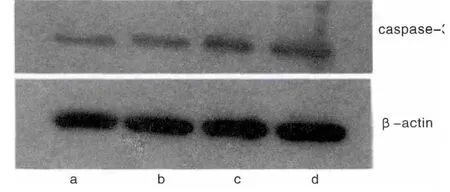
图3 不同感染时间Caspase-3变化结果
表2 旋毛虫小鼠十二指肠组织Caspase-3蛋白的表达()
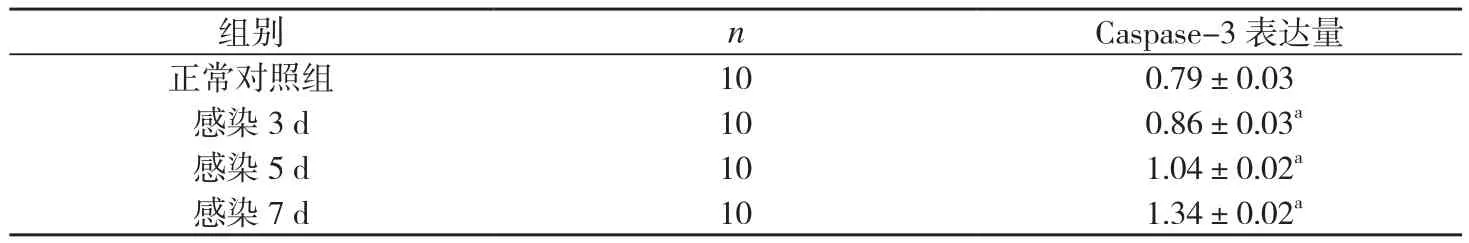
表2 旋毛虫小鼠十二指肠组织Caspase-3蛋白的表达()
F=32.012,P=0.001。与正常对照组比较,aP<0.05;感染3、5、7 d 组间两两比较,P<0.05。
组别 n Caspase-3 表达量正常对照组 10 0.79±0.03感染 3 d 10 0.86±0.03a感染 5 d 10 1.04±0.02a感染 7 d 10 1.34±0.02a
3 讨论
旋毛虫病是呈世界性分布的食源性人兽共患寄生虫病,目前在66个国家或地区有旋毛虫病分布[5]。近年来其流行范围进一步扩大,发病率有逐渐增高的趋势[6-7]。旋毛虫成虫寄生于宿主的消化道内,是旋毛虫在宿主体内的早期阶段,主要寄生在宿主的十二指肠和空肠上段,引起十二指肠和空肠局部充血、水肿。过去的研究主要局限于旋毛虫对宿主的机械性损伤。近年,寄生虫与宿主相互作用中发现的细胞凋亡现象,日益受到重视,但目前主要集中在蠕虫与少量原虫上[8-9],关于细胞凋亡在旋毛虫和宿主相互作用中研究较少。本实验拟通过病理学和分子生物学实验手段检测旋毛虫感染小鼠不同时间宿主十二指肠组织的细胞凋亡情况,探讨旋毛虫感染状态下宿主被寄生部位组织细胞凋亡的发生机理,以选择性地促进或抑制细胞凋亡的发生,为预防、治疗、杀灭旋毛虫提供实验基础。
细胞凋亡是指机体为维持体内内环境的稳定,由基因控制的、主动的、高度有序的及一些系列酶参与的过程。本实验采用HE染色、Western-blot技术、TUNEL法证实了旋毛虫发育过程中可诱导小鼠十二指肠组织发生细胞凋亡。通过HE染色证实实验动物模型建立成功,为后续实验提供可靠基础。利用Western-blot法对感染小鼠十二指肠组织进行研究,结果显示感染3、5、7 d组小鼠十二指肠组织Caspase-3表达量明显高于正常组,随着旋毛虫感染时间延长,Caspase-3表达量增加。采用TUNEL法对小鼠十二指肠组织进行染色,结果显示旋毛虫感染3、5、7 d组十二指肠黏膜层可见明显凋亡细胞,且随着感染时间延长,凋亡细胞数不断增加,与本实验做出的Western-blot结果一致。
宿主细胞凋亡与寄生虫的作用时间存在相互依赖的关系已被研究者证实,刘文杰等[10]发现,在血吸虫感染过程中,CD4+和CD8+细胞的促进凋亡基因的表达随着感染时间的延长而增高。李继红[11]研究表明,旋毛虫幼虫在发育过程中的细胞凋亡呈时间依赖性,并以生长旺盛阶段最为明显,与本实验结果一致。
实验证实旋毛虫成虫在宿主转换过程中,可以起感染期作用,引起宿主的旋毛虫感染,但可能大部分人认为旋毛虫成虫的生存周期短而且人们食入成虫的机会不多,但动物的肠肚煮沸不足或生拌凉肚给成虫感染提供了机会。另外动物间的相互蚕食,使之可能以肠道成虫的形式受到感染,在人类大量捕杀饕餮野生动物的今天,无疑给人类的健康构成了严重的威胁。早期诊断和治疗对旋毛虫患者至关重要,因此,了解旋毛虫成虫期的发病机制与生物学特征对旋毛虫病的预防和治疗有很大的意义。本实验通过体内实验,证实了旋毛虫感染可诱导其寄生部位组织发生细胞凋亡,为旋毛虫的发病机制和治疗提供了实验基础。
[1]左绍志,张桐嘉,常乐. 旋毛虫与肝癌细胞相关基因 CK-1 的原核表达及鉴定[J]. 中国生物制品学杂志,2014,27(4): 476-479.
[2]马明旺,申丽洁,董明治. 旋毛虫成虫表面抗原的 SDS-PAGE 和 Western-blot 分析[J]. 中国病原生物学杂志,2010,5(5):345-346.
[3]赵雪,申丽洁. 不同时龄旋毛虫新生幼虫的体外培养和收集方法研究[J]. 中国病原生物学杂志,2008,3(9): 697-698.
[4]杨维平,吴中兴. 人体寄生虫病化学药物防治[M]. 南京: 东南大学出版社,2004: 416-417.
[5]POZIO E. World distribution of Trichinella spp. infections in animals and humans[J]. Vet Parasitol,2007,149(1/2): 3-21.
[6]李招灵,崔晶,王中全. 旋毛虫西藏地理株生物学特性的研究[J]. 河南医学研究,2012,21(3): 260-263.
[7]温艳,张月清. 聚合酶链反应技术检测旋毛虫 DNA 的实验研究[J]. 中国人兽共患病杂志,2001,17(1): 61-62.
[8]JAMES E R,GREEN D R. Manipulation of apoptosis in the hostparasite interaction[J]. Trends Parasitol,2004,20(6): 280-287.
[9]SINAI A P,PAYNE T M,CARMEN J C,et al. Mechanisms underlying the manipulation of host apoptotic pathways by Toxoplasma gondii[J]. Int J Parasitol,2004,34(3): 381-391.
[10]刘永杰,李庆章,郝艳红. 猪囊尾蚴感染仔猪淋巴细胞凋亡率的变化[J]. 中国寄生虫学与寄生虫病杂志,2002,20(6): 341.
[11]李继红. 旋毛虫幼虫发育过程中的细胞凋亡及坏死[J]. 中国寄生虫学与寄生虫病杂志,2005,23(1): 63.

