丁苯酞预处理对缺血再灌注大脑神经元及血脑屏障的影响
严鹏,赵淑敏
(承德医学院基础医学院,河北 承德 067000)
大脑神经元和血脑屏障(blood brain barrier, BBB)在缺血再灌注损伤后会发生结构和功能改变,是缺血后病理生理变化的重要环节[1]。随着对缺血再灌注损伤机制的深入研究,应用预处理方法防治缺血性脑卒中倍受关注,并成为近年来的研究热点。丁苯酞(NBP)可通过调节脑缺血状态下脑能量代谢、增加缺血区脑血流量、减少神经细胞凋亡、改善脑缺血后神经功能缺损症状等[2-4],在临床治疗方面取得了明显的疗效。但提前给药以减轻随后发生的缺血再灌注时组织损伤的作用机制和预防剂量尚不明确。实验拟采用丁苯酞预处理大鼠,观察脑缺血再灌注脑组织中神经元及BBB的超微结构变化,为将丁苯酞应用于临床预防缺血性脑卒中提供实验依据。
1 材料与方法
1.1 材料
1.1.1 主要药品
丁苯酞软胶囊(NBP,批号118120711),石药集团恩必普药业有限公司;伊文思蓝(EB),TCI公司;OsO4,美国Sigma公司。
1.1.2 主要仪器设备
Multiskan3 型酶标仪(Finland); H-7650 透射电镜(Hitachi,Japan)。
1.1.3 实验动物分组与处理
清洁级SD雄性大鼠30只,体质量260~280 g,购于北京维通利华实验动物技术有限公司(许可证号:SCXK(京)2012-0001) 。适应性饲养1周,随机分为5组,假手术组、缺血再灌注组、NBP 20 mg/kg组、NBP 40 mg/kg组、NBP80 mg/kg组,每组6只。NBP各组于术前1周分别灌胃给予NBP 20 mg/(kg·d)、40 mg/(kg·d)、80 mg/(kg·d)预处理,连用7 d;假手术组和缺血再灌注组给等容积生理盐水。
1.2 方法
1.2.1 缺血再灌注模型制备
10%水合氯醛(350 mg/kg)腹腔内注射麻醉,缺血再灌注组和NBP各剂量组参照Longa[5]改良线栓法,制作大鼠局灶性大脑中动脉缺血再灌注模型(MCAO),缺血2 h再灌注24 h。假手术组不插入栓线。大鼠麻醉清醒后,参照Longa 5分制评分标准进行神经行为学评分。0分,正常,无神经功能损伤症状;1分,不能完全伸展对侧前爪,轻度神经功能缺损;2分,行走时,大鼠向左侧(瘫痪侧) 转圈,中度神经功能缺损;3分,行走时,大鼠身体向左侧(瘫痪侧) 倾倒,重度神经功能缺损;4分,不能自发行走,意识丧失。评分越高,说明神经损伤障碍越严重。实验过程中死亡者剔除并补足。
1.2.2 BBB通透性测定
再灌注23 h后,经鼠尾静脉注入2% EB(4 mL/kg),大鼠球结膜、皮肤变蓝示注入成功。循环1 h后,经心灌注预冷(4 ℃)生理盐水,当右心房流出清亮液体时,迅速断头取脑。取缺血侧脑组织,称湿质量。浸泡于5 mL甲酰胺溶液中,恒温培养箱(54 ℃)孵育24 h,离心5 min,1000 r/min,吸取上清液200 μL用酶标仪测定其630 nm处的OD值。甲酰胺溶液做空白比色。脑组织EB含量计算公式:脑组织EB含量(μg/g)=待测样品EB含量(μg/mL)×甲酰胺容量(mL)/脑湿质量(g),待测样品EB含量根据标准曲线求得。
1.2.3 电镜样品制作
大鼠麻醉后,经心脏灌注2%戊二醛和4%多聚甲醛混合液固定。取缺血侧大脑皮质,常规电镜样品包埋,半薄切片选区,超薄切片,铀、铅双重染色,H-7650透射电镜观察并采集图片。
1.2.4 统计学处理
2 结果
2.1 神经功能缺损评分
假手术组大鼠神经功能评分为0;缺血再灌注组大鼠神经功能缺损评分明显增高;与缺血再灌注组相比较,NBP各组评分显著降低(P<0.05), NBP 40 mg/kg组与NBP 80 mg/kg组差异无统计学意义(P>0.05),见表1。
2.2 各组EB含量测定
与假手术组相比较,缺血再灌注组脑组织EB含量显著增高,说明BBB通透性增高,完整性破坏。NBP各剂量组较缺血再灌注组EB含量明显降低(P<0.01,P<0.05),NBP 20 mg/kg组即可减轻脑缺血再灌注诱导的BBB破坏;NBP 40 mg/kg组、NBP 80 mg/kg组较NBP 20 mg/kg组抑制BBB的通透性作用更明显(P<0.05),NBP 40 mg/kg组、NBP 40 mg/kg组差异无统计学意义(P>0.05),见表1。
表1 各组脑缺血再灌注大鼠神经功能评分和EB含量的变化(,n=6)
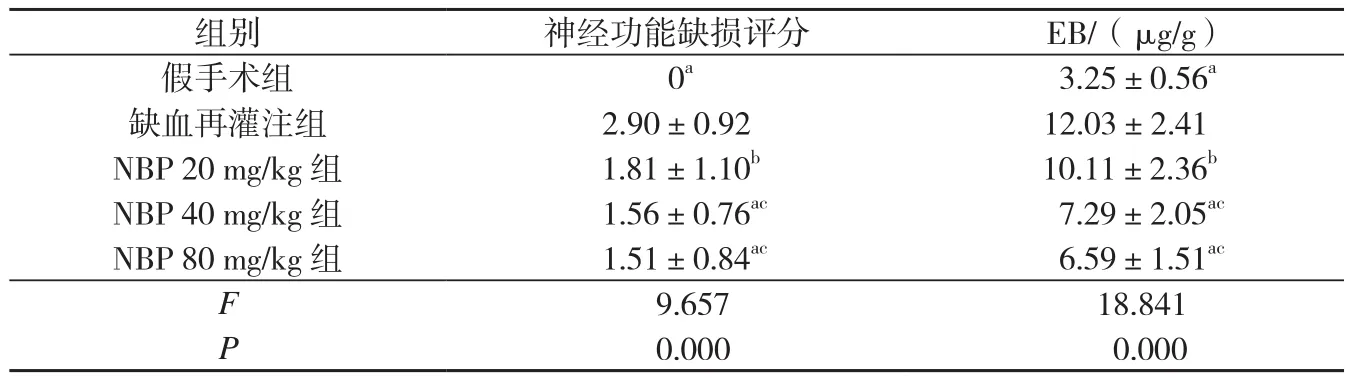
表1 各组脑缺血再灌注大鼠神经功能评分和EB含量的变化(,n=6)
与缺血再灌注组比较,aP<0.01,bP<0.05;与 NBP 20 mg/kg 组相比,cP<0.05。
组别 神经功能缺损评分 EB/(μg/g)假手术组 0a 3.25±0.56a缺血再灌注组 2.90±0.92 12.03±2.41 NBP 20 mg/kg 组 1.81±1.10b 10.11±2.36b NBP 40 mg/kg 组 1.56±0.76ac 7.29±2.05ac NBP 80 mg/kg 组 1.51±0.84ac 6.59±1.51ac F 9.657 18.841 P 0.000 0.000
2.3 缺血区大脑皮质神经元及BBB超微病理变化
透射电镜下观察,假手术组大脑皮质神经元细胞膜、核膜较清晰,染色质分布均匀;线粒体、核糖体及粗面内质网丰富,可见高尔基体、溶酶体(图1a);BBB内皮细胞、基膜连续完整,胶质细胞足板构成的胶质膜排列紧密,胞质饱满(图2a)。缺血再灌注组脑缺血区神经元溶解、坏死,细胞膜、核膜模糊或断裂,染色质凝集;胞质溶解,各种细胞器结构均不清,出现大小不等的空泡(图1b)。BBB的血管内皮肿胀、染色深,基膜劈裂、溶解,胶质膜胞质溶解呈大片空泡(图2b)。NBP 20 mg/kg 组缺血区神经元肿胀略减轻,核膜较完整但不清晰,核仁趋向中央,线粒体损伤减轻,但仍有空泡化线粒体,高尔基体、粗面内质网扩张(图1c);BBB内皮细胞肿胀减轻,基膜连续,胶质膜胞质溶解好转,可见线粒体等细胞器,但部分足板仍空化,呈大小不等、不规则的囊泡状(图2c)。NBP 40 mg/kg 组核膜清晰、完整,核仁较大仍偏位,染色质较均匀;线粒体大部分较完整,也有部分嵴减少,粗面内质网,核糖体较丰富(图1d);BBB内皮细胞肿胀明显减轻,基膜连续,胶质膜大部分足板胞质溶解已少见,细胞器增多(图2d)。NBP 80 mg/kg组膜结构清晰,核膜完整,染色质较均匀;线粒体趋于正常,可见高尔基复合体和粗面内质网,较丰富的核糖体(图1e);BBB内皮细胞完整、无水肿,可见细胞器,基膜均匀、连续,胶质膜足板胞质溶解少见,细胞器较多(图2e)。见图1、图2。
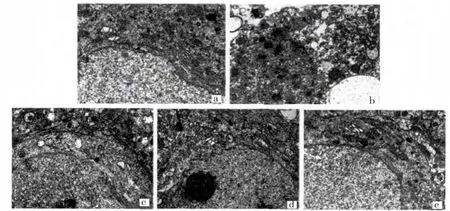
图1 各组大鼠神经元超微结构的变化(×15000)
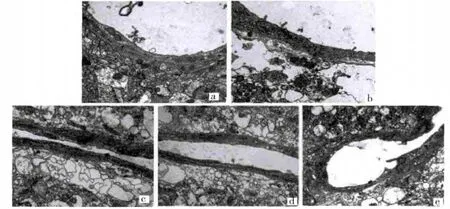
图2 各组大鼠BBB超微结构的变化(×15000)
3 讨论
脑缺血再灌注损伤最显著的组织学变化是神经元丢失和BBB结构破坏导致的血管源性脑水肿,而细胞和组织的超微结构是反映细胞损伤和修复最为直观的指标。本实验结果显示,缺血再灌注组神经元和BBB严重受损,如神经元崩解、坏死,染色质凝集,膜结构断裂不完整,胞质溶解,仅见少量严重受损的内质网和线粒体;BBB的毛细血管内皮细胞肿胀、坏死,基膜断裂、溶解,胶质膜足板胞质溶解呈大空泡状,仅存少量溶解、破坏的细胞器碎片。与Zhao等[6]研究结果一致。EB含量检测发现脑缺血再灌注后,大鼠脑组织中EB含量比假手术组显著增高,也表明BBB通透性增高、完整性破坏。
NBP是从芹菜籽中提取的有效成分,药物作用广泛,有改善微循环、抑制兴奋性氨基酸释放、增强抗氧化酶活性、降低Ca2+超载、保护线粒体、减少神经元凋亡等作用[7-9]。本实验结果显示,NBP预处理各组缺血区神经元肿胀减轻,膜结构渐完整、清晰,线粒体损伤明显减轻,高尔基体、粗面内质网和核糖体等细胞器数量和形态趋于正常;BBB内皮细胞肿胀、胶质膜胞质溶解渐好转,足板空化减轻,细胞器增多,基膜渐连续。从形态学方面上证实了以往研究结果[10-12],说明NBP干预可减轻随后发生的脑缺血再灌注损伤,对神经元具有预防性保护作用。
此外,本研究还发现,NBP 20 mg/kg组即可明显减轻脑缺血再灌注所致的神经元和BBB破坏;NBP 40 mg/kg组、NBP 80 mg/kg组较NBP 20 mg/kg组作用更明显,NBP 40 mg/kg组与NBP 80 mg/kg 组之间差异不明显(P>0.05)。说明NBP预处理对脑缺血再灌注神经元和BBB损伤有明显的预防性保护作用,NBP 40 mg/kg组预防效果较好。因此,为NBP开发成脑卒中高危人群预防用药及剂量提供了重要的实验依据。
[1]KNEISEL U,WOLBURG H. Tight junctions of the blood brain barrier[J]. Cell Mol Neurobiol,2000,20(1): 57-69.
[2]龙翠英,王明科,郑春玲,等. 丁苯酞软胶囊治疗急性脑梗死临床观察[J]. 中国实用神经疾病杂志,2011,14(4): 19-21.
[3]倪海斌,汪东良,韩威威,等. 丁苯酞(恩必普)联合丹参治疗缺血性脑卒中的临床疗效观察[J]. 中国现代医生,2014,52(13): 53-55.
[4]李静,魏光宇. 丁苯酞对缺氧/复氧诱导大鼠皮层神经元损伤的保护作用[J]. 山西医科大学学报,2010,36(1): 1-3.
[5]LONGA E Z,WEINSTEIN P R,CARLSON S,et al. Reversible middlecerebral artery occlusion without craniectomy in rats[J].Stroke,1989,20(1): 84-91.
[6]ZHAO S M,KONG W,ZHANG S F,et al. Pretreatment with scutellaria baicalensis stem-leaf total flavonoid prevents cerebral ischemia-reperfusion injury[J]. Neural Regeneration Res,2013,8(34): 3183-3192.
[7]鄢学芬,詹瑾,黄叶宁,等. 丁苯酞的药理作用与临床评价[J]. 中国医院药学杂志,2008,28(17): 1498-1500.
[8]李延可,刘宁,陈江君. 丁苯酞对急性缺血性脑卒中的作用及机制研究[J]. 中国医药导刊,2012,14(2): 254-255.
[9]高兰,娄季宇,杨霄鹏. 丁苯酞对脑缺血再灌注损伤大鼠 MMP-9 活性和血脑屏障通透性的影响[J]. 中风与神经疾病杂志,2012,29(2): 116-118.
[10]殷雁,辛世萌. 丁苯酞预处理对大鼠脑缺血再灌注损伤的神经保护作用[J]. 中风与神经疾病杂志,2012,29(8): 715-718.
[11]葛宇松,刘雪松,薛俊燕,等. 丁苯酞注射液预处理通过 PI3K/Akt 通路对大鼠脑缺血再灌注损伤的神经保护作用[J]. 中风与神经疾病杂志,2013,30(1): 33-37.
[12]纪海茹,孔令伟,孔维,等. 丁苯酞预处理对脑缺血再灌注损伤大鼠神经功能缺损评分、氧化损伤和形态学的影响[J]. 解剖学报,2014,45(5): 626-31.
——可作为磷酸盐库再利用!

