胸膜巨大孤立性纤维瘤合并周围型肺动脉瘤1例
程远大 高阳 张位星 张春芳
1 临床资料
男性,50岁,2013年1月因胸痛、胸闷就诊,计算机断层扫描(computed tomography, CT)检查发现左侧胸腔占位,左舌叶动静脉畸形(图1A,图1B),建议手术,但患者要求保守治疗,予以追踪观察。2014年9月,患者因胸闷、气促加重,再次就诊,CT提示左侧胸腔占位,病变累及肺门,纵隔多发淋巴结肿大,左肺不张,左肺动脉瘤形成,左侧胸腔积液,考虑胸腔种植性转移(图1C,图1D)。完善相关检查后,为解除压迫症状,患者强烈要求手术探查。于2014年9月12日行左侧开胸探查术,手术经左侧第5肋床外侧切口进胸,见胸腔内大量淡黄色清亮胸水,左肺压缩不张,胸腔内肿块侵犯左下肺,大小约20 cm,质脆,血运丰富,触之易出血,胸壁、膈肌等多处可见类似病变。经与患者家属沟通后,要求切除病变。因肿瘤血运丰富,无法分块切除,手术直接暴露肺门结构,解剖上、下肺静脉及肺动脉干,切除左全肺,对于胸壁和膈肌的病变行姑息性切除,术中出血约650 mL,输浓缩红细胞2 u。胸腔及胸壁的肿块术后病检结果示:梭形细胞肿瘤,部分细胞有明显异型性,核分裂现象多见,浸润肺组织,结合免疫组化,考虑恶性孤立性纤维瘤。免疫组化结果:CD34(+++)、Bcl-2(+++)、CD99(-)、S100(-)、TTF-1(-)、CK7(-)、CK-Pan(-)、EMA(-)、Vimentin(+)、CR(-)、MC(-)、CK5/6(-)、Ki67(约10%-15%)、TdT(-)、CD20(-)、CD5(-)、CgA(-)、Syn(-)、CD56(-)、F8(-)、CD31(-)。患者术后第10天顺利出院。患者分别于术后1个月(2014年11月)、8个月(2015年5月)再次到我院复查,患者未诉特殊不适,复查胸片示气管左移,左侧呈全肺切除术后状态,右肺纹理及肋膈角清晰(图2)。
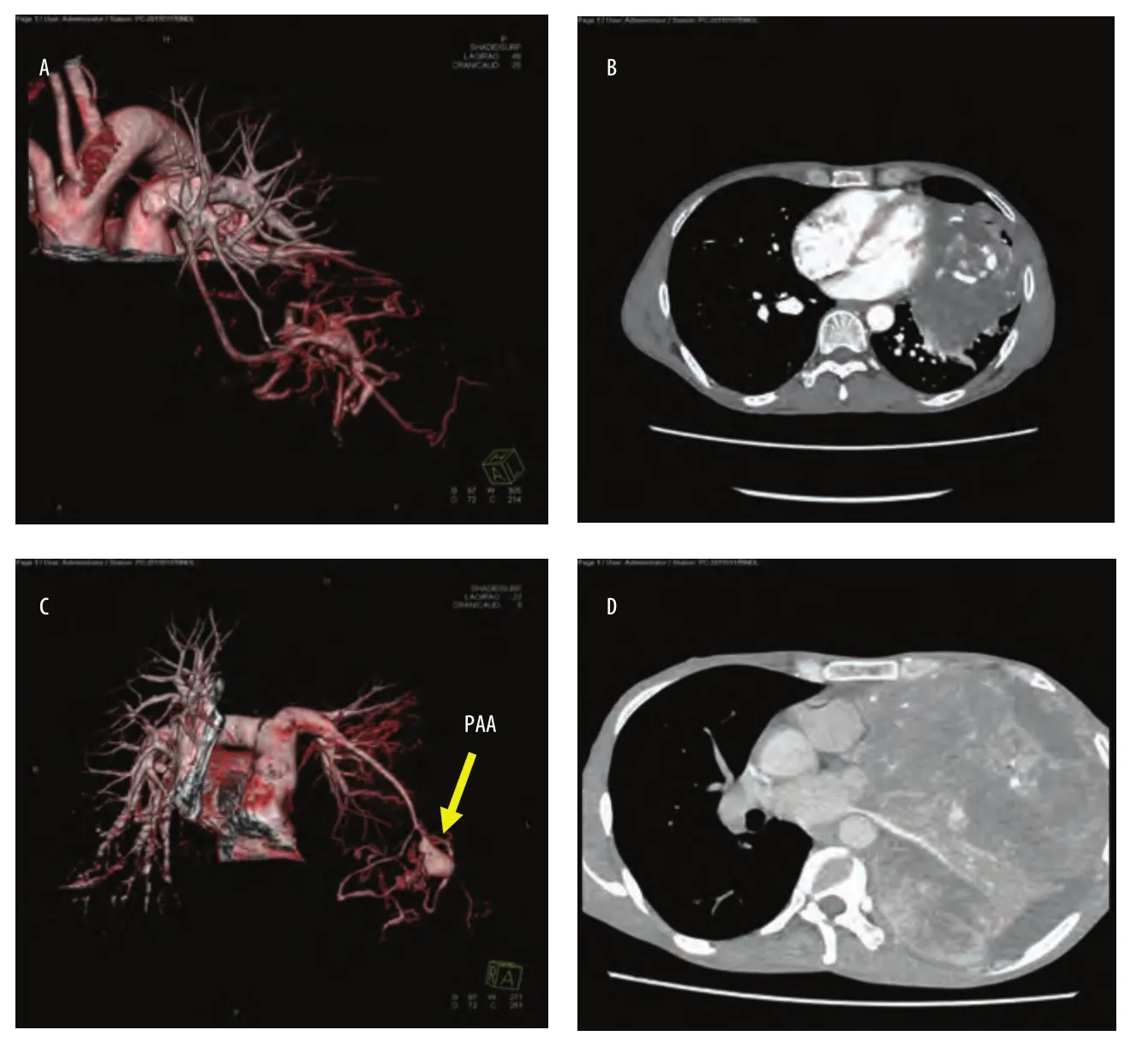
图1 患者影像图片。A和B分别是2013年患者的3D血管成像和增强CT扫描;C和D是2014年的3D血管成像和增强CT扫描。从2014年的C和D图片中,我们可以发现肺动脉瘤已形成,肿块变大,占据左侧胸腔。Fig 1 Image pictures of patients. A is 3D imaging of vessels and B is enhanced CT scan of chest in 2013; C and D is in 2014. From C and D, we can find PAA has formatted and thoracic mass (SFTP) is larger and full of the left thorax in 2014. PAA: pulmonary artery aneurysm; CT: computed tomography.
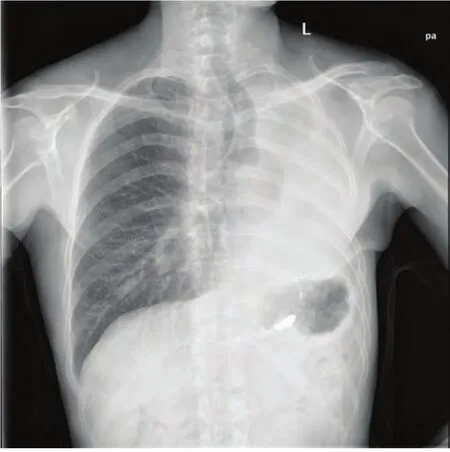
图2 患者术后胸片(2015年5月),显示左全肺切除术后的状态,气管左偏,右肺野很清晰。Fig 2 Chest X-ray after operation eight months (May in 2015), which shows a state of left pneumonectomy, trachea shift to the left, and right lung field is very clear.
2 讨论
胸膜孤立性纤维瘤(solitary fibrous tumors of pleura,SFTP),临床上不常见,占胸膜源性肿瘤的5%,约80%来自脏层胸膜,20%来自壁层胸膜,多见于50岁-70岁患者,无性别差异[1,2]。随着病理学水平的发展,SFTP被认为是起源于间皮下、间充质细胞,免疫组化常提示CD34和bcl-2呈阳性[3,4]。SFTP多为良性,据文献[5,6]报道恶性SFTP约占10%-20%,SFTP对放化疗不敏感,外科完整切除是目前SFTP的主要治疗方式[7],一般的体积不是较大的SFTP,可考虑胸腔镜手术[8],对于体积较大的仍需要开胸,我们曾报道1例巨大SFTP,肿瘤占据左侧整个胸腔,手术完整予以切除[9]。对于良性SFTP,其术后10年生存率高达97.5%[7],而恶性SFTP术后有一定的复发率,复发率约30%[10]。
肺动脉瘤(pulmonary artery aneurysm, PAA)临床亦非常罕见,尸检中发现其发病率约1/14,000,发病率与性别、年龄无关,80%位于主肺动脉[11]。PAA的发生、发展的机制目前仍不清楚。PAA常分为合并动静脉交通和不合并动静脉交通两大类,另40%见于单纯遗传性毛细血管扩张症,感染因素少;不合并动静脉交通的PAA常见发病原因可能与肺动脉高压、结蹄组织病(如:马凡综合症、Ehlers-Danlos综合征)、感染因素(梅毒、结核)、创伤等因素有关,另外还有一些不明原因的特发性PAA[12]。
对于SFTP合并PAA的患者目前尚未见报道,本文报道的左侧胸腔巨大SFTP合并周围性PAA的患者,临床上极为罕见。该患者无肺动脉高压、无明显感染因素、也无明确的外伤史,其肺动脉瘤位于周边,CT提示为合并动静脉畸形,因此考虑可能与遗传因素有关。随着SFTP的生长,瘤体的增大压迫肺组织导致左肺不张,PAA也随之形成而变大。可能的原因为巨大胸腔内肿瘤的压迫,导致肺动脉阻力的增高,肺动脉压力也随着上升所致。
PAA的临床表现无特殊性,主要表现有咯血、胸痛、呼吸困难、咳嗽、发热等,其中严重的咯血是肺动脉的危险信号,常暗示PAA的破裂[13]。该患者无明显咯血,主要表现为胸闷、气促,主要是肿瘤的压迫症状。肺血管三维成像是诊断PAA的主要手段之一,但有关PAA治疗,目前尚无统一的治疗指南,外科干预被认为是有效的方法之一。近端的PAA常采用肺动脉成形或置换,周围性的PAA常采用肺叶切除或介入栓塞治疗。本例患者因合并SFTP,且病变累及肺组织和肺门结构,左全肺不张,胸壁和膈肌多处种植转移,因此手术行左全肺切除及胸腔内的减瘤手术。根据患者半年后的随访结果可见,手术到达一定的治疗效果,改善了患者的生活质量。因手术为姑息性切除,且术后的病检结果为恶性SFTP,因此患者术后会存在肿瘤的复发。SFTP目前缺乏有效的放化疗,所以该患者术后需定期复查,必要时可考虑再次手术。
综上可见,该例患者因缺少更早期的临床检查资料,PAA与其胸腔内的SFTP在发病机制上无法判断是否存在相关性,但在后期的发展过程中,随着胸腔内的SFTP的生长,瘤体的变大,可能加速了PAA的形成和进展。但对于胸腔内巨大占位性病变是否是周围性PAA形成的原因之一,尚有待于进一步研究。

