人长链非编码RNA基因SPRY4-IT1对肺癌细胞A549侵袭和迁移能力的影响
柴松 安文婷 郭丽丽 姜乐 高志嵩 李书军
长链非编码RNA(long non-coding RNA, lnc RNA)是一类长度大于200个核苷酸的非编码RNA,在人类全基因组中有20万-40万种不同的lnc RNA。研究[1]表明lnc RNA可以通过多种方式影响编码基因的表达,在肿瘤的发生发展过程中起调控作用。SPRY4内含子转录本1(SPRY4 intronic transcript 1, SPRY4-IT1)(基因号AK024556)是转录自SPRY4基因的第二个内含子的长度为687个核苷酸的未剪接的、多聚腺苷酸化的转录产物,最初在脂肪组织中得以鉴定,且过表达SPRY4-IT1在黑色素瘤中具有促进细胞生长、迁移和侵袭的作用[2],然而其在肺癌细胞中的作用尚未报道。本研究拟探讨SPRY4-IT1对肺癌细胞A549侵袭和迁移能力的影响,并初步探索可能的作用机制。
1 材料和方法
1.1 材料 人肺癌细胞系A549、95C、95D、Calu-3、H125、H1299、H1975、SPC-A1由河北医科大学第二医院肿瘤中心提供;抗基质金属蛋白酶(matrix metalloproteinase, MMP)-2抗体、抗MMP-9抗体均购自武汉博士德生物有限公司;Transwell(8 μm孔径)小室及Matrigel胶购自北京乐博生物科技有限公司,实验中所用引物由广州锐博生物有限公司设计并合成,检测SPRY4-IT1在肺癌A549细胞中的表达,RT-PCR上游引物为5'-AGCCACATAAATTCAGCAGA-3',下游引物为5'-CGATGTAGTAGGATTCCTTT-CA-3',GAPDH上游引物为: 5'-GACTCATGACCACAGTCCATGC-3',GAPDH下游引物为: 5'-AGAGGCA-GGGATGATGTTCTG-3'。
1.2 基因全长序列克隆 根据GenBank数据库SPRY4-IT1标准序列NR-002196.1设计引物,上游引物5'-TAAGCTTGTAGAGATGGGGGTTTCATCCTGTTGG-3',下游引物5'-ACTCGAGAAAGACTCCCTTTCCTTAAGCAGATTCAC-3’,循环条件:93oC预变性1 min,93oC变性30 s,65oC退火30 s,72oC延伸2 min,25个循环,72oC终末延伸5 min,产物用1%琼脂糖凝胶电泳分离扩增产物并进行产物纯化回收,将产物连接T载体后,转化DH5α感受态细胞,通过蓝白斑筛选,挑取白色克隆,扩增后进行酶切鉴定,同时送测序分析证实扩增片段的正确性。
1.3 构建真核表达载体 双酶切pcDNA3.1载体和插入正确片段的T质粒,分别纯化回收目的片段。连接线性化pcDNA3.1载体和目的片段,转化DH5α感受态细胞,进行菌液PCR鉴定,并通过测序分析得到插入片段阳性克隆,命名为pcDNA3.1-SPRY4-IT1表达载体。用无内毒素试剂盒大量制备质粒。
1.4 细胞培养和细胞转染[3]使用含10%小牛血清的RPMI-1640培养液,在37oC、含5%CO2的培养箱内培养实验中用到的肺癌细胞系。细胞生长融合度达到50%时,用Lipo 2000进行细胞转染,分为转染空载体pcDNA3.1组和转染pcDNA3.1-SPRY4-IT1表达载体组。
1.5 RT-PCR检测肺癌细胞中SPRY4-IT1的表达 培养肺癌细胞,细胞生长融合度打70%时收集细胞,通过Trizol法提取细胞总RNA,逆转录合成cDNA,应用上述RT-PCR引物扩增SPRY4-IT1,ABI7300检测并分析各细胞中SPRY4-IT1的水平。
1.6 细胞划痕迁移实验 将A549细胞以每孔5×105个接种于6孔板中,按照上述实验分组转染48 h后,细胞融合度达到90%以上,用无菌移液枪头部划线,置于37oC、5%CO2的细胞培养箱中培养24 h后光学显微镜下拍照,随即取5个视野,测量划痕两侧细胞间距取平均值,每组实验设3个复孔,实验重复3次。
1.7 Transwell侵袭实验 将A549细胞以每孔5×105个接种于6孔板中,细胞生长融合度为60%时按照上述实验分组转染空载体和pcDNA3.1-SPRY4-IT1过表达质粒,转染24 h后收集转染后的各组细胞,重悬于无血清RPMI-1640培养液,以每孔5×104个细胞加入预铺好Matrigel的Transwell小室上室内,下室加入500 μL完全培养液,置于37oC、5%CO2细胞培养箱中培养24 h 后多聚甲醛固定,0.05%结晶紫染色,400倍光学显微镜下计数穿膜细胞数,随即取10个视野,取平均值,每组实验设3个复孔,实验重复3次。
1.8 免疫印迹实验[4]收集细胞划痕实验后的各组细胞,用胰酶消化并收集,用含有蛋白酶抑制剂的RIPA裂解细胞,置于冰上,每5分钟震摇细胞1次,共裂解30 min,15,000 rpm在4oC离心机上离心15 min,取上清,即为提取的细胞蛋白质。通过BCA法检测蛋白浓度,水浴变性蛋白,加入5×SDS-PAGE上样缓冲液,加样等量蛋白的蛋白裂解液,用10%的SDS-PAGE胶进行电泳分离,电转印到尼龙膜上,用5%脱脂牛奶的PBS缓冲液室温封闭1 h,一抗用1:1,000稀释的抗人MMP-2、MMP-9单克隆抗体4oC过夜孵育,用PBS-Tween洗膜,室温每次15 min,共3次;印迹膜用1:3,000的抗鼠IgG偶联的辣根过氧化物酶作为二抗,室温孵育1 h,用PBS-Tween洗膜,室温每次15 min,共3次。用增强型化学发光液检测试剂盒化学发光显色。检测细胞中MMP-2、MMP-9的表达,以β-actin作为内参照,结果进行灰度值分析并通过统计学检验,实验重复3次。
1.9 统计学处理 采用SPSS 13.0统计分析软件,计量资料采用均数±标准差(Mean±SD)表示,组间比较采用t检验,以P<0.05为差异有统计学意义。
2 结果
2.1 pcDNA3.1-SPRY4-IT1真核表达载体构建 以cDNA为模板,用引物扩增目的片段,得到与预期片段大小相符的特异性片段(图1A)。切胶纯化回收目的片段,并与pGEMTeasy载体连接,插入目的片段后,通过酶切鉴定和测序分析证实插入片段的正确性(图1B,图1C)。将目的片段SPRY4-IT1与pGEM-Teasy载体连接后的重组体经BamH I+Hind III双酶切,与相同双酶切线性化的pcDNA3.1载体连接,得到完整的pcDNA3.1-SPRY4-IT1表达载体,通过BamH I+Hind III酶切鉴定和测序分析(图1D,图1E),确认载体构建成功。将重组质粒pcDNA3.1-SPRY4-IT1和空质粒pcDNA3.1转染A549细胞后,检测细胞中SPRY4-IT1表达,结果提示转染重组质粒pcDNA3.1-SPRY4-IT1的细胞中SPRY4-IT1表达量是转染空质粒的32.7倍(图2)。

图1 pcDNA3.1-SPRY4-IT1真核表达载体构建情况。A:目的片段扩增产物;B:目的片段与T载体连接后酶切鉴定结果;C:目的片段与T载体连接后测序结果;D:目的片段与pcDNA3.1载体连接后酶切鉴定结果;E:目的片段与pcDNA3.1载体连接后测序结果。Fig 1 pcDNA3.1-SPRY4-IT1 eukaryotic expression vector construction. A: Amplification products of target fragment; B: Enzyme digestion identification results of target fragment and T vector; C: Sequencing results of target fragment and T vector; D: Enzyme digestion identification results of target fragment and pcDNA3.1 vector; E: Sequencing results of target fragment and pcDNA3.1 vector.
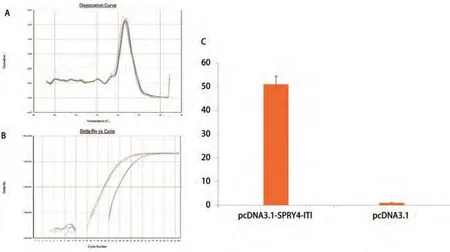
图2 将重组质粒pcDNA3.1-SPRY4-IT1和空质粒pcDNA3.1转染A549细胞后,检测细胞中SPRY4-IT1表达。A:目的基因溶解曲线;B:目的基因扩增曲线;C:SPRY4-IT1在细胞中表达水平比较。Fig 2 The expression of SPRY4-IT1 in pcDNA3.1-SPRY4-IT1 and pcDNA3.1 A549 cells. A:Dissolution curve of target gene; B: Amplification curve of target gene; C: The expression of SPRY4-IT1 in different cells.
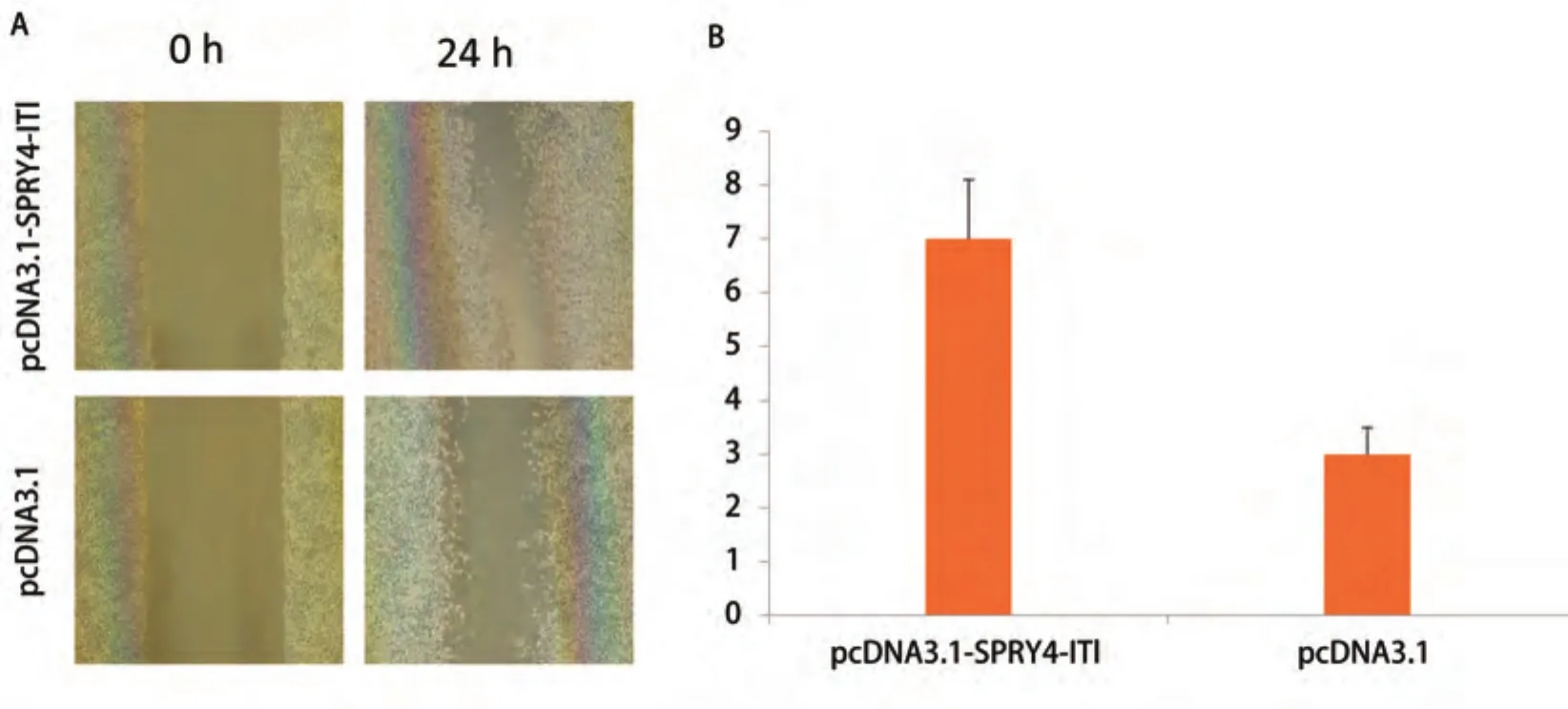
图3 细胞划痕实验结果。A:培养24 h后两组细胞迁移结果的比较(×400);B:24 h后两组细胞迁移距离比较。Fig 3 Cell scratch test results. A: Cell migration results of two groups (×400); B: Cell migration spaces of two groups.
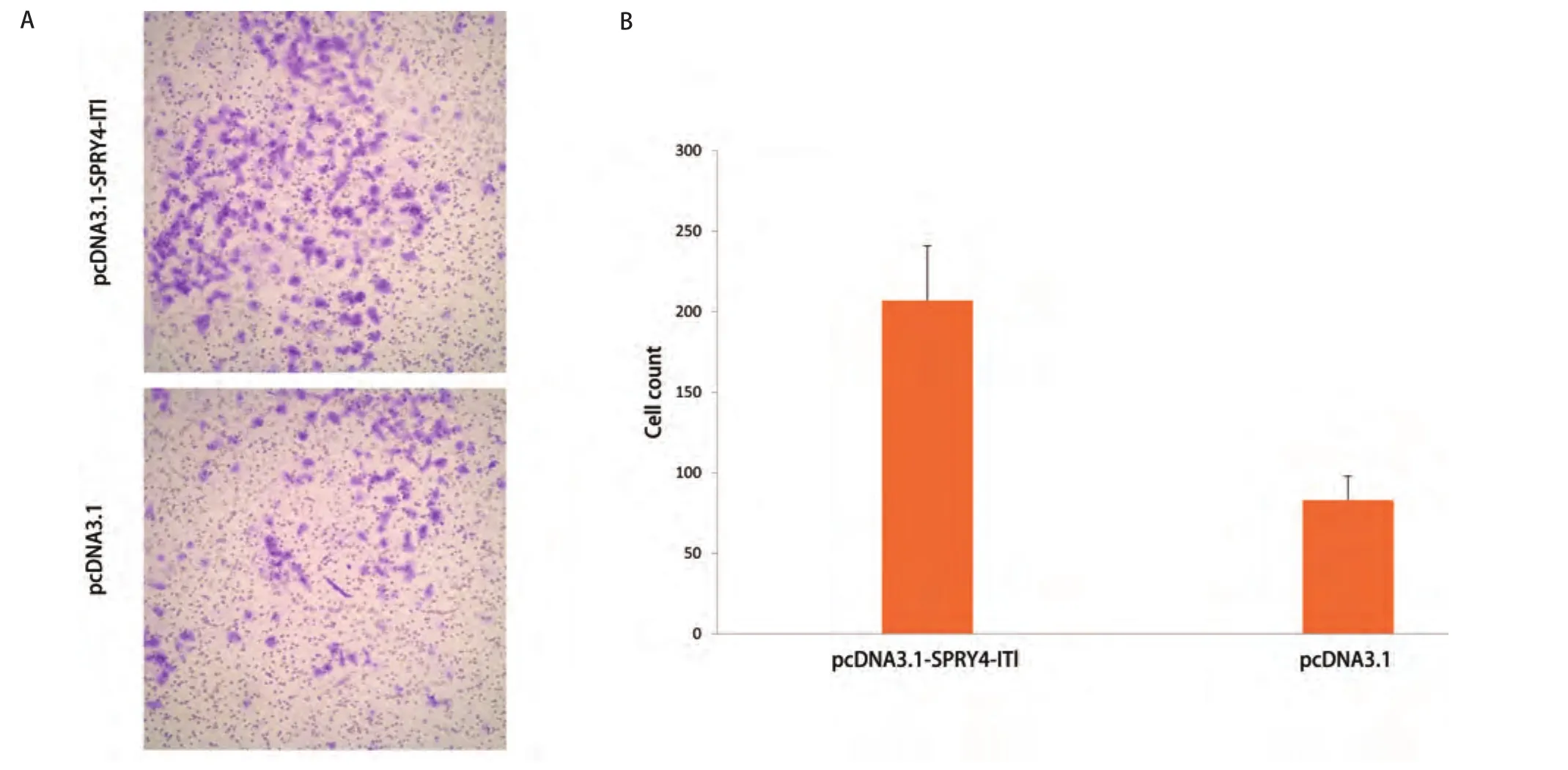
图 4 细胞Transwell小室结果。A:显微镜下两组细胞穿过Transwell小室基底膜结果(×400);B:两组细胞穿过基底膜细胞数目比较。Fig 4 Transwell assay results. A: Cells through the basement membrane results of two groups (×400); B: The numbers of transmembrane A549 cells of two groups.
2.2 SPRY4-IT1对细胞迁移能力的影响 将A549细胞接种于6孔板,转染pcDNA3.1-SPRY4-IT1和空载体pcDNA3.1,24 h后结果显示转染pcDNA3.1-SPRY4-IT1细胞划痕两侧细胞间距较转染pcDNA3.1细胞明显变窄(图3),提示A549细胞转染pcDNA3.1-SPRY4-IT1后细胞的迁移能力增强。
2.3 SPRY4-IT1对细胞侵袭能力的影响 A549细胞转染pcDNA3.1-SPRY4-IT1后其穿膜细胞数为(207±34)个/视野,对照组为(83±15)个/视野,组间差异有统计学意义(P<0.05)(图4)。表明A549细胞转染pcDNA3.1-SPRY4-IT1后细胞的侵袭能力增强。
2.4 SPRY4-IT1对MMP-2和MMP-9蛋白的影响 转染pcDNA3.1-SPRY4-IT1细胞中的MMP-2及MMP-9蛋白表达较转染空质粒组均有升高(图5)。
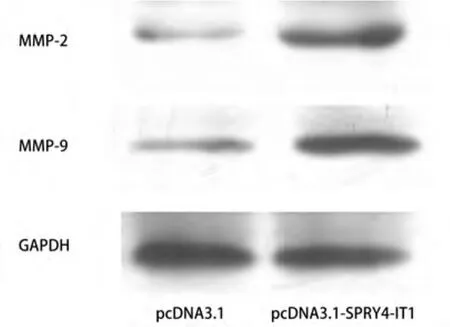
图 5 过表达SPRY4-IT1对MMP-2和MMP-9的影响Fig 5 Effect of overexpression of SPRY4-IT1 on matrix metalloproteinase (MMP)-2 and MMP-9
3 讨论
在人类基因组中除了编码基因外,同时包含大量的非编码RNAs(non-coding RNAs, ncRNAs)[5]。ncRNAs虽不具备编码蛋白质功能,但能通过不同方式调控编码基因的表达和功能,lncRNA与多种类型的肿瘤发生发展有着密切联系,已成为近年来的研究热点之一[1]。这类ncRNAs既可以通过影响蛋白翻译发挥转录后调控,也可以通过影响基因的转录活性及蛋白降解等多种途径发挥功能。
SPRY4-IT1是由SPRY4基因的一个内含子转录而来,其内部含有多个二级发卡结构,已有研究表明SPRY4-IT1在黑色素瘤细胞中过表达,并且参与调控黑色素瘤细胞的凋亡与迁移[2]。有关SPRY4-IT1在肺癌中的研究尚未见报道,为了更深入地探讨SPRY4-IT1基因在肺癌细胞中的作用,本研究克隆了SPRY4-IT1基因,并构建了SPRY4-IT1真核表达载体,用脂质体介导转染A549细胞,发现原本在A549细胞中表达量很低的SPRY4-IT1,在转染pcDNA3.1-SPRY4-IT1后,表达量升高了25倍(与转染空载体相比较),能够满足进一步的实验需要。
肺癌细胞最重要的恶性行为即具有高度的侵袭转移能力[6-8],因此我们在肺癌A549细胞中转染pcDNA3.1-SPRY4-IT1重组质粒,观察SPRY4-IT1对肺癌细胞迁移、侵袭能力的影响。我们的研究发现,转染pcDNA3.1-SPRY4-IT1细胞划痕两侧细胞间距较转染pcDNA3.1细胞明显变窄,A549细胞转染pcDNA3.1-SPRY4-IT1后其穿膜细胞数为(207±34)个/视野,对照组为(83±15)个/视野,组间差异有统计学意义(P<0.05),可见通过细胞划痕运动实验和Transwell侵袭实验均证实过表达SPRY4-IT1后可以明显增加A549细胞的侵袭、迁移能力,提示SPRY4-IT1有可能与肺癌细胞的侵袭迁移相关。MMP-2和MMP-9是目前公认的调控肿瘤侵袭转移的关键因子[9-11],为了进一步研究SPRY4-IT1对肺癌A549细胞侵袭迁移能力改变的作用机制,我们通过Western blot检测其中MMP-2及MMP-9的表达,发现在肺癌A549细胞中过表达SPRY4-IT1可以显著增加MMP-2和MMP-9蛋白的表达。
综上所述,在肺癌A549细胞中过表达SPRY4-IT1可增强细胞的侵袭、迁移能力;同时过表达SPRY4-IT1后MMP-2及MMP-9呈升高趋势,提示SPRY4-IT1可能通过对调控MMP影响肺癌的侵袭转移能力。可见SPRY4-IT1在肺癌的侵袭转移中发挥重要作用,为肺癌的临床治疗提供了新的药物靶点及监测指标。

