PTZ诱导的癫痫急性发作大鼠大脑神经元中F-actin、Calponin3和ROCK2的表达及其意义
程春旭,李树蕾,古小云,黄可欣,李艳超,张舒岩,杨立彬
(1.吉林大学第一医院儿科,吉林 长春 130021;2. 吉林省长春市传染病医院传染科,吉林 长春 130123;3.吉林大学基础医学院组织学与胚胎学系,吉林 长春 130021;4.吉林大学基础医学院生物学实验中心,吉林 长春 130021;5.吉林大学第一医院神经外科,吉林 长春 130021)
PTZ诱导的癫痫急性发作大鼠大脑神经元中F-actin、Calponin3和ROCK2的表达及其意义
程春旭1,2,李树蕾3,古小云3,黄可欣4,李艳超3,张舒岩5,杨立彬1
(1.吉林大学第一医院儿科,吉林 长春 130021;2. 吉林省长春市传染病医院传染科,吉林 长春 130123;3.吉林大学基础医学院组织学与胚胎学系,吉林 长春 130021;4.吉林大学基础医学院生物学实验中心,吉林 长春 130021;5.吉林大学第一医院神经外科,吉林 长春 130021)
目的:探讨戊四氮(PTZ) 诱发的大鼠癫痫急性发作对大脑神经元中F-actin、Calponin3和ROCK2蛋白表达水平的影响,阐明癫痫急性发作时阻断F-actin异常解聚、触发F-actin重构的可能机制。方法:3周龄Wistar 幼鼠56只分为对照组(n=6)和癫痫组(n=50)。对照组大鼠给予腹腔注射生理盐水;癫痫组大鼠经腹腔注射60 mg·kg-1PTZ建立癫痫急性发作模型,造模成功的24只大鼠分别在癫痫急性发作后的相应时间点(1、2、3和7 d时)随机处死6只用于取材。采用Alex-488标记的phalloidine进行荧光染色观察大鼠大脑海马组织中分子层的F-actin荧光强度;采用免疫荧光染色法观察大鼠大脑皮层和海马神经元中Calponin3和ROCK2的分布;采用Western blotting法检测大鼠海马组织中Calponin3、ROCK2和磷酸化ROCK2蛋白的相对表达水平。结果:与对照组比较,癫痫急性发作1 d后,癫痫组大鼠大脑树突棘密集的海马中分子层的F-actin荧光强度降低(P<0.05),点状聚集结构消失。免疫荧光染色,对照组大鼠Calponin3在神经元胞质中弥漫性分布,而癫痫急性发作7 d后,癫痫组大鼠神经元中Calponin3则聚集在细胞皮质;对照组大鼠ROCK2仅在少量神经元突起中分布,而癫痫急性发作7 d后,癫痫组大鼠大量神经元胞体和突起中均可见ROCK2分布。Western blotting检测,与对照组比较,癫痫组大鼠各时间点海马组织中Calponin3相对表达水平显著降低(P<0.05),但是随着时间延长,1周内逐渐升高并趋向正常水平。与对照组比较,癫痫组大鼠海马组织中ROCK2蛋白相对表达水平从癫痫急性发作后3 d开始显著增加并持续至造模后7 d(P<0.05);磷酸化ROCK2蛋白相对表达水平则从癫痫急性发作后1 d就开始显著增加并持续到7 d(P<0.05),且随着时间延长逐渐降低。结论:PTZ诱导幼鼠癫痫急性发作导致F-actin异常解聚,同时激活RhoA/ROCK2信号途径,上调ROCK2和Calponin3蛋白表达水平。
癫痫;戊四氮;丝状肌动蛋白;钙调节蛋白3;ROCK2
癫痫作为长期反复的发作性疾病,神经元树突棘缺失和超兴奋性突触的重建是其重要的病理特征。丝状肌动蛋白(Filiment-actin,F-actin)作为主要的细胞骨架,主要分布在成熟神经元的树突棘[1-3],维持树突棘结构的稳定。因此,F-actin结构或水平异常与癫痫中树突棘缺失和重建有密切关联。研究[4-8]证实:在多种不同致痫剂诱导的癫痫急性发作动物模型中,树突棘和F-actin水平均显著减少,随着病程的延长,F-actin水平逐渐恢复,同时伴随着树突棘的重建[4,9-10]。但是,癫痫急性发作后阻断F-actin异常解聚、触发F-actin重构的机制尚不十分明确。为了阐明该机制,本研究检测了戊四氮(pentetrazol,PTZ)诱导的癫痫急性发作大鼠大脑神经元中F-actin、钙调节蛋白3(Calponin3)和ROCK2的分布和表达。
1 材料与方法
1.1动物、主要试剂和仪器3周龄Wistar雄性幼鼠56只,体质量(37±5)g, 由吉林大学实验动物中心提供,动物合格证号:SCXK(吉)-2013-0001。经吉林大学基础医学院实验动物伦理委员会审查,所有动物按屏障环境设施要求管理,饲养于屏障环境设施中,24 h自由饮食。PTZ和Alex 564-phalloidine (Sigma公司,美国),兔抗ROCK2(Abcam公司,美国),兔抗Calponin3(Sant Cruz公司,美国),水溶性封片剂(Thermo公司,美国),蛋白质提取试剂盒(Qiagen公司,德国),BAC试剂盒(碧云天生物技术研究所,中国),ECL发光试剂盒(Thermo公司,美国)。石蜡切片机(Leica公司,德国),光学显微镜(Olympus公司,日本),ECL成像系统、SDS电泳仪和湿法转膜仪(Bio-RAD公司,美国)。
1.2动物分组和给药56只大鼠分为对照组(n=6)和癫痫组(n=50)。癫痫组50只3周龄Wistar 幼鼠腹腔注射60 mg·kg-1PTZ建立癫痫急性发作模型,按Racine分级[11]判断模型是否制备成功。造模成功后24 h为1 d,依次类推。根据造模后时间(1、2、3和7 d)将造模成功的24只大鼠(癫痫组)随机分为4个亚组,每组6只动物。对照组6只大鼠腹腔注射0.1 mL生理盐水。分别在造模成功后1、2、3和7 d腹腔注射0.3%水合氯醛麻醉大鼠,4%多聚甲醛磷酸盐缓冲液灌注固定,取大鼠脑组织,常规石蜡包埋,制备3 μm厚切片,用于荧光标记和免疫荧光检测。
1.3荧光标记法检测大鼠大脑海马中分子层的F-actin荧光强度造模后1 d取材制备石蜡切片。石蜡切片经过常规二甲苯脱蜡、下行梯度酒精和水化;滴加2 g·L-1Alexa Flour 488-Phalloidin,4℃过夜;PBS洗5 min×3次,水溶性封片剂封片,荧光显微镜下观察大鼠海马中分子层F-actin分布,利用ImageJ软件分析相同面积内F-actin的荧光强度。每组观察3只动物,每只动物观察3张脑组织切片。
1.4免疫荧光法检测大鼠大脑皮层和海马神经元中Calponin3和ROCK2的分布造模成功后7 d取材制备石蜡切片。石蜡切片经过常规二甲苯脱蜡、下行梯度酒精和水化;10%胃蛋白酶37℃抗原修复10 min,取出后室温放置10 min,PBS洗5 min×3次;5%小牛血清白蛋白组分Ⅵ室温封闭30 min;加入1∶100稀释的一抗(分别为兔抗ROCK2和兔抗Calponin3)4℃过夜,PBS洗5 min×3次;加入1∶100稀释的二抗Alex 488-羊抗兔,37℃孵育1 h,PBS洗30 min×3次;水溶性封片剂封片,荧光显微镜下观察大鼠海马和大脑皮层神经元中Calponin3和ROCK2的分布。
1.5Western blotting法检测大鼠海马组织中Calponin3、ROCK2和磷酸化ROCK2蛋白相对表达水平分别在造模成功后1、2、3和7 d取大鼠海马组织,利用蛋白质提取试剂盒提取总蛋白,BCA试剂盒进行蛋白质定量,取等量蛋白样品进行SDS电泳。恒压条件下将蛋白转至PVDF膜,10%脱脂奶粉封闭4 h,1∶500稀释的一抗(兔抗Calponin3、兔抗ROCK2、兔抗磷酸化ROCK2和鼠抗GAPDH)4℃孵育过夜,PBS洗10 min×3次,1∶1 000稀释的二抗孵育2 h,PBS洗10 min×3次,加入ECL反应液避光孵育5 min,ECL成像系统成像。用Image J 软件分析Western blotting结果, GAPDH吸光度(A)值为内参,对目的蛋白进行半定量分析,蛋白相对表达水平=目的蛋白A值/内参蛋白A值。

2 结 果
2.1大鼠大脑海马中分子层的F-actin表达癫痫组大鼠海马组织CA1和CA3区中分子层的F-actin的荧光强度较对照组明显降低(P<0.05),而且F-actin点状聚集结构消失,见图1(插页四)和表1。
2.2大鼠大脑皮层和海马神经元中Calponin3和ROCK2的分布对照组大鼠:Calponin3弥散分布于神经元细胞核周围和树突的胞质中,在树突周围呈不连续点状分布,树突轮廓模糊;海马CA1区神经元胞体仅有少量树突内可见ROCK2分布。癫痫组大鼠:Calponin3在神经元胞体和树突中分布明显减少,主要聚集于神经元胞体周边和树突周围,在树突周围呈连续的点状分布,树突轮廓清晰。Calponin3在海马CA1区神经元中的分布与大脑皮层相似,但由于海马CA1区神经元胞体相对较小,Calponin3在胞质中的分布变化不如大脑皮层神经元明显。CA1区神经元胞体和大量树突中均有ROCK2分布,故细胞边界、细胞核和树突的轮廓清晰。在大脑皮层神经元中ROCK2的分布与在海马CA1区相似,但是在树突中的分布变化不如CA1区明显(图2,见插页四)。
2.3大鼠海马组织中Calponin3、ROCK2和磷酸化ROCK2蛋白的相对表达水平癫痫组大鼠海马组织中Calponin3蛋白表达水平显著低于对照组(P<0.05),但随着时间延长逐渐增加趋近正常水平。造模后2 d内癫痫组大鼠海马组织中ROCK2蛋白相对表达水平并未明显增加,从第3天至第7天癫痫组大鼠海马组织中ROCK2蛋白相对表达水平明显高于对照组(P<0.05);而磷酸化ROCK2蛋白相对水平从造模后第1天至第7天一直显著高于对照组(P<0.05),且随时间延长呈现递减趋势。见图3和表2。
表1各组大鼠大脑海马组织分子层中F-actin的荧光强度

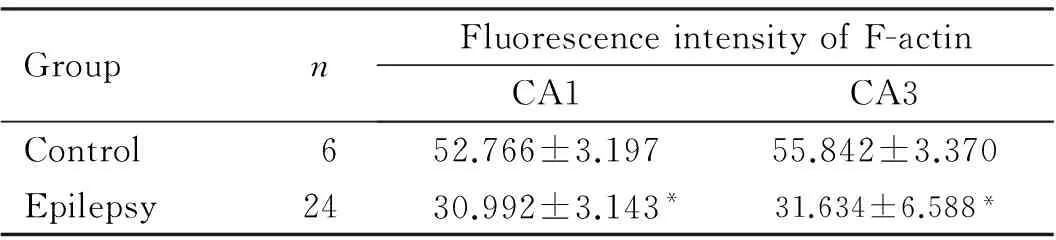
GroupnFluorescenceintensityofF-actinCA1CA3Control652.766±3.19755.842±3.370Epilepsy2430.992±3.143*31.634±6.588*
*P<0.05vscontrol group.

Lane 1:Control group; Lane 2-5: Epilepsy group(1-7 d after modeling).
图3各组大鼠海马组织中Calponin3、ROCK2和磷酸化ROCK2蛋白表达电泳图
Fig.3Electrophoregram of expressions of Calponin3,ROCK2,and phosphorylated ROCK2 proteins in hippocampus tissue of rats in various groups
表2各组大鼠海马组织中Calponin3、ROCK2和磷酸化ROCK2的蛋白相对表达水平
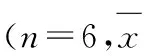
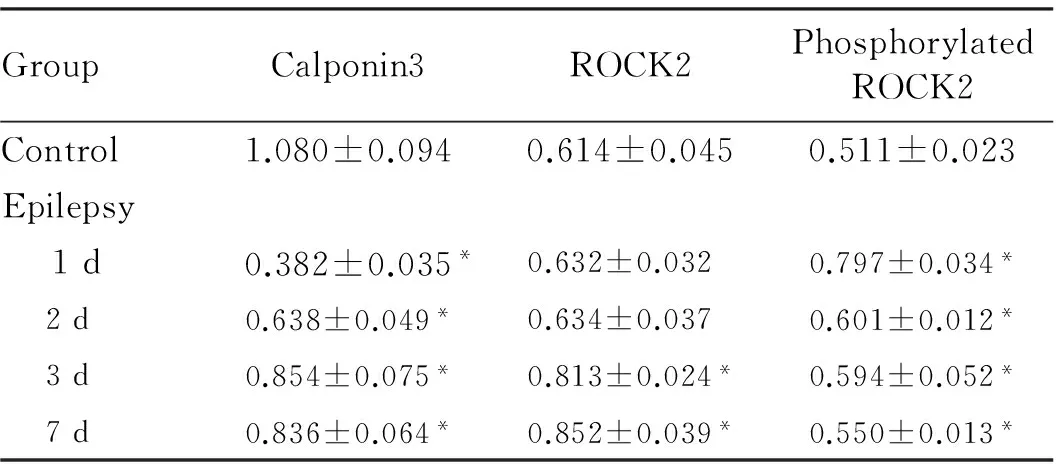
GroupCalponin3ROCK2PhosphorylatedROCK2Control1.080±0.0940.614±0.0450.511±0.023Epilepsy 1d0.382±0.035*0.632±0.0320.797±0.034* 2d0.638±0.049*0.634±0.0370.601±0.012* 3d0.854±0.075*0.813±0.024*0.594±0.052* 7d0.836±0.064*0.852±0.039*0.550±0.013*
*P<0.05vscontrol group.
3 讨 论
本研究利用PTZ诱导大鼠癫痫急性发作模型,检测了大鼠大脑神经元中F-actin、Calponin3和ROCK2的分布和蛋白表达水平,探讨了癫痫急性发作时阻断F-actin异常解聚、触发F-actin重构的可能调节机制。由于Phalloidin能透过醛类固定剂处理的细胞膜,可特异、高亲和力结合各种长度的F-actin,而不与肌动蛋白(actin)单体分子发生反应,所以本研究用Alexa Flour 488-Phalloidin荧光标记法检测海马组织中F-actin的分布。大鼠神经元中细胞骨架F-actin主要分布在树突棘中,而大脑海马CA1和CA3区神经元密集,其内分子层为树突棘富集区。本研究结果显示:对照组大鼠神经元可见F-actin聚集呈点状,荧光强度较强;而癫痫急性发作可导致神经元树突棘的数量减少,故癫痫组大鼠该区域的F-actin荧光强度低,F-actin的点状聚集消失,提示癫痫急性发作可导致F-actin异常解聚,而F-actin的持续异常解聚导致神经元树突棘的结构改变或数量减少。但是在动物模型中,癫痫急性发作后很快进入静止期,也称为树突棘重构期,为1~2周[4],因此,本课题组设想在癫痫急性发作后神经元中可能存在阻断F-actin异常解聚或触发F-actin重构的反馈性机制。
由于F-actin的结构和聚合状态受actin结合蛋白调节。其中,Calponin 3蛋白在中枢神经系统中,尤其是海马锥体细胞中表达异常丰富,与F-actin特异性地共定位于树突棘[12-13]。Calponin3能够识别并结合F-actin,防止F-actin降解,促进F-actin延伸[13]。因此,Calponin3是与癫痫有密切关联的actin结合蛋白。本研究从蛋白质水平和形态学水平分析了大鼠癫痫急性发作后Calponin3的变化,Western blotting结果显示:癫痫发作后各时间点大鼠海马组织中Calponin3表达水平均显著低于对照组,但随时间延长逐渐趋近正常水平,提示癫痫急性发作时F-actin异常解聚与Calponin3分离,大量游离的Calponin3进入胞质中并快速降解;但是随着外界刺激因素的消失,Calponin3的表达水平又逐渐上调,结合并稳定F-actin的结构,促进F-actin延伸,从而阻断F-actin的持续异常解聚,触发F-actin的重构。本研究中免疫荧光染色结果显示:癫痫急性发作后7 d,Calponin3从神经元核周胞质移位到细胞皮质。有研究[14]证实:磷酸化的Calponin3可从胞质易位到细胞皮质,而Calponin3磷酸化是其结合F-actin所必须的,因此本研究结果进一步验证了Calponin3参与癫痫急性发作后参与F-actin重构的推测。
为了验证癫痫急性发作后神经元中的Calponin3通过磷酸化调节F-actin重构,本研究还检测了海马神经元RhoA/ROCK2信号途径中ROCK2和磷酸化ROCK2蛋白表达水平。ROCK2只有被上游的RhoA激活为磷酸化ROCK2才能发挥催化底物磷酸化的作用[15-16]。本研究结果显示:癫痫急性发作后大鼠海马神经元中ROCK2表达水平随着时间呈现递增趋势,但是只有急性发作后3和7 d时ROCK2表达水平才显著高于对照组;而癫痫急性发作后各时间点的磷酸化ROCK2表达水平一直显著高于对照组,但是随着时间延长呈现递减趋势。ROCK2和磷酸化ROCK2的表达模式差异提示了癫痫急性发作可激活RhoA/ROCK2途径,首先促进神经细胞中ROCK2磷酸化,随后上调细胞中ROCK2的表达水平。由于活化的RhoA/ROCK2复合可从细胞溶质转移到细胞膜[15-16],本文作者推测:在癫痫急性发作后活化的ROCK2激酶结构域与底物Calponin3相互作用,催化其磷酸化并发生质膜易位,故而神经元核周胞质中Calponin3分布明显减少;随着时间延长,Calponin3表达增加,F-actin解聚减少;F-actin的延伸和重构增加,可能通过负反馈调节,使得磷酸化ROCK2表达水平逐渐下降。
综上所述,本文作者认为:激活RhoA/ROCK2途径依赖的Calponin3磷酸化是癫痫急性发作后阻断F-actin异常解聚、触发F-actin重构的可能机制。
[1]Zhang W,Benson DL.Developmentally regulated changes in cellular compartmentation and synaptic distribution of actin in hippocampal neurons [J].J Neurosci Res,2002,69 (4):427-436.
[2]Capani F,Martone ME,Deerinck TJ,et al.Selective localization of high concentrations of F-actin in subpopulations of dendritic spines in rat central nervous system:a three-dimensional electron microscopic study [J].J Comp Neurol,2001,435(2):156-170.
[3]宁薇,徐淑君,罗建红.培养大鼠海马神经元树突发育的活细胞成像和量化分析[J].浙江大学学报:医学版,2007,36(2):155-160.
[4]Isokawa M.Remodeling dendritic spines of dentate granule cells in temporal lobe epilepsy patients and the rat pilocarpine model [J].Epilepsia,2000,41 (Suppl 6):S14-S17.
[5]Mizrahi A,Crowley JC,Shtoyerman E,et al.High-resolutioninvivoimaging of hippocampal dendrites and spines [J].J Neurosci,2004,24(13):3147-3151.
[6]Zeng LH,Xu L,Rensing NR,et al.Kainate seizures cause acute dendritic injury and actin depolymerizationinvivo[J].J Neurosci,2007,27(43):11604-11613.
[7]Ouyang Y,Yang XF,Hu XY,et al.Hippocampal seizures cause depolymerization of filamentous actin in neurons independent of acute morphological changes [J].Brain Res,2007,1143:238-246.
[8]Kurz JE,Moore BJ,Henderson SC,et al.A cellular mechanism for dendritic spine loss in the pilocarpine model of status epilepticus [J].Epilepsia,2008,49(10):1696-1710.
[9]Zhang YF,Li SL,Xiong TQ,et al.The differential rearrangement of filamentous actin in mossy fiber synapses in Pentylenetetrazol-kindled C57BL/6 mice [J].Epilepsy Res,2014,108 (1):20-28.
[10]Zhang YF,Xiong TQ,Tan BH,et al.Pilocarpine-induced epilepsy is associated with actin cytoskeleton reorganization in the mossy fiber-CA3 synapses [J].Epilepsy Res,2014,108 (3):379-389.
[11]陈雅岚,李杰,徐馨,等.黑皮质素受体-4在癫痫模型大鼠脑组织中的表达及相关机制[J].第三军医大学学报,2014, 36(24):2445-2450.
[12]张军,黄晓元,王凌峰,等.调宁蛋白的研究进展与展望[J].中华临床医师杂志:电子版,2013, 7(2):739-741.
[13]Rami G,Caillard O,Medina I,et al.Change in the shape and density of dendritic spines caused by overexpression of acidic calponin in cultured hippocampal neurons [J].Hippocampus,2006,16 (2):183-197.
[14]Shibukawa K,Yamazaki N,Kumasawa K,et al.Calponin 3 regulates actin cytoskeleton rearrangement in trophoblastic cell fusion [J].Mol Biol Cell,2010,21 (22):3973-3984.
[15]肖保国.Rho激酶抑制剂的研究现状及其在神经系统疾病中的应用前景[J].重庆医科大学学报,2008,33 (Suppl 1):99-112.
[16]Schofield AV,Bernard O.Rho-associated coiled-coil kinase (ROCK) signaling and disease [J].Crit Rev Biochem Mol Biol,2013,48(4):301-316.
Expressions of F-actin,Calponin3,and ROCK2 in cerebral neurons of rats with acute epileptic seizure induced by PTZ
CHENG Chunxu1,2,LI Shulei3,GU Xiaoyun3,HUANG Kexin4,LI Yanchao3, ZHANG Shuyan5,YANG Libin1
(1.Department of Pediatrics,First Hospital,Jiliin University,Changchun 130021,China 2.Department of Infection,Infectious Disease Hospital,Jilin Province,Changchun 130123,China; 3. Department of Histology and Embryology,School of Basic Medical Sciences,Jilin University,Changchun 130021,China; 4. Center for Biological Experiment,School of Basic Medical Sciences,Jilin University,Changchun 130021,China; 5.Department of Neurosurgery,First Hospital,Jiliin University,Changchun 130021,China)
ObjectiveTo disscuss the effect of the acute epileptic seizure induced by pentetrazol (PTZ) on the expressions of F-actin,Calponin3,and ROCK2 in the cerebral neurons of the rats,and to illuminate the possible mechanism of preventing the F-actin from abnormal depolymerization and triggering the rearrangement of F-actin.Methods56 immature rats aged 3 weeks were divided into control (n=6) and epilepsy (n=50) groups. The rats in control group were injected with physiological saline introperitoneally.The rats in epilepsy group were introperitoneally injected with 60 mg·kg-1PTZ to establish the acute epileptic seizure models.And 6 rats from successful acute epileptic seizure models were sacrificed at different time points (1,2,3,and 7 d) after modeling.The fluorescence intensity of F-actin in the internal molecular layer of hippocampus of the rats was observed by phalloidine staining labeled by Alex-488; the distributions of Calponin3 and ROCK2 in the cerebral neurons in the pallium and hippocampus of the rats were detected by immunofluorescence method; the relative expression levels of Calponin3,ROCK2,and phosphorylated ROCK2 were analyzed by Western blotting method.ResultsCompared with control group,the fluorescence intensity of F-actin in the hippocampal internal molecular layer of the rats in epilepsy group was decreased (P<0.05),and the dot-shaped aggregation of F-actin was disappeared 1 d after modeling.The immunofluorescence results showed that Calponin3 dispersed in the cytoplasm of the neurons of the rats in control group;however,it aggregated in the cell cortex of the neurons 7 d after modeling in epilepsy group.ROCK2 was located in a small amount of neuritis of the rats in control group,whereas a great quantity of ROCK2 was found in both of the cell body and neuritis in epilepsy group 7 d after modeling.The Western blotting results showed that the relative expression levels of Calponin3 protein in the epilepsy group were markedly decreased at different time points after modeling compared with control group (P<0.05);however,it was increased gradually with the prolongation of time and closed to the level in control group within 1 week.The relative expression levels of ROCK2 protein in the hippocampus of the rats in epilepsy group began to increase steadily from 3 to 7 d after modeling compared with control group (P<0.05);however,the relative expression levels of phosphorylated ROCK2 protein in epilepsy group were increased sustainably from 1 to 7 d after modeling compared with control group (P<0.05),and were decreased gradually in a time-dependent manner.ConclusionThe acute epileptic seizure of the immature rats induced by PTZ not only leads to the abnormal depolymerization of F-actin,but also actives the RhoA/ROCK2 signal pathway simultaneously and up-regulates the expression levels of ROCK2 and Calponin3 proteins.
epilepsy; pentetrazol; filiment-actin;Calponin3;ROCK2
1671-587Ⅹ(2015)02-0299-05
10.13481/j.1671-587x.20150218
2014-06-17
吉林省科技厅自然科学基金资助课题(20130101138JC);吉林大学白求恩医学部青年科研基金资助课题(2069)
程春旭(1975-),女,吉林省长春市人,副主任医师,在读医学硕士,主要从事神经系统疾病方面的研究。
张舒岩,副教授(Tel:0431-81875891,E-mail:syzh27@yahoo.com.cn);
杨立彬,副教授,硕士研究生导师(Tel:0431-88782412, E-mail:yanglibin19681126@tom.com)
R742.1
A

