高同型半胱氨酸血症与阿尔茨海默病精神障碍的相关性分析*
郑占杰 陈 红 王金东 衣 磊 于 慧 孔伶俐 崔维珍
中国.山东省青岛市精神卫生中心 266034 △通讯作者 E-mail:zzjqd163@163.com
·论 著·(精神卫生)
高同型半胱氨酸血症与阿尔茨海默病精神障碍的相关性分析*
郑占杰 陈 红 王金东 衣 磊 于 慧 孔伶俐 崔维珍
中国.山东省青岛市精神卫生中心 266034 △通讯作者 E-mail:zzjqd163@163.com
目的:探讨高同型半胱氨酸血症与阿尔茨海默病精神障碍(BPSD)的相关性。方法:对77例阿尔茨海默病(AD)患者(BPSD组40例,非BPSD组37例)及39例正常对照者进行血浆同型半胱氨酸(Hcy)测定,并分析其与BPSD、认知功能障碍及痴呆病程的关系。结果:①BPSD组和非BPSD组血浆Hcy明显高于正常组(P<0.001),且BPSD组显著高于非BPSD组(P<0.001);②Hcy水平与认知功能障碍(rBPSD组=0.974,P<0.001;r非BPSD组=0.929,P<0.001)、痴呆病程(rBPSD组=0.988,P<0.001;r非BPSD组=0.974,P<0.001)密切相关,但未发现BPSD与认知功能障碍及痴呆病程的相关性。结论:高同型半胱氨酸血症可能参与BPSD的发病机制。
阿尔茨海默病;精神行为症状;同型半胱氨酸;简易智能精神状态量表
阿尔茨海默病(Alzheimer disease,AD)是一种以智能全面减退为主要表现的中枢神经系统原发性退行性变性疾病,其主要病理特征为老年斑和神经元纤维缠结[1]。据流行病学调查发现70%~90%的AD患者伴有妄想、幻觉、激越、攻击等行为和精神症状(BPSD)[2-3],与认知功能障碍一样,痴呆的精神障碍也是其核心症状。高同型半胱氨酸血症可由体内遗传性或非遗传性代谢障碍所致,既往有关Hcy方面的研究大多集中在精神分裂症、抑郁症及AD等人群,在国内未见与BPSD相关的文献报道。而高同型半胱氨酸血症是否与BPSD发病有一定的相关性,目前尚无定论。本研究旨在探讨BPSD患者血浆同型半胱氨酸(Homocysteine,Hcy)浓度及其可能的临床意义,并为BPSD的预防和治疗提供必要的帮助。
1 对象与方法
1.1 对象
研究组为2010年5月-2012年3月间在本院老年科门诊及住院的AD患者。入组标准:①符合《国际疾病分类》第10版(ICD-10)及《美国疾病诊断和统计手册》修订第4版(DSM-Ⅳ-TR)对AD的诊断标准;②简易智力状态检查(MMSE)≤24分[4];③痴呆病行为量表(BEHAVE.AD)评分≥8分[5];④性别不限,年龄≤80岁;⑤无拒食、暴食等异常饮食史;⑥排除抑郁等其他疾病导致的痴呆;排除心、肝、肾、内分泌、血液、风湿病、消化系统及营养不良等疾患;排除烟草酒精及其他精神活性物质滥用史,入组前未服用维生素类药物;⑦监护人提供病史并签署测试知情同意书。研究组共77例,根据是否伴有妄想、幻觉、激越、攻击等行为和精神症状分为BPSD组40例和非BPSD组37例。BPSD组:男19例,女21例;年龄60~79岁,平均(72.10±4.84)岁;病程9~36月,平均(21.58±7.45)月。非BPSD组:男19例,女18例;年龄60~80岁,平均(71.78±4.85)岁;病程9~36月,平均(20.92±7.77)月。正常对照组39例,来源于同期市立医院常规体检的健康老人,男19例,女20例;年龄60~80岁,平均(71.05±4.69)岁;MMSE≥27。均无精神疾病家族史、无烟酒嗜好,排除标准与研究组相同。3组性别、年龄及教育年限均无显著性差异。所有被试者在研究前皆签署知情同意书。
1.2 方法
1.2.1 实验方法 抽取所有受试者早上空腹血2ml,立即放入冰箱,1h内分离血清,于-30℃冷藏。集中统一编号,由本院化验室特定人员测定血浆同型半胱氨酸。测定采用循环酶法,药盒由德赛诊断系统有限公司生产。血浆Hcy的临床参考范围为5~15umol/L,>15umol/L为高Hcy血症。
1.2.2 认知评估 本研究采用简易智能精神状态量表(MMSE)评定受试者的认知功能障碍情况。均由本科室经过正规培训的专业医师进行评定。MMSE得分评定:MMSE量表共11个题目,总分为30分。划分痴呆的分界值为:文盲<17分,小学<20分,中学以上<24分。
1.3 统计处理

2 结 果
2.1 一般资料的比较
3组共纳入116例,一般情况见表1。3组之间MMSE得分有统计学差异,两两比较发现,BPSD和非BPSD组的得分皆明显低于正常组(P<0.001)。

表1 3组被试人口学资料比较
注:BPSD组、非BPSD组和正常组做单因素方差分析:*P<0.05,下同
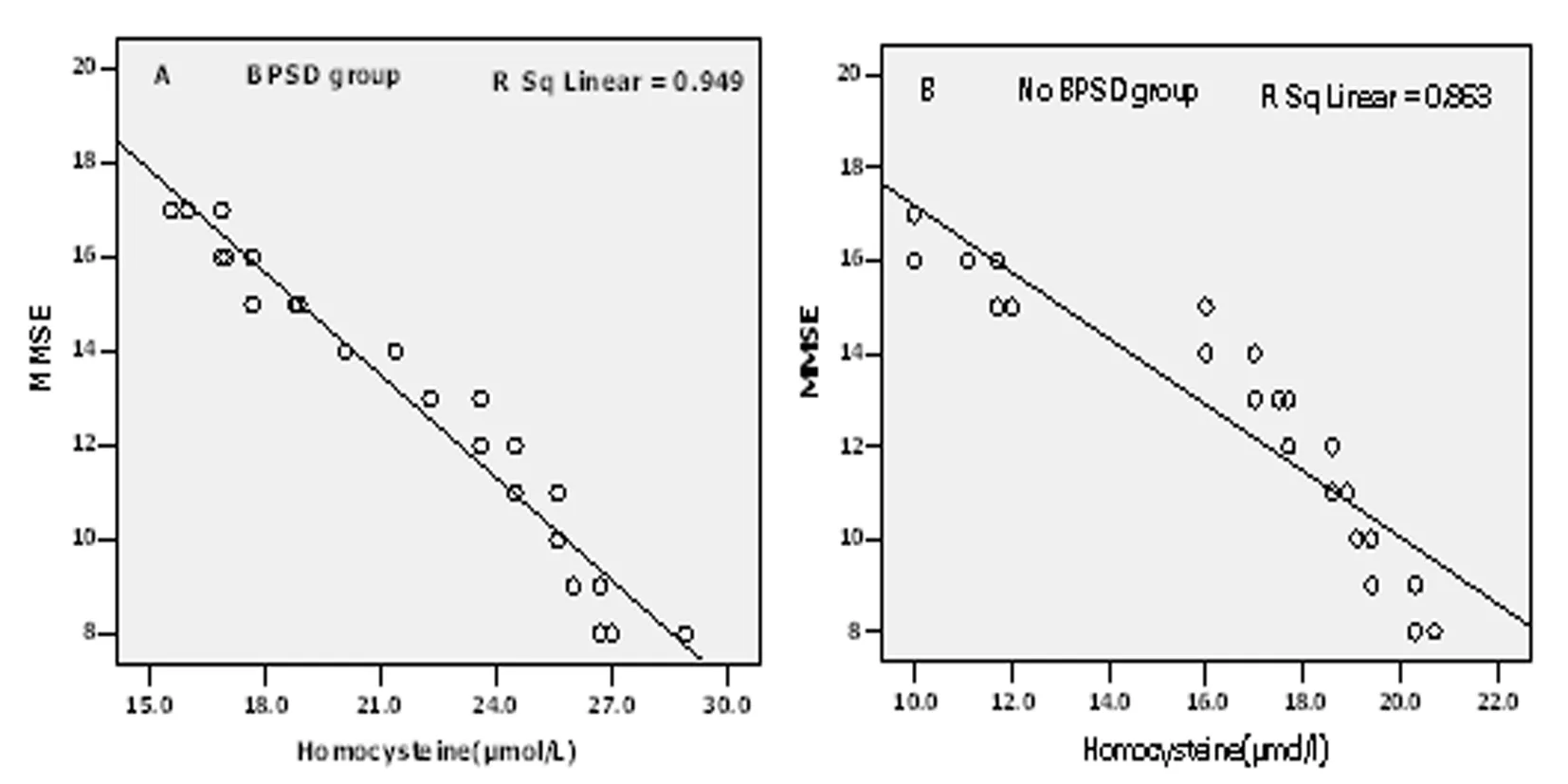
图1 阿尔茨海默病(AD)患者MMSE与Hcy之间的相关性(A:BPSD组;B:非BPSD组)
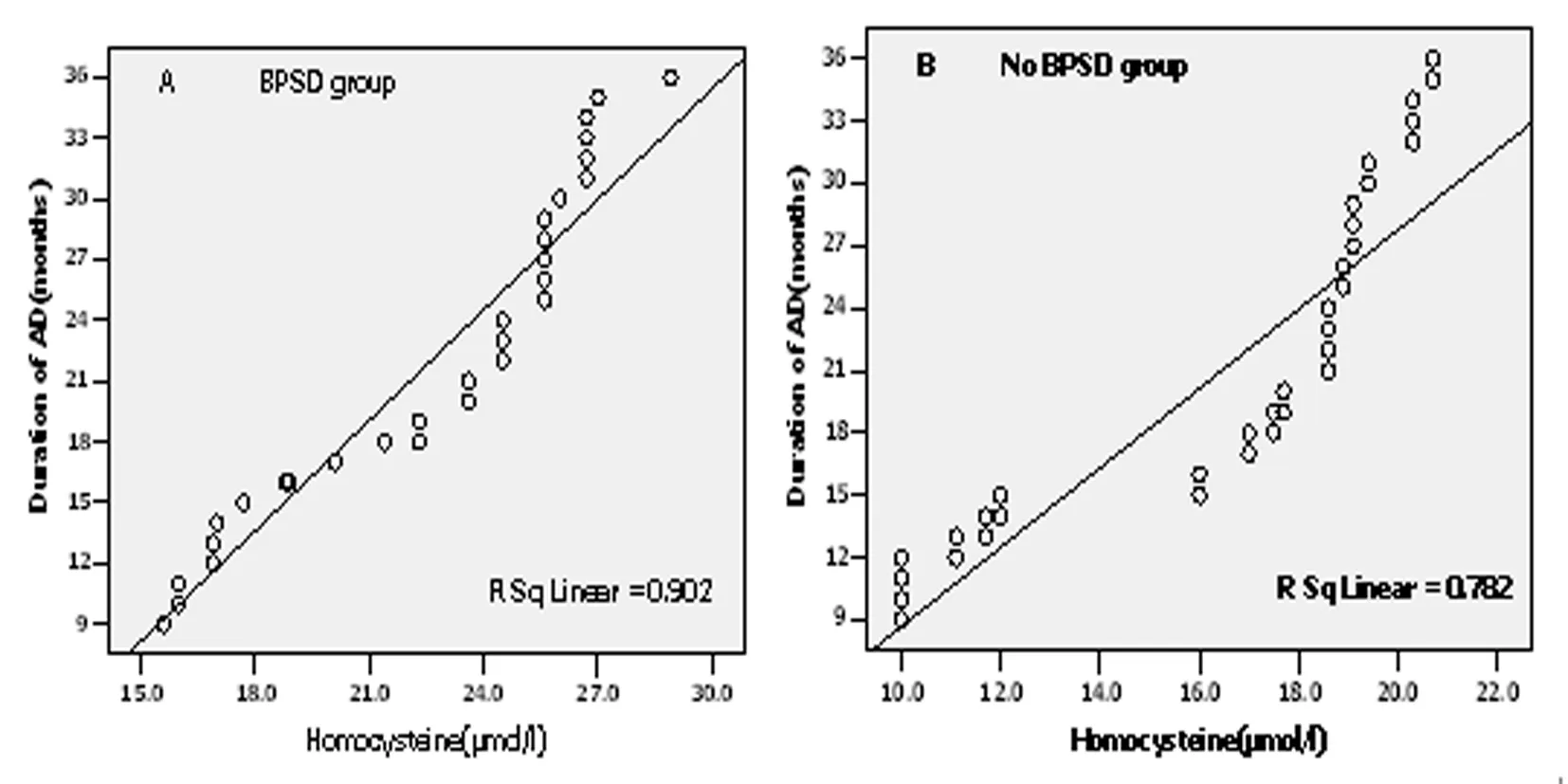
图2 阿尔茨海默病(AD)患者痴呆病程与Hcy之间的相关性(A:BPSD组;B:非BPSD组)

表2 3组血浆Hcy水平比较
2.2 血浆Hcy水平的比较
3组被试Hcy浓度之间的比较存在显著性差异(P<0.001),BPSD组和非BPSD组血浆Hcy水平较正常组明显增高,且BPSD组显著高于非BPSD组(P<0.001)。其中BPSD组中,40例全部为高Hcy血症者;非BPSD组中,有高Hcy血症者27例,占73.0%.;健康对照组未发现有高Hcy血症者;3组之间高Hcy血症检出率差异显著(P<0.001)。
2.3 Hcy与认知功能障碍(MMSE)
BPSD组40例,MMSE量表分8~17分,平均(12.50±2.91)分,非BPSD组37例,MMSE量表分8~17分,平均(12.59±2.77)分。两组之间MMSE得分无明显差异(P=0.864),分别对两组的Hcy和MMSE做相关分析,结果显示两组的血浆Hcy与MMSE得分皆呈显著负相关(rBPSD组=-0.974,P<0.001;r非BPSD组=-0.929,P<0.001),见图1。
2.4 Hcy与痴呆病程
BPSD组40例,痴呆病程9~36月,平均(21.58±7.45)月,非BPSD组37例,痴呆病程9~36月,平均(20.92±7.77)月。两组血浆Hcy分别与痴呆病程做相关分析,结果显示,两组的血浆Hcy与病程呈显著正相关(rBPSD组=0.988,P<0.001;r非BPSD组=0.974,P<0.001),见图2。
3 讨 论
Hcy是一种含硫基的氨基酸,为蛋氨酸的中间代谢产物。蛋氨酸在三磷酸腺苷(ATP)的参与下形成S-腺苷蛋氨酸,后者是一个活泼的甲基供体,并在甲基转移酶作用下变成S-腺苷同型半胱氨酸,再脱去腺苷生成同型半胱氨酸。体内Hcy主要通过下面两个途径进行分解代谢:Hcy和丝氨酸在胱硫醚β合成酶(CBS)作用下生成胱硫醚,再在胱硫醚酶作用下形成半胱氨酸,然后分解为丙酮酸、硫酸和水。在此过程中,CBS和胱硫醚酶的活性都依赖于维生素B6。Hcy可以再甲基化重新形成蛋氨酸而参加蛋氨酸循环,此过程需维生素B12、甲基转移酶、亚甲基四氢叶酸还原酶(MTHFR)、叶酸、甜菜碱及胆碱[6]。两种代谢过程各占50%左右。据此,人体内Hcy的浓度受蛋氨酸浓度、关键酶的活性及一些辅助因子的影响。一般健康成人空腹血浆tHcy范围约在10umol/L左右,但地区差异很大,且男性高于女性[5]。引起Hcy体内蓄积的原因有遗传代谢障碍和获得性代谢障碍。
血浆高Hcy水平是心脑血管病的重要危险因子。有作者根据80例临床患者以及上万例以上高Hcy血症患者的流行病学研究指出,血浆高Hcy浓度不仅是一种动脉粥样硬化性血管疾病的危险因子,所涉及的血管有冠状动脉、脑动脉以及外周动脉;而且还是使动脉、静脉形成血栓栓塞的严重危险因子[7]。血浆同型半胱氨酸的增高对神经系统的毒性机制尚不清楚,其诱发AD的可能途径为:Hcy通过激活N-甲基D-天门冬氨酸受体而具有神经细胞毒性,从而导致神经元死亡;同型半胱氨酸被转化成同型胱氨酸,而后者对神经元具有兴奋毒性作用;而且,在皮质神经元的培养中,加入淀粉样β蛋白,可致神经元对兴奋性氨基酸的易感性增高。高Hcy血症可导致动脉粥样硬化,动脉粥样硬化反过来又可使认知功能下降,导致痴呆的发生。高Hcy血症可促使氧自由基和过氧化氢生成,引起血管内皮细胞损伤和毒性作用,使患者极易患AD,如海马部位神经元对微血管病变或者缺血症状最敏感,该部表现出AD的特征性病理变化即老年斑和神经纤维的缠结。血Hcy升高,维生素B12的缺乏,可以引起其他一些代谢的异常,如S-腺苷蛋氨酸合成受损、低甲基化,均涉及一些关键的生化反应,从而导致大脑功能的异常[8]。
BPSD在大多数AD患者在疾病发展过程中的某一阶段都会出现[9],且是患者寻求住院治疗和生活质量降低的最常见原因[10]。更甚者,这些BPSD症状才是引起患者痛苦和该疾病受到挑战与给患者家庭带来负担的最大原因,而不是通常大家所认为的记忆损害[11]。此外,鉴于目前还没有明确的经过许可的治疗BPSD的药物以及其它一些可选择的药物也可能给患者带来极大的风险,所以,BPSD患者的治疗是我们正在面临的一个很大的挑战。因此,明确BPSD症状群是否与高同型半胱氨酸血症或vitB12和叶酸的缺乏存在一定的相关性有助于为伴有BPSD的AD患者找到有效的治疗方法。
既往研究发现,AD[12-13]和精神障碍[14]患者存在血浆vitB12和叶酸浓度的降低,也有一些研究探讨了血浆vitB12、叶酸的浓度与伴有BPSD的痴呆患者的关系,但均未发现明确的相关性[15-16]。目前未发现国内有关Hcy与BPSD之间相关性的报道。所以,一致认为Hcy浓度的测量是非常重要的,血浆vitB12、叶酸的浓度可能不能反应大脑中的真实状态[17]。本研究发现,BPSD组和非BPSD组血浆Hcy水平较正常组明显增高,且BPSD组显著高于非BPSD组,提示高水平血浆Hcy与AD有关,亦提示高水平血浆Hcy可能与BPSD有关。既往有关该方面的研究很少,且未发现BPSD与非BPSD两组之间Hcy浓度存在明显差异[18]。所以,本研究是首次发现Hcy浓度与BPSD之间存在一定的相关性。但是目前对高同型半胱氨酸血症是否与AD患者伴有BPSD相关仍没有一致的结论,将来需要在该方面进一步的研究来探讨结论的一致性。
研究还发现,BPSD组和非BPSD组的MMSE得分明显低于正常组,但两患者组之间无明显差异,且两组的血浆Hcy与MMSE呈显著负相关,说明血浆Hcy增高可加重AD患者的认知功能障碍,与既往报道的一致[19],但未发现MMSE与BPSD的相关性。国外近年的研究结果显示,BPSD组的MMSE得分显著低于非BPSD组,但并未发现Hcy与MMSE之间的相关性[18]。MMSE得分能反映病人认知功能损害的程度。随着MMSE得分的增加,认知功能损害的程度是加重的。这些结果提示,血浆Hcy浓度的增加会导致AD患者认知功能障碍的加重,这与既往的研究是一致的,但未发现MMSE与BPSD的相关性[19]。上述研究一致认为Hcy与认知损害是相关的[20-22]。
血浆Hcy与痴呆病程呈显著正相关,表明Hcy随着痴呆病情的进展而逐渐增高,这与既往的研究结果是一致的[23]。由于AD的病因复杂,系多因素共同作用的结果,而Hcy可能只是其因素之一,并且不是主要或原发病因,但它可促使AD的发生或AD各种病理生理损害加重,使AD病情程度加重。
本研究招募了正常人群作为正常对照组,这样尽可能排除了人体代谢的影响,我们可以更精确的比较3组被试之间的Hcy浓度差异。而国外的一些研究也把他们研究的被试仅有AD患者作为一个局限性[18]。
本研究发现,BPSD可能与Hcy有关,但未发现BPSD与认知功能障碍及痴呆病程的相关性,这可能与样本量较小及缺乏有效的BPSD评估工具有关。在今后的研究中可以扩大样本及进行纵向前瞻性研究,以进一步研究BPSD的相关影响因素。此外,可以同时结合分子遗传学方面的研究,候选基因包括MTHFR、CBS、丝氨酸甲基转移酶(SHMT)等,以及神经影像学研究,进一步揭示高水平Hcy在BPSD发病机制中的作用。
[1]孙正海,崔光成,丰宏林,等.富拉尔基区阿尔茨海默病患病率及影响因素初步研究[J].中国健康心理学杂志,2011,19(3):278-80
[2]顾曙光,蒋梦妮,季莉.安理申治疗痴呆并发行为和精神症状的疗效观察[J].中国健康心理学杂志,2013,21(6):815-6
[3]陈彩霞,吴震卿,徐清,等.喹硫平合并小剂量丙戊酸钠治疗老年期痴呆精神行为症状的研究[J].中国健康心理学杂志,2013,20(11):1631-1632
[4]张明园.精神科评定量表手册[M].长沙:湖南科学技术出版社,1998
[5]Reisberg B,Auer S R,Monteiro I M.Behavioral pathology in Alzheimer's disease(BEHAVE-AD) rating scale[J].International Psychogeriatrics,1997,8(S3):301-308
[6]Ngga K,Rajani R,Mrdh E,et al.Cobalamin,folate,methylmalonic acid,homocysteine,and gastritis markers in dementia[J].Dementia and Geriatric Cognitive Disorders,2003,16(4):269-275
[7]许海燕,陈在嘉.冠心病患者同型半胱氨酸代谢相关酶基因多态性的研究[J].中华医学杂志,1999,79(6):414-416
[8]毕胜,张昱,吴江,等.阿尔茨海默病与MTHFR基因及血浆同型半胱氨酸水平的关系[J].中华神经科杂志,2000,33(6):345-345
[9]Piccininni M,Di Carlo A,Baldereschi M,et al.Behavioral and psychological symptoms in Alzheimer's disease:Frequency and relationship with duration and severity of the disease[J].Dementia and Geriatric Cognitive Disorders,2005,19(5-6):276-281
[10]Steinberg M,Sheppard J-M,Tschanz J T,et al.The incidence of mental and behavioral disturbances in dementia:The Cache county study[J].The Journal of Neuropsychiatry and Clinical Neurosciences,2003,15(3):340-345
[11]Rymer S,Salloway S,Norton L,et al.Impaired awareness,behavior disturbance,and caregiver burden in Alzheimer disease[J].Alzheimer Disease & Associated Disorders,2002,16(4):248-253
[12]Quadri P,Fragiacomo C,Pezzati R,et al.Homocysteine,folate,and vitamin B-12 in mild cognitive impairment,Alzheimer disease,and vascular dementia[J].The American Journal of Clinical Nutrition,2004,80(1):114-122
[13]Stuerenburg H J,Mueller-Thomsen T,Methner A.Vitamin B 12 plasma concentrations in Alzheimer disease[J].Neuro Endocrinol Lett,2004,25(Suppl 3):176-177
[14]Bottiglieri T.Folate,vitamin B12,and neuropsychiatric disorders[J].Nutrition Reviews,1996,54(12):382-390
[15]Engelborghs S,Vloeberghs E,Maertens K,et al.Correlations between cognitive,behavioural and psychological findings and levels of vitamin B12 and folate in patients with dementia[J].International Journal of Geriatric Psychiatry,2004,19(4):365-370
[16]Whyte E M,Mulsant B H,Butters M A,et al.Cognitive and behavioral correlates of low vitamin Blevels in elderly patients with progressive dementia[J].The American Journal of Geriatric Psychiatry,2002,10(3):321-327
[17]Nilsson K,Gustafson L,Hultberg B,et al.Plasma homocysteine is a sensitive marker for tissue deficiency of both cobalamines and folates in a psychogeriatric population[J].Dementia and Geriatric Cognitive Disorders,1999,10(6):476-482
[18]Tabet N,Rafi H,Weaving G,et al.Behavioural and psychological symptoms of Alzheimer type dementia are not correlated with plasma homocysteine concentration[J].Dementia and Geriatric Cognitive Disorders,2006,22(5-6):432-438
[19]Mccaddon A,Hudson P,Davies G,et al.Homocysteine and cognitive decline in healthy elderly[J].Dementia and Geriatric Cognitive Disorders,2001,12(5):309-313
[20]Schafer J H,Glass T A,Bolla K I,et al.Homocysteine and cognitive function in a population‐based study of older adults[J].Journal of the American Geriatrics Society,2005,53(3):381-388
[21]Budge M M,De Jager C,Hogervorst E,et al.Total plasma homocysteine,age,systolic blood pressure,and cognitive performance in older people[J].Journal of the American Geriatrics Society,2002,50(12):2014-2018
[22]Prins N,Den Heijer T,Hofman A,et al.Homocysteine and cognitive function in the elderly:The rotterdam scan study[J].Neurology,2002,59(9):1375-1380
[23]Nilsson K,Gustafson L,Hultberg B,et al.Relation between plasma homocysteine and Alzheimer's disease[J].Dementia and Geriatric Cognitive Disorders,2002,14(1):7-12
The Correlation of Hyperhomocysteine and Behaviral and Psychological Symptoms of Dementia
Zheng Zhanjie,Chen Hong,Wang Jindong,et al
Qingdao Mental Health Center,Qingdao 266034,Shandong Province,China
Objective:To investigate the correlation between hyperhomocysteine and Behaviral and Psychological Symptoms of Dementia(BPSD).Methods:Plasma homocysteine(Hcy) was measured in 77 patients with Alzheimer disease(AD)(BPSD group of 40 cases,non-BPSD group of 37cases) and 39 normal controls.The correlation between plasma homocysteine levels and BPSD,cognitive impairment,duration of dementia were analyzed.Results:①The plasma Hcy levels were significantly higher in BPSD and non-BPSD group than that in the normal group(P<0.001),and the BPSD group was significantly higher than non-BPSD group(P<0.001).② There was a significantly correlation between Hcy levels and cognitive decline(rBPSD grou=0.974,P<0.001;rNo-BPSD grou=0.929,P<0.001) and duration of dementia(rBPSD grou=0.988,P<0.001;rNo-BPSD grou=0.974,P<0.001),but no correlation between BPSD and cognitive dysfunction and duration of dementia.Conclusion:Hyperhomocysteine may take part in the pathogenesis of BPSD.
Alzheimer disease;Behaviral and Psychological Symptoms of Dementia;Homocystenine;MMSE
* 青岛市卫生局立项课题资助项目(编号:2010-WSZD068)
R395.1,R749.1
A
1005-1252(2015)01-0004-05
10.13342/j.cnki.cjhp.2015.01.002
2014-07-07)

